13.2: Diagramas de fases - Sistemas binarios
- Page ID
- 78018
Como se explica en la Sec. 8.2, un diagrama de fases es una especie de mapa bidimensional que muestra qué fase o fases son estables bajo un conjunto dado de condiciones. Esta sección analiza algunos tipos comunes de sistemas binarios, y la Sección 13.3 describirá algunos sistemas ternarios interesantes.
13.2.1 Generalidades
Un sistema binario tiene dos componentes;\(C\) es igual\(2\), y el número de grados de libertad es\(F=4-P\). Debe haber al menos una fase, por lo que el valor máximo posible de\(F\) es 3. Dado que\(F\) no puede ser negativo, el sistema de equilibrio no puede tener más de cuatro fases.
Podemos variar independientemente la temperatura, presión y composición del sistema en su conjunto. En lugar de usar estas variables como coordenadas de un diagrama de fases tridimensional, generalmente dibujamos un diagrama de fases bidimensional que es un diagrama de temperatura-composición a una presión fija o un diagrama de presión-composición a una temperatura fija. La posición del punto del sistema en uno de estos diagramas corresponde entonces a una temperatura definida, presión y composición general. La variable de composición generalmente varía a lo largo del eje horizontal y puede ser la fracción molar, la fracción de masa o el porcentaje en masa de uno de los componentes, como se ilustrará actualmente por varios ejemplos.
La forma en que interpretamos un diagrama de fases bidimensional para obtener las composiciones de fases individuales depende del número de fases presentes en el sistema.
- Si el punto del sistema se encuentra dentro de un área monofásica del diagrama de fases, la variable de composición es la composición de esa fase única. Hay tres grados de libertad. En el diagrama de fases, el valor de cualquiera\(T\) o\(p\) ha sido fijo, por lo que hay otras dos variables intensivas independientes. Por ejemplo, en un diagrama de fases de temperatura-composición, la presión es fija y la temperatura y la composición se pueden cambiar independientemente dentro de los límites del área monofásica del diagrama.
- Si el punto del sistema está en un área bifásica del diagrama de fases, dibujamos una línea de unión horizontal de temperatura constante (en un diagrama de fases de temperatura-composición) o presión constante (en un diagrama de fases de presión-composición). Se aplica la regla de la palanca. La posición del punto en cada extremo de la línea de unión, en el límite del área bifásica, da el valor de la variable de composición de una de las fases y también el estado físico de esta fase: ya sea el estado de un área unifásica adyacente, o el estado de una fase de composición fija cuando el límite es una línea vertical. Así, un límite que separa un área bifásica para fases\(\pha\) y\(\phb\) de un área monofásica para fase\(\pha\) es una curva que describe la composición de la fase\(\pha\) como una función de\(T\) o\(p\) cuando está en equilibrio con la fase\(\phb\). La curva se llama solidus, liquidus o vaporus dependiendo de si la fase\(\pha\) es un sólido, líquido o gas.
- Un sistema binario con tres fases solo tiene un grado de libertad y no puede ser representado por un área en un diagrama de fases bidimensional. En cambio, existe una línea de límite horizontal entre áreas, con un punto especial a lo largo de la línea en el cruce de varias áreas. Las composiciones de las tres fases vienen dadas por las posiciones de este punto y los puntos en los dos extremos de la línea. La posición del punto del sistema en esta línea no especifica de manera única las cantidades relativas en las tres fases.
Los ejemplos que siguen muestran algunos de los tipos más simples de diagramas de fase conocidos para los sistemas binarios.
13.2.2 Sistemas sólidos-líquidos

Figura 13.1 Temperatura - Diagrama de fases de composición para un sistema binario que presenta un punto eutéctico.
La Figura 13.1 es un diagrama de fase temperatura-composición a una presión fija. La variable de composición\(z\B\) es la fracción molar del componente B en el sistema como un todo. Las fases mostradas son una mezcla líquida binaria de A y B, sólido puro A y sólido puro B.
El área líquida monofásica está delimitada por dos curvas, que podemos pensar ya sea como curvas de punto de congelación para el líquido o como curvas de solubilidad para los sólidos. Estas curvas comprenden el liquidus. A medida que la fracción molar de cualquiera de los componentes en la fase líquida disminuye desde la unidad, el punto de congelación disminuye. Las curvas se encuentran en el punto a, que es un punto eutéctico. En este punto, tanto el sólido A como el sólido B pueden coexistir en equilibrio con una mezcla líquida binaria. La composición en este punto es la composición eutéctica, y la temperatura aquí (denotada\(T\subs{e}\)) es la temperatura eutéctica. (“Eutéctico” viene del griego para un fácil derretimiento.) \(T\subs{e}\)es la temperatura más baja para la presión dada a la que la fase líquida es estable.
Supongamos que combinamos\(0.60\mol\)\(0.40\mol\) A y B (\(z\B=0.40\)) y ajustamos la temperatura para poner el punto del sistema en b. este punto está en el área líquida monofásica, por lo que el sistema de equilibrio a esta temperatura tiene una sola fase líquida. Si ahora colocamos el sistema en contacto térmico con un reservorio frío, el calor se transfiere fuera del sistema y el punto del sistema se mueve hacia abajo a lo largo de las isópletas (trayectoria de composición global constante) b—h. La velocidad de enfriamiento depende del gradiente de temperatura en el límite del sistema y del calor del sistema capacidad.
En el punto c de las isópletas, el punto del sistema alcanza el límite del área monofásica y está a punto de ingresar al área bifásica etiquetada como A (s) + líquido. En este punto del proceso de enfriamiento, el líquido se satura con respecto al sólido A, y el sólido A está a punto de congelarse del líquido. Hay una disminución abrupta (rotura) en la velocidad de enfriamiento en este punto, debido a que el proceso de congelación implica una disminución adicional de entalpía.
A la temperatura aún más baja en el punto d, el punto del sistema se encuentra dentro del área bifásica sólido-líquido. La línea de unión a través de este punto es la línea e—f. Las composiciones de las dos fases vienen dadas por los valores de\(z\B\) en los extremos de la línea de unión:\(x\B\sups{s}=0\) para el sólido y\(x\B\sups{l} =0.50\) para el líquido. De la regla general de palanca (Eq. 8.2.8), la relación de las cantidades en estas fases es\ begin {ecuación}\ frac {n\ sups {l}} {n\ sups {s}} =\ frac {z\ b-x\ B\ sups {s}} {x\ B\ sups {l} -z\ B} =\ frac {0.40-0} {0.50-0.40} = 4.0\ tag {13.2.1}\ end {equation} Dado que el monto total es\(n\sups{s}+n\sups{l} =1.00\mol\), los montos de las dos fases deben ser \(n\sups{s}=0.20\mol\)y\(n\sups{l} =0.80\mol\).
Cuando el punto del sistema alcanza la temperatura eutéctica en el punto g, el enfriamiento se detiene hasta que todo el líquido se congela. El sólido B se congela así como el sólido A. Durante esta parada eutéctica, existen al principio tres fases: líquido con la composición eutéctica, sólido A y sólido B. A medida que el calor continúa siendo retirado del sistema, la cantidad de líquido disminuye y las cantidades de los sólidos aumentan hasta que finalmente solo \(0.60\mol\)del sólido A y\(0.40\mol\) del sólido B están presentes. Entonces la temperatura comienza a disminuir nuevamente y el punto del sistema ingresa al área bifásica para el sólido A y el sólido B; las líneas de unión en esta área se extienden de\(z\B{=}0\) a\(z\B{=}1\).
Los diagramas de fase de temperatura y composición como este a menudo se mapean experimentalmente observando la curva de enfriamiento (temperatura en función del tiempo) a lo largo de isoplésimas de varias composiciones. Este procedimiento es el análisis térmico. Una ruptura en la pendiente de una curva de enfriamiento a una temperatura particular indica que el punto del sistema se ha movido de un área líquida monofásica a un área bifásica de líquido y sólido. Una parada de temperatura indica que la temperatura es el punto de congelación del líquido para formar un sólido de la misma composición, o bien una temperatura eutéctica.

Figura 13.2 Diagramas de fase de temperatura-composición con eutécticos individuales.
a) Dos sólidos puros y una mezcla líquida (E. W. Washburn, International Critical Tables of Numerical Data, Physics, Chemistry and Technology, Vol. IV, McGraw-Hill, Nueva York, 1928, p. 98).
b) Dos soluciones sólidas y una mezcla líquida.
La Figura 13.2 muestra dos diagramas de fase temperatura-composición con puntos eutécticos únicos. El diagrama de la izquierda es para el sistema binario de cloroformo y tetracloruro de carbono, dos líquidos que forman mezclas casi ideales. Las fases sólidas son cristales puros, como en la Fig. 13.1. El diagrama de la derecha es para el sistema plata-cobre e involucra fases sólidas que son soluciones sólidas (aleaciones sustitucionales de composición variable). El área etiquetada s\(\aph\) es una solución sólida que es principalmente plata, y s\(\bph\) es una solución sólida que es principalmente cobre. Las líneas de unión en las áreas bifásicas no terminan en una línea vertical para un componente sólido puro como lo hacen en el sistema que se muestra en el diagrama de la izquierda. Las tres fases que pueden coexistir a la temperatura eutéctica de\(\tx{1,052}\K\) son la fusión de la composición eutéctica y las dos soluciones sólidas.

Figura 13.3 Temperatura - diagrama de fases de composición para el sistema binario de\(\alpha\) -naftilamina (A) y fenol (B) en\(1\br\) (J. C. Philip, J. Chem. Soc. , 83, 814—834, 1903).
En la sección 12.5.4 se discutió la posibilidad de la aparición de un compuesto sólido cuando se enfría una mezcla líquida binaria. Un ejemplo de este comportamiento se muestra en la Fig. 13.3, en la que el compuesto sólido contiene cantidades iguales de los dos componentes\(\alpha\) -naftilamina y fenol. Las posibles fases sólidas son A puro, B puro y el compuesto sólido AB. Solo uno o dos de estos sólidos pueden estar presentes simultáneamente en un estado de equilibrio. La línea vertical en la figura en\(z\B=0.5\) representa el compuesto sólido. La temperatura en el extremo superior de esta línea es el punto de fusión del compuesto sólido,\(29\units{\(\degC\)}\). El sólido se funde congruentemente para dar un líquido de la misma composición. Un proceso de fusión con este comportamiento se denomina reacción distéctica. La curva de enfriamiento para el líquido de esta composición mostraría un alto en el punto de fusión.
El diagrama de fases de la Fig. 13.3 tiene dos puntos eutécticos. Se asemeja a dos diagramas de fase simples como la Fig. 13.1 colocados uno al lado del otro. Hay una diferencia importante: la pendiente de la curva de punto de congelación (curva liquidus) es distinta de cero en la composición de un componente puro, pero es cero en la composición de un compuesto sólido que está completamente disociado en el líquido (como se deriva teóricamente en la Sec. 12.5.4). Así, la curva de la Fig. 13.3 tiene un máximo relativo en la composición del compuesto sólido (\(z\B=0.5\)) y es redondeada allí, en lugar de tener una cúspide, como un arco románico en lugar de un arco gótico.

Figura 13.4 Temperatura - Diagrama de fases de composición para el sistema binario de H\(_2\) O y NaCl a\(1\br\). (Datos de Roger Cohen-Aad y John W. Lorimer, Cloruros de metales alcalinos y amonio en agua y agua pesada (sistemas binarios), serie de datos de solubilidad, Vol. 47, Pergamon Press, Oxford, 1991; y E. W. Washburn, Tablas críticas internacionales de datos numéricos, física, química y Tecnología, Vol. III, McGraw-Hill, Nueva York, 1928.)
Un ejemplo de un compuesto sólido que no se funde congruentemente se muestra en la Fig. 13.4. El hidrato sólido\(\ce{NaCl*2H2O}\) es\(61.9\%\) NaCl en masa. Se descompone a\(0\units{\(\degC\)}\) para formar una solución acuosa de composición\(26.3\%\) NaCl en masa y una fase sólida de NaCl anhidro. Estas tres fases pueden coexistir en equilibrio en\(0\units{\(\degC\)}\). Una transición de fase como esta, en la que un compuesto sólido se transforma en un líquido y otro sólido diferente, se denomina fusión incongruente o peritéctica, y el punto en el diagrama de fases a esta temperatura en la composición del líquido es un punto peritéctico.
La Figura 13.4 muestra que hay otras dos temperaturas a las que tres fases pueden estar presentes simultáneamente:\(-21\units{\(\degC\)}\), donde las fases son hielo, la solución en su punto eutéctico, y el hidrato sólido; y\(109\units{\(\degC\)}\), donde las fases son H\(_2\) O gaseosas, una solución de\(28.3\%\) NaCl de composición por masa, y NaCl sólido. Tenga en cuenta que ambos segmentos del límite derecho del área de solución monofásica tienen pendientes positivas, lo que significa que las solubilidades del hidrato sólido y la sal anhidra aumentan con el aumento de la temperatura.
13.2.3 Líquidos parcialmente miscibles
Cuando dos líquidos que son parcialmente miscibles se combinan en ciertas proporciones, se produce la separación de fases (Sec. 11.1.6). Dos fases líquidas en equilibrio entre sí se denominan fases conjugadas. Obviamente las dos fases deben tener diferentes composiciones o serían idénticas; la diferencia se llama brecha de miscibilidad. Un sistema binario con dos fases tiene dos grados de libertad, de manera que a una temperatura y presión dadas cada fase conjugada tiene una composición fija.

Figura 13.5 Temperatura - Diagrama de fases de composición para el sistema binario de acetato de metilo (A) y disulfuro de carbono (B) en\(1\br\) (datos de P. Ferroni y G. Spinolo, Int. DATOS Ser., Sel. Mezclas de Datos, Ser. A, 70, 1974). Todas las fases son líquidas. El círculo abierto indica el punto crítico.
La dependencia típica de una brecha de miscibilidad de la temperatura se muestra en la Fig. 13.5. La brecha de miscibilidad (la diferencia de composiciones en los límites izquierdo y derecho del área bifásica) disminuye a medida que aumenta la temperatura hasta que a la temperatura superior del consoluto, también llamada temperatura crítica superior de la solución, la brecha desaparece. El punto al máximo de la curva límite del área bifásica, donde la temperatura es la temperatura del consoluto superior, es el punto consoluto o punto crítico. En este punto, las dos fases líquidas se vuelven idénticas, así como las fases líquida y gaseosa se vuelven idénticas en el punto crítico de una sustancia pura. Se observa opalescencia crítica (Sec. 8.2.3) en las proximidades de este punto, causada por grandes fluctuaciones de composición local. A temperaturas en y por encima del punto crítico, el sistema es una mezcla líquida binaria única.
Supongamos que combinamos el componente A (acetato\(6.0\mol\) de metilo) y\(4.0\mol\) del componente B (disulfuro de carbono) en un recipiente cilíndrico y ajustamos la temperatura a\(200\K\). La fracción molar global de B es\(z\B=0.40\). El punto del sistema está en el punto a en la región bifásica. A partir de las posiciones de los puntos b y c en los extremos de la línea de unión a través del punto a, encontramos que las dos capas líquidas tienen composiciones\(x\B\aph=0.20\) y\(x\B\bph=0.92\). Dado que el disulfuro de carbono es el más denso de los dos líquidos puros, la capa inferior es la fase\(\phb\), la capa que es más rica en disulfuro de carbono. Según la regla de palanca, la relación de las cantidades en las dos fases viene dada por\ begin {ecuación}\ frac {n\ bph} {n\ aph} =\ frac {z\ b-x\ B\ aph} {x\ B\ bph-z\ B} =\ frac {0.40-0.20} {0.92-0.40} = 0.38\ tag {13.2.2}\ ecuación final} Combinar este valor con nos\(n\aph+n\bph=10.0\mol\) da\(n\aph=7.2\mol\) y\(n\bph=2.8\mol\).
Si gradualmente agregamos más disulfuro de carbono al recipiente mientras agitamos suavemente y mantenemos la temperatura constante, el punto del sistema se mueve hacia la derecha a lo largo de la línea de unión. Dado que los extremos de esta línea de empate tienen posiciones fijas, ninguna fase cambia su composición, pero la cantidad de fase\(\phb\) aumenta a expensas de la fase\(\pha\). La interfaz líquido-líquido se mueve hacia arriba en el recipiente hacia la parte superior de la columna de líquido hasta que, en la composición general\(z\B=0.92\) (punto c), solo hay una fase líquida.
Ahora supongamos que el punto del sistema está de vuelta en el punto a y elevamos la temperatura manteniendo constante la composición general en\(z\B=0.40\). El punto del sistema sube las isópletas a-d. El diagrama de fases muestra que la relación\((z\B-x\B\aph)/(x\B\bph-z\B)\) disminuye durante este cambio. Como resultado, la cantidad de fase\(\pha\) aumenta, la cantidad de fase\(\phb\) disminuye y la interfaz líquido-líquido se mueve hacia abajo hacia el fondo del recipiente hasta que en\(217\K\) (punto d) nuevamente hay una sola fase líquida.
13.2.4 Sistemas líquido-gas con mezclas líquidas ideales

Figura 13.6 Diagramas de fases para el sistema binario de tolueno (A) y benceno (B). Las curvas se calculan a partir de las ecuaciones 13.2.6 y 13.2.7 y las presiones de vapor de saturación de los líquidos puros.
(a) Presión: diagrama de composición en\(T=340\K\).
(b) Diagrama de temperatura-composición en\(p=1\br\).
El tolueno y el benceno forman mezclas líquidas que son prácticamente ideales y obedecen de cerca la ley de Raoult para la presión parcial. Para el sistema binario de estos componentes, podemos usar las presiones de vapor de los líquidos puros para generar las curvas liquidus y vaporus del diagrama de fases presión-composición y temperatura-composición. Los resultados se muestran en la Fig. 13.6. La variable de composición\(z\A\) es la fracción molar global del componente A (tolueno).
Las ecuaciones necesarias para generar las curvas se pueden derivar de la siguiente manera. Considera una mezcla líquida binaria de componentes A y B y composición de fracción molar\(x\A\) que obedece la ley de Raoult para presión parcial (Ec. 9.4.2):\ begin {ecuación} p\ A = x\ A p\ A^*\ qquad p\ B = (1-x\ A) p\ B^*\ tag {13.2.3}\ end {ecuación} Estrictamente hablando, la ley de Raoult se aplica a un sistema líquido-gas mantenido a una presión constante por medio de un tercer componente gaseoso,\(p\A^*\) y\(p\B^*\) son las presiones de vapor de los componentes líquidos puros a esta presión y la temperatura del sistema. Sin embargo, cuando una fase líquida se equilibre con una fase gaseosa, la presión parcial de un constituyente del líquido es prácticamente independiente de la presión total (Sec. 12.8.1), por lo que es una buena aproximación aplicar las ecuaciones a un sistema binario líquido-gas y tratar\(p\A^*\) y \(p\B^*\)como funciones solamente de\(T\).
Cuando el sistema binario contiene una fase líquida y una fase gaseosa en equilibrio, la presión es la suma de\(p\A\) y\(p\B\), que a partir de la Ec. 13.2.3 viene dada por\ begin {recopilar}\ s {\ begin {split} p & = x\ A p\ A^* + (1-x\ A) p\ B^*\ cr & = p\ B^* + (p\ A^*-P\ B^*) x\ A\ end {split}}\ tag {13.2.4}\ cond {( \(C{=}2\), mezcla líquida ideal)}\ end {recoger} donde\(x\A\) está la fracción molar de A en la fase líquida. La ecuación 13.2.4 muestra que en el sistema bifásico,\(p\) tiene un valor entre\(p\A^*\) y\(p\B^*\), y que si\(T\) es constante,\(p\) es una función lineal de\(x\A\). La composición de la fracción molar del gas en el sistema bifásico viene dada por\ begin {ecuación} y\ A =\ frac {p\ A} {p} =\ frac {x\ A p\ A^*} {p\ B^* + (p\ A^*-p\ B^*) x\ A}\ tag {13.2.5}\ end {ecuación}
Un sistema binario bifásico tiene dos grados de libertad. En un dado\(T\) y\(p\), cada fase debe tener una composición fija. Podemos calcular la composición líquida reordenando la Eq. 13.2.4:\ begin {recoger}\ s {x\ A =\ frac {p-p\ B^*} {p\ a^*-p\ B^*}}\ tag {13.2.6}\ cond {(\(C{=}2\), mezcla líquida ideal)}\ end {reunir} La composición del gas viene dada entonces por\ begin {recopilar}\ s {\ begin {split y}\ A & =\ frac {p\ A} {p} =\ frac {x\ A p\ A^*} {p}\ cr & amp; =\ izquierda (\ frac {p-p\ B^*} {p\ a^*-p\ B^*}\ derecha)\ frac {p\ A^*} {p}\ end {split}}\ tag {13.2.7}\ cond {(\(C{=}2\), mezcla líquida ideal)}\ end {reunir}
Si conocemos\(p\A^*\) y\(p\B^*\) como funciones de\(T\), podemos usar las ecuaciones 13.2.6 y 13.2.7 para calcular las composiciones para cualquier combinación de\(T\) y\(p\) en la que puedan coexistir las fases líquida y gaseosa, y así construir un diagrama de fases presión-composición o temperatura-composición.
En la Fig. 13.6 (a), la curva liquidus muestra la relación entre\(p\) y\(x\A\) para fases líquidas y gaseosas equilibradas a constante\(T\), y la curva de vapor muestra la relación entre\(p\) y\(y\A\) bajo estas condiciones. Vemos que\(p\) es una función lineal de\(x\A\) pero no de\(y\A\).
De manera similar, la curva liquidus de la Fig. 13.6 (b) muestra la relación entre\(T\) y\(x\A\), y la curva de vapor muestra la relación entre\(T\) y\(y\A\), para fases líquidas y gaseosas equilibradas a constante\(p\). Ninguna curva es lineal.

Figura 13.7 Superficies liquidus y vaporus para el sistema binario de tolueno (A) y benceno. Las secciones transversales a través de la región bifásica se dibujan a temperaturas constantes de\(340\K\)\(370\K\) y y a presiones constantes de\(1\br\) y\(2\br\). Dos de las secciones transversales se cruzan en una línea de unión en\(T=370\K\) y\(p=1\br\), y las otras secciones transversales están rayadas en la dirección de las líneas de unión.
Una curva de liquidus también se denomina curva de punto de burbuja o curva de punto de ebullición. Otros nombres para una curva de vapor son curva de punto de condensación y curva de condensación. Estas curvas son en realidad secciones transversales de superficies liquidus y vaporus en un diagrama tridimensional\(T\) —\(p\) — de\(z\A\) fases, como se muestra en la Fig. 13.7. En esta figura, la superficie liquidus está a la vista en la parte delantera y la superficie vaporosa se oculta detrás de ella.
13.2.5 Sistemas líquido-gas con mezclas líquidas no ideal
La mayoría de las mezclas líquidas binarias no se comportan idealmente. La situación más común son las desviaciones positivas de la ley de Raoult. (En el modelo molecular de Sec. 11.1.5, las desviaciones positivas corresponden a un valor menos negativo de\(k\subs{AB}\) que el promedio de\(k\subs{AA}\) y\(k\subs{BB}\).) Algunas mezclas, sin embargo, tienen interacciones específicas A-B, como la solvatación o asociación molecular, que impiden la mezcla aleatoria de las moléculas de A y B, y el resultado son entonces desviaciones negativas de la ley de Raoult. Si las desviaciones de la ley de Raoult, ya sean positivas o negativas, son lo suficientemente grandes, la curva liquidus a temperatura constante exhibe un máximo o mínimo y resultados de comportamiento azeotrópico.

Figura 13.8 Sistema binario de metanol (A) y benceno a\(45\units{\(\degC\)}\) (Hossein Toghiani, Rebecca K. Toghiani, y Dabir S. Viswanath, J. Chem. Ing. Data, 39, 63—67, 1994).
a) Presiones parciales y presión total en fase gaseosa equilibradas con mezclas líquidas. Las líneas discontinuas indican el comportamiento legal de Raoult.
(b) Diagrama de fases de presión-composición en\(45\units{\(\degC\)}\). Círculo abierto: punto azeotrópico en\(z\A=0.59\) y\(p=60.5\units{kPa}\).
La Figura 13.8 muestra el comportamiento azeotrópico del sistema binario metanol-benceno a temperatura constante. En la Fig. 13.8 (a), se representan gráficamente las presiones parciales experimentales en una fase gaseosa equilibrada con la mezcla líquida no ideal en función de la composición líquida. Las presiones parciales de ambos componentes presentan desviaciones positivas de la ley de Raoult, consistentes con la afirmación de la Sec. 12.8.2 de que si un constituyente de una mezcla líquida binaria presenta desviaciones positivas de la ley de Raoult, con solo un punto de inflexión en la curva de fugacidad versus fracción molar, la otro constituyente también tiene desviaciones positivas de la ley de Raoult. La presión total (igual a la suma de las presiones parciales) tiene un valor máximo mayor que la presión de vapor de cualquiera de los componentes puros. La curva de\(p\) versus\(x\A\) se convierte en la curva liquidus del diagrama de fases presión-composición mostrado en la Fig. 13.8 (b). Los puntos en la curva de vapor se calculan a partir de\(p=p\A/y\A\).
En la práctica, los datos necesarios para generar las curvas liquidus y vaporus de un sistema binario no ideal se obtienen generalmente permitiendo que las mezclas líquidas de diversas composiciones hiervan en un equilibrio aún a una temperatura o presión fijas. Cuando las fases líquida y gaseosa se han equilibrado, se retiran muestras de cada una para su análisis. Las presiones parciales mostradas en la Fig. 13.8 (a) se calcularon a partir de las composiciones experimentales en fase gaseosa con las relaciones\(p\A=y\A p\) y\(p\B=p-p\A\).
Si la curva liquidus a temperatura constante tiene una presión máxima en una composición líquida que no corresponde a uno de los componentes puros, como es el caso del sistema metanol-benceno, entonces las fases líquida y gaseosa son mezclas de composiciones idénticas a esta presión. Este comportamiento se dedujo al final de la Sec. 12.8.3. En el diagrama de fases presión-composición, las curvas liquidus y vaporus tienen máximos a esta presión, y las dos curvas coinciden en un punto azeotrópico. Un sistema binario con desviaciones negativas de la ley de Raoult puede tener una curva liquidus isotérmica con una presión mínima a una composición de mezcla particular, en cuyo caso las curvas liquidus y vaporus coinciden en un punto azeotrópico en este mínimo. El fenómeno general en el que las mezclas líquidas y gaseosas equilibradas tienen composiciones idénticas se denomina azeotropía, y el líquido con esta composición es una mezcla azeotrópica o azeótropo (griego: hierve sin cambios). Una mezcla azeotrópica se vaporiza como si fuera una sustancia pura, experimentando una transición de fase de equilibrio a un gas de la misma composición.

Figura 13.9 Superficies liquidus y vaporus para el sistema binario de metanol (A) y benceno (Hossein Toghiani, Rebecca K. Toghiani, y Dabir S. Viswanath, J. Chem. Ing. Data, 39, 63—67, 1994). Las secciones transversales se rayan en la dirección de las líneas de unión. La curva discontinua es la curva azeotrópica vapor-presión.
Si las curvas liquidus y vaporus presentan un máximo en un diagrama de fases presión-composición, entonces exhiben un mínimo en un diagrama de fases de temperatura-composición. Esta relación se explica para el sistema metanol-benceno por las superficies tridimensionales liquidus y vaporus dibujadas en la Fig. 13.9. En este diagrama, la superficie vaporosa se oculta detrás de la superficie liquidus. La sección transversal rayada en la parte frontal de la figura es la misma que el diagrama de presión-composición de la figura 13.8 (b), y la sección transversal rayada en la parte superior de la figura es un diagrama de fases de temperatura-composición en el que el sistema exhibe un azeótropo de ebullición mínima.
Un sistema binario que contiene una mezcla azeotrópica en equilibrio con su vapor tiene dos especies, dos fases, y una relación entre variables intensivas:\(x\A =y\A\). El número de grados de libertad es entonces\(F = 2+s-r-P = 2+2-1-2 = 1\); el sistema es univariante. A una temperatura dada, el azeótropo puede existir a una sola presión y tener una sola composición. A medida que\(T\) cambia, también lo hacen\(p\) y\(z\A\) a lo largo de una curva azeotrópica vapor-presión como se ilustra por la curva discontinua en la Fig. 13.9.
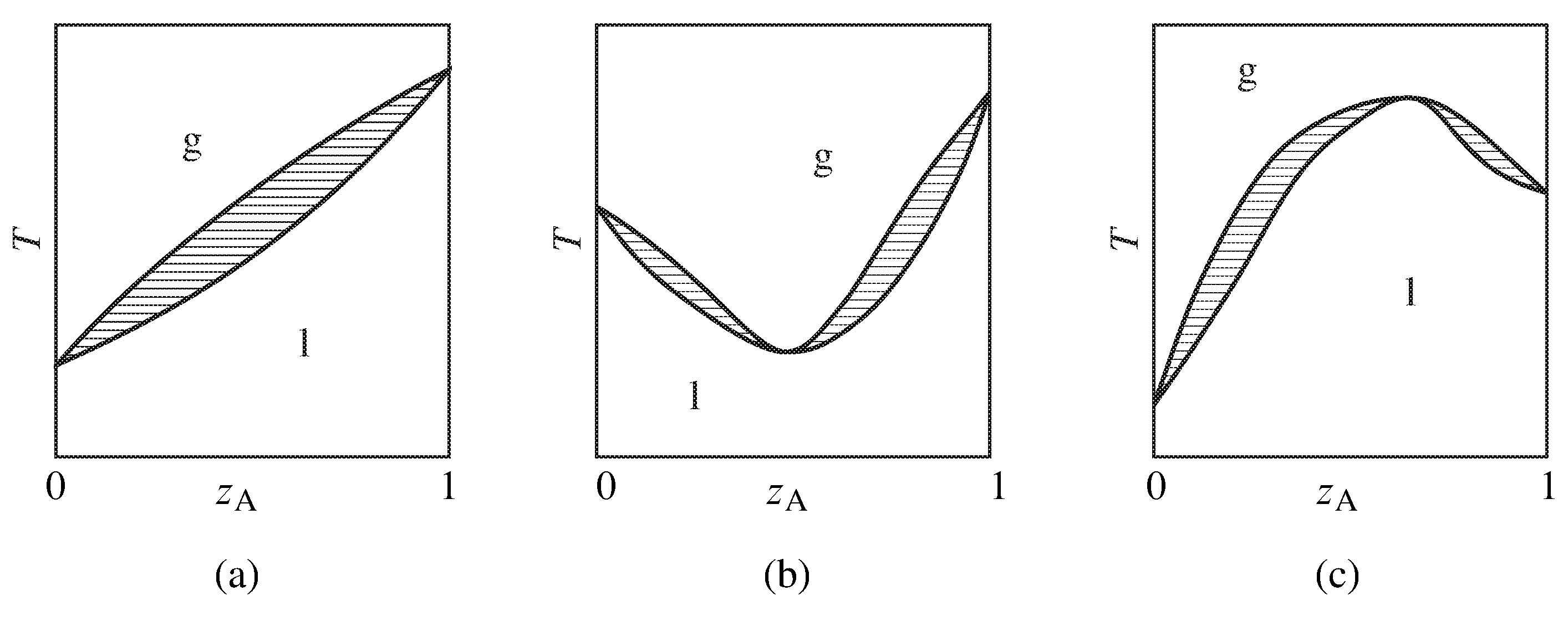
Figura 13.10 Diagramas de fase de temperatura - composición de sistemas binarios que muestran (a) no azeotropía, (b) un azeótropo de ebullición mínima y (c) un azeótropo de ebullición máxima. Solo se etiquetan las áreas monofásicas; las áreas bifásicas se rayan en la dirección de las líneas de unión.
La Figura 13.10 resume la apariencia general de algunos diagramas de fase de temperatura-composición relativamente simples de sistemas binarios. Si el sistema no forma un azeótropo (comportamiento zeotrópico), la fase gaseosa equilibrada es más rica en un componente que la fase líquida en todas las composiciones líquidas, y la mezcla líquida se puede separar en sus dos componentes por destilación fraccionada. El gas en equilibrio con una mezcla azeotrópica, sin embargo, no está enriquecido en ninguno de los componentes. La destilación fraccionada de un sistema con un azeótropo conduce a la separación en un componente puro y la mezcla azeotrópica.

Figura 13.11 Temperatura: diagramas de fase de composición de sistemas binarios con líquidos parcialmente miscibles que muestran (a) la capacidad de separarse en componentes puros por destilación fraccionada, (b) un azeótropo de ebullición mínima y (c) ebullición a una temperatura más baja que el punto de ebullición de cualquiera de las dos componente puro. Solo se etiquetan las áreas monofásicas; las áreas bifásicas se rayan en la dirección de las líneas de unión.
El comportamiento más complicado se muestra en los diagramas de fase de la Fig. 13.11. Se trata de sistemas binarios con líquidos parcialmente miscibles en los que se alcanza el punto de ebullición antes de que se pueda observar una temperatura superior del consoluto.
13.2.6 Sistemas de gas sólido

Figura 13.12 Diagrama de fases de presión-composición para el sistema binario de CuSO\(_4\) (A) y H\(_2\) O (B) a\(25\units{\(\degC\)}\) (Thomas S. Logan, J. Chem. Educ. , 35, 148—149, 1958; E. W. Washburn, Tablas Críticas Internacionales de Datos Numéricos, Física, Química y Tecnología, Vol. VII, McGraw-Hill, Nueva York, 1930, p. 263).
Como ejemplo de un sistema de dos componentes con fases sólidas y gaseosas equilibradas, considere los componentes\(\ce{CuSO4}\) y\(\ce{H2O}\), denotados A y B respectivamente. En el diagrama de fases presión-composición mostrado en la Fig. 13.12, la variable composición\(z\B\) es como de costumbre la fracción molar del componente B en el sistema en su conjunto.
La sal anhidra y sus hidratos (compuestos sólidos) forman la serie de sólidos\(\ce{CuSO4}\),\(\ce{CuSO4*H2O}\),\(\ce{CuSO4*3H2O}\), y\(\ce{CuSO4*5H2O}\). En el diagrama de fases estas fórmulas se abrevian A, AB\(_3\), AB y AB\(_5\). Los siguientes equilibrios de disociación (equilibrios de deshidratación) son posibles:\ begin {align*}\ ce {CuSO4*H2O}\ tx {(s)} &\ flechas\ ce {CuSO4}\ tx {(s)} +\ ce {H2O}\ tx {(g)}\ cr\ ce {1/2CuSO4*3H2O}\ tx {(s)} &\ flechas\ ce {1/2CuSO4*H2O}\ tx {(s)} +\ ce {H2O}\ tx {(g)}\ cr\ ce {1/2CuSO4*5H2O}\ tx {(s)} &\ flechas\ ce {1/2CuSO4*3 H2O}\ tx {(s)} +\ ce {H2O}\ tx {(g)}\ end {align*} Los equilibrios se escriben arriba con coeficientes que hacen que el coeficiente de H\(_2\) O (g) sea unidad. Cuando uno de estos equilibrios se establece en el sistema, hay dos componentes y tres fases; la regla de fase entonces nos dice que el sistema es univariante y la presión tiene solo un valor posible a una temperatura dada. Esta presión se llama la presión de disociación del hidrato superior.
Las presiones de disociación de los tres hidratos se indican mediante líneas horizontales en la Fig. 13.12. Por ejemplo, la presión de disociación de\(\ce{CuSO4*5H2O}\) es\(1.05\timesten{-2}\units{\(\br\)}\). A la presión de cada línea horizontal, el sistema de equilibrio puede tener una, dos o tres fases, con composiciones dadas por las intersecciones de la línea con líneas verticales. Un cuarto equilibrio trifásico se muestra en\(p=3.09\timesten{-2}\units{\(\br\)}\); este es el equilibrio entre el sólido\(\ce{CuSO4*5H2O}\), la solución acuosa saturada de este hidrato y el vapor de agua.
Considerar la constante de equilibrio termodinámico de una de las reacciones de disociación. A las bajas presiones mostradas en el diagrama de fases, las actividades de los sólidos son prácticamente unitarias y la fugacidad del vapor de agua es prácticamente la misma que la presión, por lo que la constante de equilibrio es casi exactamente igual a\(p\subs{d}/p\st\), donde\(p\subs{d}\) está la presión de disociación del hidrato superior en la reacción. Así, un hidrato no puede existir en equilibrio con el vapor de agua a una presión por debajo de la presión de disociación del hidrato porque la disociación sería espontánea en estas condiciones. Por el contrario, la sal formada por la disociación de un hidrato no puede existir en equilibrio con el vapor de agua a una presión superior a la presión de disociación porque la hidratación sería espontánea.
Si el sistema contiene aire seco como componente gaseoso adicional y se establece uno de los equilibrios de disociación, la presión parcial\(p\subs{H\(_2\) O}\) de H\(_2\) O es igual (aproximadamente) a la presión\(p\subs{d}\) de disociación del hidrato superior. Las declaraciones anteriores respecto a la disociación e hidratación dependen ahora del valor de\(p\subs{H\(_2\) O}\). Si se coloca un hidrato en el aire en el que\(p\subs{H\(_2\) O}\) es menor que\(p\subs{d}\), la deshidratación es espontánea; este fenómeno se llama eflorescencia (latín: florecimiento). Si\(p\subs{H\(_2\) O}\) es mayor que la presión de vapor de la solución saturada del hidrato más alto que se pueda formar en el sistema, la sal anhidra y cualquiera de sus hidratos absorberán espontáneamente el agua y formarán la solución saturada; esto es delicuescencia (latín: volviéndose fluido ).
Si el sistema de equilibrio de dos componentes contiene sólo dos fases, es bivariante correspondiente a una de las áreas de la Fig. 13.12. Aquí se pueden variar tanto la temperatura como la presión. En el caso de áreas etiquetadas con dos fases sólidas, la presión tiene que ser aplicada a los sólidos por un fluido (distinto de H\(_2\) O) que no se considera parte del sistema.
13.2.7 Sistemas a alta presión

Figura 13.13 Comportamiento presión-temperatura-composición en el sistema binario heptano-etano (W. B. Kay, Ind. Ing. Chem. , 30, 459—465, 1938). Los círculos abiertos son puntos críticos; la curva discontinua es la curva crítica. La línea discontinua a—b ilustra la condensación retrógrada en\(450\K\).
Los diagramas binarios de fase comienzan a verse diferentes cuando la presión es mayor que la presión crítica de cualquiera de los componentes puros. Se han observado diversos tipos de comportamiento en esta región. Un tipo común, el que se encuentra en el sistema binario de heptano y etano, se muestra en la Fig. 13.13. Esta figura muestra secciones de un diagrama de fases tridimensional a cinco temperaturas. Cada sección es un diagrama de fases presión-composición a constante\(T\). Las áreas bifásicas se rayan en la dirección de las líneas de unión. En el extremo izquierdo de cada línea de empate (a baja\(z\A\)) hay una curva vaporosa, y en el extremo derecho hay una curva liquidus. La curva de presión de vapor del etano puro (\(z\A{=}0\)) termina en el punto crítico del etano en\(305.4\K\); entre este punto y el punto crítico del heptano en\(540.5\K\), hay una curva crítica continua, que es el lugar de los puntos críticos en los que se convierten las mezclas de gas y líquido idéntico en composición y densidad.
Considere lo que sucede cuando el punto del sistema está en el punto a de la Fig. 13.13 y la presión se incrementa luego por compresión isotérmica a lo largo de la línea a—b. El punto del sistema se mueve desde el área para una fase gaseosa al área bifásica gas—líquido y luego hacia el área de fase gaseosa nuevamente. Este curioso fenómeno, la condensación seguida de la vaporización, se denomina condensación retrógrada.
Bajo algunas condiciones, un aumento isobárico de\(T\) puede resultar en vaporización seguida de condensación; esto es vaporización retrógrada.

Figura 13.14 Comportamiento presión-temperatura-composición en el sistema binario xenón-helio (J. de Swann Arons y G. A. M. Diepen, J. Chem. Phys. , 44, 2322—2330, 1966). Los círculos abiertos son puntos críticos; la curva discontinua es la curva crítica.
Un tipo diferente de comportamiento a alta presión, el que se encuentra en el sistema xenón-helio, se muestra en la Fig. 13.14. Aquí, la curva crítica comienza en el punto crítico del componente menos volátil (xenón) y continúa a temperaturas y presiones más altas que la temperatura y presión críticas de cualquiera de los componentes puros. La región bifásica a presiones por encima de esta curva crítica a veces se dice que representa el equilibrio gas—gas, o inmiscibilidad gas—gas, porque normalmente no consideraríamos que un líquido exista más allá de los puntos críticos de los componentes puros. Por supuesto, las fases coexistentes en esta región bifásica no son gases en el sentido ordinario de ser fluidos tenues, sino fluidos de alta presión de densidades similares a líquidos. Si queremos llamar a ambas fases gases, entonces tenemos que decir que las sustancias gaseosas puras a alta presión no necesariamente se mezclan espontáneamente en todas las proporciones como lo hacen a presiones ordinarias.
Si la presión de un sistema se incrementa isotérmicamente, eventualmente aparecerán fases sólidas; estas no se muestran en las Figs. 13.13 y Fig. 13.14.


