11.10: Teoría de Colisiones
- Page ID
- 72160
La Teoría de Colisiones fue introducida por primera vez en la década de 1910 por Max Trautz (Trautz, 1916) y William Lewis (Lewis, 1918) para tratar de explicar las magnitudes de las constantes de velocidad en términos de la frecuencia de colisiones moleculares, la energía colisional y las orientaciones relativas de las moléculas involucradas en la colisión .
La velocidad de una reacción, de acuerdo con la teoría de colisiones, se puede expresar como
\[ \text{rate} = Z_{ab} F \label{majorrate}\]
donde\(Z_{AB}\) es la frecuencia de colisiones entre las moléculas\(A\) e\(B\) involucradas en la reacción, y\(F\) es la fracción de esas colisiones que conducirán a una reacción. El factor\(F\) tiene dos contribuyentes importantes, la energía de la colisión y la orientación de las moléculas cuando chocan. El primer término,\(Z_{AB}\), puede tomarse de la teoría molecular cinética discutida en el Capítulo 2.
\[ Z_{AB} = \left( \dfrac{8k_BT}{\pi \mu} \right)^{1/2} \sigma_{AB} [A][B] \label{collision}\]
Donde el primer término es la velocidad relativa promedio en la que\(\mu\) se encuentra la masa reducida del sistema de colisión A-B,\(\sigma_{AB}\) es la sección transversal colisional,\([A]\) y\([B]\) son las concentraciones de\(A\) y\(B\).
El factor\(F\) depende de la energía de activación. Suponiendo una distribución de energías de Boltzmann (o similar a Boltzmann), la fracción de colisiones moleculares que tendrá suficiente energía para superar la barrera de activación viene dada por
\[ F= e^{-E_a/RT} \label{arr}\]
Combinando las Ecuaciones\ ref {colisión} y\ ref {arr}, la velocidad de la reacción (Ecuación\ ref {majorrate}) se predice por
\[ \text{rate} = \left( \dfrac{8k_BT}{\pi \mu} \right) ^{1/2} \sigma_{AB} e^{-E_a/RT} [A][B] \]
Entonces, si la ley de tarifas se puede expresar como una ley de tasa de segundo orden
\[\text{rate} = k [A][B]\]
es claro que la constante de velocidad\(k\) viene dada por
\[k=\left( \dfrac{8k_BT}{\pi \mu} \right)^{1/2} \sigma_{AB} e^{-E_a/RT}\]
En comparación, la teoría predice que la forma del prefactor Arrhenius es
\[A= \left( \dfrac{8k_BT}{\pi \mu} \right)^{1/2} \sigma_{AB}\]
Cabe señalar que la teoría de colisiones parece aplicarse únicamente a las reacciones bimoleculares, ya que se necesitan dos moléculas para colisionar. Pero hay muchas reacciones que tienen leyes de tarifas de primer orden, pero son iniciadas por pasos bimoleculares en los mecanismos. (Los mecanismos de reacción formarán gran parte de la discusión en el Capítulo 12.) Consideremos como ejemplo, la descomposición de\(N_2O_5\), que sigue a la reacción
\[2 N_2O_5 \rightarrow 4 NO_2 + O_2\]
Bajo cierto conjunto de condiciones, se observan las siguientes concentraciones en función del tiempo.
| tiempo (s) | \([N_2O_5]\)(M) | \([NO_2]\)(M) | \([O_2]\)(M) |
|---|---|---|---|
| 0 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0260 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0000 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0000 |
| 100 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0219 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0081 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0016 |
| 200 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0185 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0150 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0030 |
| 300 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0156 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0207 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0041 |
| 400 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0132 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0256 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0051 |
| 500 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0111 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0297 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0059 |
| 600 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0094 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0332 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0066 |
| 700 | \ ([N_2O_5]\) (M)” nowrap="nowrap” style="height:19px; ">0.0079 | \ ([NO_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0361 | \ ([O_2]\) (M)” nowrap="nowrap” style="height:19px; ">0.0072 |
Gráficamente, estos datos se ven de la siguiente manera:
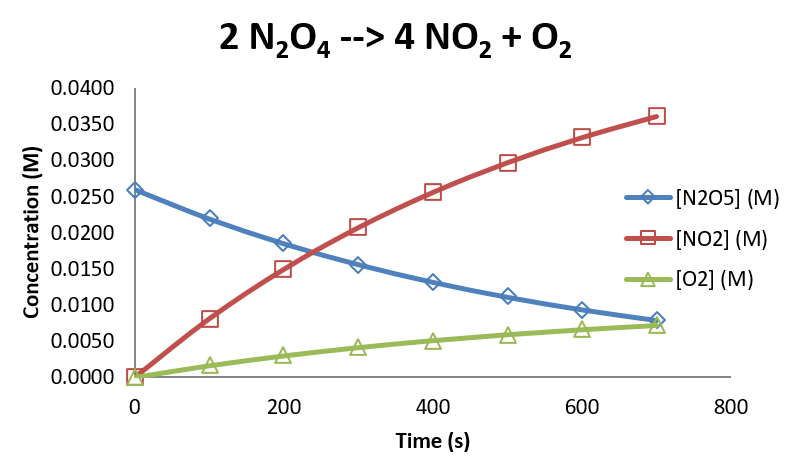
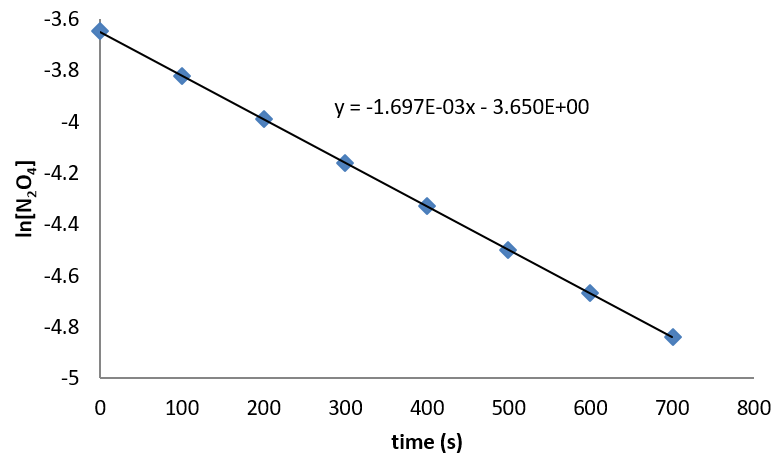
Los datos para N 2 O 5 pueden analizarse empíricamente para mostrar que la reacción es de primer orden en N 2 O 5, con una constante de velocidad de 1.697 x 10 -3 s -1. (La gráfica se muestra a continuación.) Entonces la ley de velocidad para la reacción es
\[\text{rate} = 1.697 \times 10^{-3}s^{-1} [N_2O_5]\]
Entonces, ¿cómo se puede usar la teoría de colisiones para comprender la constante de velocidad? Resulta que el mecanismo para la reacción implica una etapa de iniciación bimolecular.
El mecanismo para la reacción tiene una etapa de iniciación bimolecular
\[ N_2O_5 + M \rightleftharpoons N_2O_5^* + M\]
donde\(N_2O_5^*\) es una forma activada energéticamente de la\(N_2O_5\) cual puede relajarse para reformarse\(N_2O_5\) o descomponerse para formar los productos de la reacción. Debido a que el paso de iniciación es bimolecular, la teoría de colisión puede ser utilizada para entender la ley de velocidad, pero debido a que el producto del paso unimolecular experimenta una lenta conversión a productos unimolecularmente, se observa que la tasa global es de primer orden en\(N_2O_5\). El análisis de los mecanismos de reacción, y la reconciliación con las leyes de tasas observadas, forman los temas del Capítulo 12.


