7.1: La aproximación del método variacional
- Page ID
- 80376
- Apreciar la complejidad de resolver múltiples átomos de electrones
- Caracterizar las interacciones multi-electrón dentro de los conceptos de blindaje
- Utilizar el método variacional como aproximación para estudiar problemas insolubles
- Método variacional del usuario para evaluar la carga nuclear efectiva para un átomo específico
En esta sección introducimos el potente y versátil método variacional y lo utilizamos para mejorar las soluciones aproximadas que encontramos para el átomo de helio utilizando la aproximación electrónica independiente.
La verdadera energía (determinada experimentalmente) del átomo de helio
El átomo de helio tiene dos electrones unidos a un núcleo con carga\(Z = 2\). La eliminación sucesiva de los dos electrones puede considerarse paso a paso:
\[\ce{He} \xrightarrow {\textit{I}_1} \ce{He}^+ + e^-\xrightarrow {\textit{I}_2}\ce{He}^{++}+2e^-\label{7.1.1} \]
La primera energía de ionización\(I_1\) es la energía mínima requerida para eliminar el primer electrón del gas helio y se determina experimentalmente:
\[ \begin{align*} \textit{I}_1=-\textit{E}_{1\textit{s}}(\ce{He}) = 24.59\;eV \end{align*} \nonumber \]
Si bien la segunda energía de ionización, se\(I_2\) puede determinar experimentalmente, también se puede calcular exactamente a partir de las soluciones de átomos de hidrógeno ya que\(\ce{He^{+}}\) es un ion similar al hidrógeno con\(Z=2\). Por lo tanto, tenemos
\[ \begin{align*} \textit{I}_2 &=-\textit{E}_{ 1\textit{s}}(\ce{He}^+) \\[4pt] &=\dfrac{Z^2}{2n^2} \\[4pt] &=54.42\mbox{ eV} \end{align*} \nonumber \]
La energía de las tres partículas separadas en el lado derecho de la Ecuación\(\ref{7.1.1}\) es cero (por definición). Por lo tanto, la energía del estado fundamental del átomo de helio viene dada por
\[ \begin{align*} E_{true}&=-(\textit{I}_1+\textit{I}_2) \\[4pt] &=-79.02\mbox{ eV}.\end{align*} \nonumber \]
que se puede expresar en términos de la constante de Rydberg (\(R_H=13.6 \; eV\)) que también describe la energía más baja del átomo de hidrógeno
\[E_{true} = -5.8066\,R_H \nonumber \]
Intentaremos reproducir este verdadero valor, lo más cerca posible, por diferentes enfoques teóricos (todas las aproximaciones).
La aproximación “La ignorancia es dicha”
El hamiltoniano para el átomo de helio es:
\[\hat{H} = -\dfrac{\hbar^2}{2m_e}\nabla_{el_{1}}^2 -\dfrac{\hbar^2}{2m_e}\nabla_{el_{2}}^2 - \dfrac {Ze^2}{4\pi\epsilon_0 r_1} - \dfrac {Ze^2}{4\pi\epsilon_0 r_2} + \cancel{ \dfrac {e^2}{4\pi \epsilon_0 r_{12}} } \label{7.1.3} \]
Si simplemente ignoramos el término de repulsión electrón-electrón, entonces la Ecuación\ ref {7.1.3} puede simplificarse a
\[ \begin{align} \hat{H} & \approx -\dfrac{\hbar^2}{2m_e}\nabla_{el_{1}}^2 - \dfrac {Ze^2}{4\pi\epsilon_0 r_1} - \dfrac{\hbar^2}{2m_e}\nabla_{el_{2}}^2 - \dfrac {Ze^2}{4\pi\epsilon_0 r_2} \label{7.1.3B} \\[4pt] &\approx h_1(r_1) + h_2(r_2) \label{7.1.3C} \end{align} \]
donde\(h_1\) y\(h_2\) son hamiltonianos de un electrón para los electrones 1 y 2, respectivamente, y son solo los hamiltonianos similares al hidrógeno. La aproximación en la Ecuación\ ref {7.1.3C} es conveniente ya que el electrón 1 es separable del electrón 2, de manera que la efunción de onda de dos electrones se aproxima como un producto a dos funciones de onda de un electrón:
\[\Psi_{total} = \psi_{el_{1}}\psi_{el_{2}} \label{7.1.4a} \]
o en notación de braket
\[ | \Psi_{total} \rangle = \hat{H} | \psi_{el_1} \psi_{el_2} \rangle \label{7.1.4b} \]
Con algún álgebra de operador surge algo importante: las energías de un electrón son aditivas:
\[ \begin{align*} \hat{H} \Psi_{total} &= (\hat{H}_{el_1} + \hat{H}_{el_2}) \psi_{n\ {el_1}} \psi_{n\ {el_2}} = (E_{n_1} + E_{n_2}) \psi_{n\ {el_1}} \psi_{n\ {el_2}} \end{align*} \nonumber \]
o en notación de bra-ket
\[ \begin{align*} \hat{H} | \Psi_{total} \rangle &= \hat{H} | \psi_{el_1} \psi_{el_2} \rangle \\[4pt] &= (E_{n_1} + E_{n_2}) | \psi_{1} \psi_{2} \rangle \end{align*} \nonumber \]
La energía para un átomo de helio en estado fundamental (ambos electrones en el estado más bajo) es entonces
\[ \begin{align*} E_{He_{1s}} &= \underset{\text{energy of single electron in helium}}{E_{n_1}} + \underset{\text{energy of single electron in helium}}{E_{n_2}} \\[4pt] &= -R_H\left(\dfrac{Z^2}{1}\right) -R_H \left(\dfrac{Z^2}{1}\right) \\[4pt] &= -8R_H \end{align*} \nonumber \]
Esta aproximación sobreestima significativamente la verdadera energía del átomo de helio\(E_{He_{1s}} = -5.8066\,R\). Esta es una mala aproximación y necesitamos abordar la repulsión electrón-electrón correctamente (o mejor al menos).
Blindaje y penetración
Una forma de tomar en cuenta la repulsión electrón-electrón es modificar la forma de la función de onda. Una modificación lógica es cambiar la carga nuclear,\(Z\), en las funciones de onda a una carga nuclear efectiva (\(Z_{eff}\)), de +2 a un valor menor. El fundamento para hacer esta modificación es que un electrón protege parcialmente la carga nuclear del otro electrón, como se muestra en la Figura 7.1.1 .
Una región de densidad de carga negativa entre uno de los electrones y el núcleo +2 hace que la energía potencial entre ellos sea más positiva (disminuye la atracción entre ellos). Podemos efectuar este cambio matemáticamente usando\(\zeta < 2\) en la expresión wavefunction. Si el blindaje estuviera completo, entonces\(Z_{eff}\) equivaldría a 1. Si no hay blindaje, entonces\(Z_{eff}= 2\). Entonces, una manera de tomar en cuenta la interacción electrón-electrón es diciendo que produce un efecto de blindaje. El blindaje no es cero, y no está completo, por lo que la carga nuclear efectiva varía entre uno y dos.
En general, una teoría debe ser capaz de hacer predicciones con antelación al conocimiento del resultado experimental. En consecuencia, se necesita un principio y método para elegir el mejor valor para\(Z_{eff}\) o cualquier otro parámetro ajustable que se va a optimizar en un cálculo. El Principio Variacional proporciona el criterio y método requeridos y dice que el mejor valor para cualquier parámetro variable en una función de onda aproximada es el valor que da la energía más baja para el estado fundamental; es decir, el valor que minimiza la energía. El método variacional es el procedimiento que se utiliza para encontrar la energía más baja y los mejores valores para los parámetros variables.
Una mejor aproximación: el método variacional
El método variacional es una forma de encontrar aproximaciones al estado propio o estado fundamental de energía más baja, y algunos estados excitados. Esto permite calcular las funciones de onda aproximadas y es el principio variacional. El método consiste en elegir una “función de onda de prueba” dependiendo de uno o más parámetros, y encontrar los valores de estos parámetros para los cuales el valor de expectativa de la energía es el más bajo posible. La función de onda obtenida al fijar los parámetros a dichos valores es entonces una aproximación a la función de onda del estado fundamental, y el valor de expectativa de la energía en ese estado es un límite superior a la energía del estado fundamental.
El principio variacional significa que el valor de expectativa para la energía de unión obtenida usando una función de onda aproximada y el operador hamiltoniano exacto será mayor o igual que la energía verdadera para el sistema. Esta idea es realmente poderosa. Cuando se implementa, nos permite encontrar la mejor función de onda aproximada a partir de una función de onda dada que contiene uno o más parámetros ajustables, llamada función de onda de prueba. Una declaración matemática del principio variacional es
\[ E_{trial} \ge E_{true} \label {7.1.7} \]
donde
\[ \begin{align} E_{trial} &= \dfrac{ \langle \psi _{trial}| \hat {H} | \psi _{trial} \rangle}{\langle \psi _{trial} | \psi _{trial} \rangle} \\[4pt] &= \dfrac {\displaystyle \int \psi _{trial} ^* \hat {H} \psi _{trial} d \tau}{\displaystyle \int \psi _{trial} ^* \psi _{trial} d\tau } \label {7.1.8} \end{align} \]
La ecuación\(\ref{7.1.7}\) se llama teorema variacional y establece que para un operador hamiltoniano independiente del tiempo, cualquier función de onda de prueba tendrá una energía variacional (es decir, valor de expectativa) que es mayor o igual a la función de onda verdadera del estado fundamental correspondiente a la función dada Hamiltoniano (Ecuación\ ref {7.1.7}). Debido a esto, la energía variacional es un límite superior a la verdadera energía del estado fundamental de una molécula dada. El enfoque general de este método consiste en elegir una “función de onda de prueba” dependiendo de uno o más parámetros, y encontrar los valores de estos parámetros para los cuales el valor de expectativa de la energía es el más bajo posible (Figura 7.1.2 ).
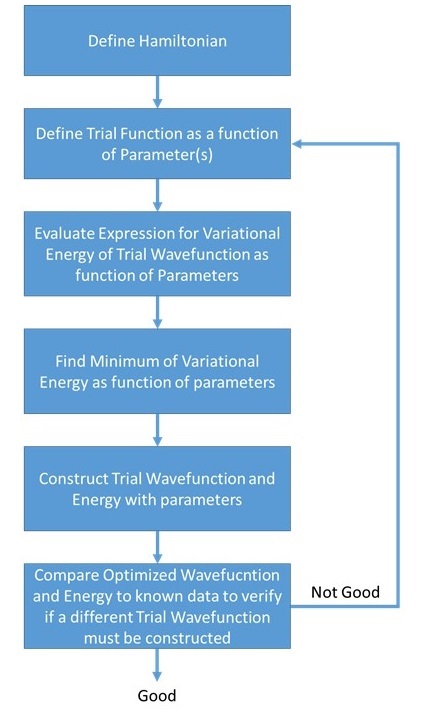
La energía variacional solo\(E_{trial}\) es igual a la energía verdadera\(E_{true}\) cuando la función de onda de prueba correspondiente\(\psi_{trial}\) es igual a la verdadera función de onda\(\psi_{true}\).
Aplicación al estado fundamental del átomo de helio
A menudo los valores de expectativa (numerador) y las integrales de normalización (denominador) en Ecuación se\(\ref{7.1.8}\) pueden evaluar analíticamente. Para el caso del átomo He, consideremos la función de onda de prueba como la función de onda del producto dada por la ecuación\(\ref{7-13}\) (esto se llama la aproximación orbital),
\[\psi (r_1 , r_2) \approx \varphi (r_1) \varphi (r_2) \label {7-13} \]
El parámetro ajustable o variable en la función de onda de prueba es la carga nuclear efectiva\(\zeta\), y el hamiltoniano es la forma completa que se da a continuación (Nota: los cálculos cuánticos generalmente se refieren a la carga nuclear efectiva\(Z_{eff}\) como\(\zeta\) más que como usamos anteriormente).
\[\hat {H} = -\dfrac {\hbar ^2}{2m} \nabla^2_1 - \dfrac {\zeta e^2}{4 \pi \epsilon _0 r_1} - \dfrac {\hbar ^2}{2m} \nabla ^2_2 - \dfrac {\zeta e^2}{4 \pi \epsilon _0 r_2} + \dfrac {e^2}{4 \pi \epsilon _0 r_{12}} \label {9-9} \]
el parámetro ajustable o variable en la función de onda de prueba es la carga nuclear efectiva\(\zeta\) (sería igual a\(\zeta=2\) si estuviera completamente sin blindaje), y el hamiltoniano es la forma completa. Cuando se evalúa el valor de expectativa para la energía de prueba (Ecuación\ ref {7.1.8}) para helio, el resultado es una energía variacional que depende del parámetro ajustable,\(\zeta\).
\[ E_{trial} (\zeta) = \dfrac {\mu e^4}{4 \epsilon ^2_0 h} \left ( \zeta ^2 - \dfrac {27}{8} \zeta \right ) \label {7.1.9} \]
Esta función se traza en la Figura 7.1.3 como una función de\(\zeta\). De acuerdo con el principio variacional (Ecuación\ ref {7.1.7}), el valor mínimo de la energía en esta gráfica es la mejor aproximación de la energía verdadera del sistema, y el valor asociado de\(\zeta\) es el mejor valor para el parámetro ajustable.
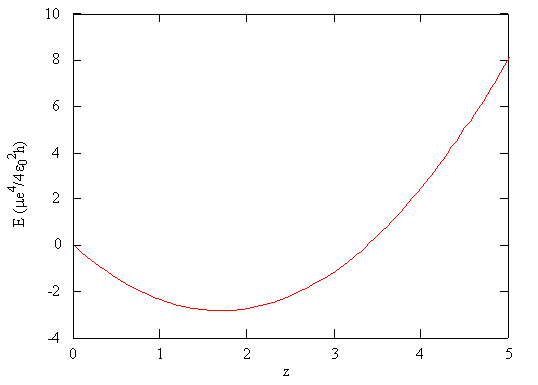
Usando la función matemática para la energía de un sistema, la energía mínima con respecto al parámetro ajustable se puede encontrar tomando la derivada de la energía con respecto a ese parámetro, estableciendo la expresión resultante igual a cero, y resolviendo para el parámetro, en este caso\(\zeta\). Este es un método estándar en cálculo para encontrar máximos y mínimos.
Encuentre el valor para\(\zeta\) que minimice la energía de unión de helio para la función de onda de prueba del producto en la Ecuación\ ref {7-13} con el Hamiltoniano en la Ecuación\ ref {9-9}. y compare la energía de unión con el valor experimental. ¿Cuál es el porcentaje de error en el valor calculado?
Solución
El método variacional requiere seguir el flujo de trabajo en la Figura 7.1.2 .
- Paso 1: Definir el hamiltoniano - Esto viene dado por la Ecuación\ ref {9-9}.
- Paso 2: Definir la función de onda de prueba como una función de al menos un parámetro - Esto viene dado por la Ecuación\ ref {7-13}.
- Paso 3: Evaluar la energía variacional (\(E_{trial}\)integral (Ecuación\ ref {7.1.8}) - Este procedimiento ya estaba arriba en la Ecuación\ ref {7.1.9}.
- Paso 4: Minimizar la energía variacional en función del (de los) parámetro (s) - Siguiendo el enfoque estándar para encontrar los extrema en el cálculo, evaluar la derivada de\(E_{trial}\) con respecto a\(\zeta\) y puesta a cero:\[\dfrac{dE_{trial}}{d\zeta} = \dfrac {\mu e^4}{4 \epsilon ^2_0 h} \left ( 2 \zeta - \dfrac {27}{8} \right ) =0 \nonumber \] luego encontrar solución para las raíces de este polinomio\[2 \zeta - \dfrac {27}{8}=0 \nonumber \] o \[\zeta = \dfrac {27}{16} \approx 1.6875 \nonumber \]
- Paso 5-6: La pregunta no pide la función de onda optimizada (Paso 5) o comparar el resultado con el valor verdadero para evaluar la calidad de la aproximación (Paso 6). Podemos saltarnos estos pasos.
Del Ejercicio 7.1.1 , la\(\zeta = 1.6875\) y la energía aproximada calculamos usando este método de aproximación, E approx = -77.483 eV. La Tabla 7.1.1 muestra que se obtiene una mejora sustancial en la precisión de la energía de unión calculada mediante el uso de blindaje para dar cuenta de la interacción electrón-electrón. Incluir el efecto del blindaje electrónico en la función de onda reduce el error en la energía de unión a aproximadamente 2%. Esta idea es muy simple, elegante y significativa.
|
|
|
|---|---|
| “La ignorancia es dicha” Aproximación (negligencia repulsión entre electrones) | -108.8 |
| Método variacional con carga efectiva variable | -77.483 |
| Experimental | -79.0 |
La mejora que hemos visto en los cálculos de energía total utilizando un parámetro variable\(\zeta\) indica que una contribución importante de la interacción electrón-electrón o repulsión a la energía de unión total surge del hecho de que cada electrón protege la carga nuclear del otro electrón. Es razonable suponer que los electrones son independientes; es decir, que se mueven independientemente, pero se debe tomar en cuenta el blindaje para afinar las funciones de onda. La inclusión de parámetros optimizables en la función de onda nos permite desarrollar una imagen física clara de las consecuencias de nuestro cálculo de variación. Calcular correctamente las energías es importante, y también es importante poder visualizar densidades de electrones para sistemas multielectrónicos. En las dos secciones siguientes, tomamos un descanso temporal de nuestra consideración de los métodos de aproximación para examinar más de cerca las funciones de onda multielectrónica.
Colaboradores y Atribuciones
Adapted from "Quantum States of Atoms and Molecules" by David M. Hanson, Erica Harvey, Robert Sweeney, Theresa Julia Zielinski


