8.10: Las reglas de Hund determinan los símbolos de término de los estados electrónicos terrestres
- Page ID
- 79647
- Definir tres reglas de Hund
- Utilice tres reglas de Hunds para predecir la configuración de energía más baja y los símbolos de términos para sistemas de múltiples electrones
En la sección de Aufbau se discutió cómo esos electrones llenan primero los orbitales de menor energía, y luego se mueven hacia orbitales de mayor energía solo después de que los orbitales de menor energía estén llenos. No obstante, existe un problema con esta regla. Ciertamente, los orbitales 1s deben llenarse antes que los orbitales 2s, porque los orbitales 1s tienen un valor menor de n, y por lo tanto una energía menor. ¿Y los tres orbitales 2p diferentes? ¿En qué orden deben llenarse? La respuesta a esta pregunta involucra la regla de Hund, que tiene mucho más sentido en el contexto de símbolos de términos generados que se utilizan para combinar los diversos\(L\) y\(S\) los valores representan adiciones vectoriales de posibles microestados.
Reglas del perro
- El estado con mayor valor de\(S\) es más estable y la estabilidad disminuye con la disminución\(S\).
- Para estados con mismos valores de\(S\), el estado con mayor valor de\(L\) es el más estable.
- Si los estados tienen los mismos valores de\(L\) y\(S\) luego, para un subshell que está menos de la mitad lleno, el estado con el más pequeño\(J\) es el más estable; para los subshells que están más de la mitad llenos, el estado con el mayor valor de\(J\) es el más estable.
Clasifique estos términos asociados a una configuración electrónica de un átomo basada en la energía (a través de las reglas de Hund):
\(^3D\),\(^3P\),\(^3S\),\(^1D\),\(^1P\),\(^1S\)
Primera Regla de Hund (Maximizar Multiplicidad de Espín)
Según la primera regla, los electrones siempre entran en un orbital vacío antes de que se emparejen. Los electrones están cargados negativamente y, como resultado, se repelen entre sí. Los electrones tienden a minimizar la repulsión ocupando sus propios orbitales, en lugar de compartir un orbital con otro electrón. Además, los cálculos cuánticos mecánicos han demostrado que los electrones en orbitales ocupados por separado son menos efectivamente cribados o protegidos del núcleo.
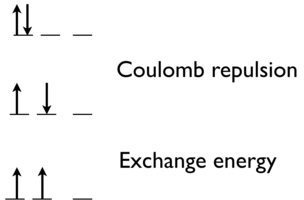
Hay una repulsión de Coulomb entre dos electrones para ponerlos en el mismo orbital (una energía de emparejamiento de espín que a menudo se discute en Crystal Field Theory). Sin embargo, también hay un efecto mecánico cuántico. La energía de intercambio (que es favorable) aumenta con el número de posibles intercambios entre electrones con el mismo giro y energía. Al pasar del estado superior al estado medio de la Figura 8.10.1 , eliminamos la repulsión de Coulomb entre electrones en el mismo orbital. Además, al pasar del estado medio al estado inferior (estado más estable predicho por la primera regla de Hund), ganamos la energía de intercambio, porque estos dos electrones son indistinguibles.
Segunda Regla de Hund (Maximizar Multiplicidad Angular Orbital)
Lo que importa es el momento angular total (escalar), no la dirección. Los signos negativos y positivos se refieren únicamente a la dirección del momento angular, no a la magnitud. La dirección es además arbitraria (excepto en, digamos, un campo magnético o eléctrico). Así es la dirección de giro, por cierto. Por convención usualmente dibujamos el primer electrón en cada orbital como “up” (spin positivo). Sin embargo, con la misma facilidad podríamos dibujarlo “hacia abajo”. No hace diferencia - en ausencia de un campo EM externo, la energía es la misma, aunque sólo sea porque las moléculas/átomos están girando con respecto al marco de laboratorio de todos modos. “Arriba” y “abajo”, es decir, es artificial. Lo que importa son los vectores de impulso relativo de los diversos electrones en el sistema, y de ahí su suma total.
Tercera Regla de Hund (Minimizar menos de la mitad de relleno o maximizar los proyectiles más de la mitad llenos)
Hace mucho tiempo alguien ofrecía una explicación razonablemente simple relacionada con el hecho de que cuando el caparazón está más de medio lleno, es más fácil visualizar el sistema como una interacción entre el espín y los momentos orbitales de los agujeros en lugar de electrones, en cuyo caso el término de estabilización energética se invierte en firmar. Esto se debe a que el momento angular de giro de un solo agujero sería opuesto en signo comparado con el momento angular de giro de un solo electrón. Tomando como ejemplo - los tres orbitales p. Una situación con 1 electrón y 5 electrones son funcionalmente similares, excepto que uno tiene un solo electrón y otro tiene un solo agujero. Siendo todas las cosas iguales, el momento angular de giro total del sistema de 1 electrón sería opuesto en signo a cualquiera que sea el momento angular de giro total del sistema de 5 electrones. Entonces se cambiarían las expectativas de las reglas de Hund. Se puede ver esto si dibuja todos los microestados de las configuraciones de 1 electrón y 5 electrones: el todo está prácticamente cambiado en signo en este último caso.
¿Qué términos y niveles pueden surgir de un átomo con la configuración de estado fundamental de\(1s^22s^22p^6 3s^2 3p^6 4s^2 4p^1 3d^1\)? ¿Cuál es el estado más estable (más bajo en energía)?
Solución
Los estados posibles incluyen:
\(^1F_3\),\(^1D_2\),\(^1P_1\),\(^3F_4\),\(^3F_3\),\(^3F_2\),,\(^3D_3\),\(^3D_2\),\(^3D_1\),\(^3P_2\),\(^3P_1\),\(^3P_0\).
Hay dos electrones desapareados en este sistema a partir de la configuración de electrones.
- La regla 1 predice que el estado base será un triplete con\(S=1\) así\(2S+1=3\). Entonces el estado base es de esta lista más estrecha:\(^3F_4\),,,\(^3F_3\),\(^3F_2\),\(^3D_3\),,\(^3D_2\),\(^3D_1\),\(^3P_2\),\(^3P_1\),\(^3P_0\).
- La regla 2 predice un\(F\) estado ya que esa es la multiplicidad más alta con\(L= 3\): Entonces el estado base es de esta lista más estrecha:\(^3F_4\),\(^3F_3\),\(^3F_2\)
- La regla 3 predice el\(J\) término más bajo ya que el shell d está menos de la mitad lleno. Ese es el\(J=2\) estado.
Por lo tanto, para este sistema, el átomo tendrá una estructura de estado fundamental de
\(^3F_2\)
La configuración de tierra de un\(\ce{Ti^{2+}}\) ion es\([Ar]3d^2\). ¿Cuál es el término de estado energético más bajo?
Solución
- Regla 1: dos electrones desapareados ⇒ mayor S = 1 ⇒ 2S + 1 = 3
- Regla 2: dos en d en giro paralelo ⇒ mayor L = 1 + 2 = 3 ⇒ 3F
- Regla 3: .L = 3, S = 1 ⇒ J = 4, 3, 2; menos de medio relleno ⇒\(^3F_2\)
Cuál es el término de estado energético más bajo para los siguientes átomos e iones.
- \(\ce{C}\):\([He]2s^2 2p^2\)
- \(\ce{N}\):\([He]2s^2 2p^3\)
- \(\ce{O}\):\([He]2s^2 2p^4\)
- \(\ce{Cr^{3+}}\):\([Ar]3d^3\)
- \(\ce{Mn^{3+}}\):\([Ar]3d^4\)
- \(\ce{Fe^{3+}}\):\([Ar]3d^5\)
- Contestar
-
\(^3P_0\),\(^4S_{3/2}\),\(^3P_2\),\(^4F_{3/2}\)\(^5D_0\), y\(^6S_{5/2}\), respectivamente.

