25.4: La presión osmótica puede determinar las masas moleculares
- Page ID
- 79781
Algunos materiales de membrana son permeables para algunas moléculas, pero no para otras. A menudo esto es una cuestión de tamaño de la molécula, pero también puede ser una cuestión de solubilidad de la molécula en el material de barrera. Muchas membranas biológicas tienen propiedades semipermeables y, por lo tanto, la ósmosis es un proceso biológico importante.
La figura 25.4.1 muestra una célula osmótica simple. Ambos compartimentos contienen agua, pero el de la derecha también contiene un soluto cuyas moléculas (representadas por círculos verdes) son demasiado grandes para pasar a través de la membrana. Muchas sustancias artificiales y naturales son capaces de actuar como membranas semipermeables. Las paredes de la mayoría de las células vegetales y animales entran dentro de esta categoría.
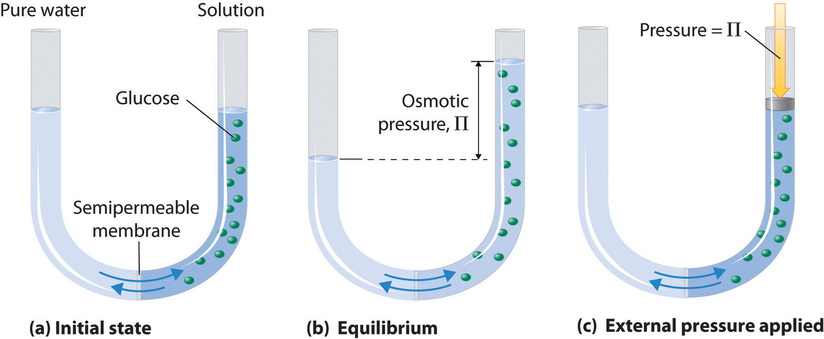
Si las moléculas de solvente pueden pasar, pero las moléculas de soluto (o iones) no pueden y en el lado opuesto de la membrana hay solvente puro, las moléculas de soluto tienen la oportunidad de aumentar el tamaño de la caja en la que están atrapadas. Las moléculas de disolvente migrarán espontáneamente a través de la membrana para aumentar el volumen de la solución y así reducir su concentración.
Si la solución es ideal este proceso es en muchos sentidos análogo al aumento espontáneo en el volumen de un gas que se permite expandirse contra el vacío. Por supuesto, el volumen del 'soluto-gas' está limitado por la disponibilidad de solvente y -si se hace bajo gravedad en un tubo en forma de U por la acumulación de presión hidrostática. Esta presión se conoce como la presión osmótica\(Π\)
En equilibrio podemos escribir:
\[μ^*(T,P) = μ^{sln}(T,P+ Π,a_1) \nonumber \]
\[μ^*(T,P) = μ^*(T,P+ Π)+ RT\ln a_1 \nonumber \]
De\(dG\) en sus variables naturales sabemos que
\[ \left(\dfrac{∂G}{∂P} \right)_{T,x} = V \nonumber \]
Tomando el parcial versus\(x_1\) obtenemos:
\[ \left( \dfrac{∂μ^*}{∂P} \right)_{T,x} = V^*_{bar,1} \nonumber \]
Esto significa que podemos integrar sobre el volumen molar para\(μ^*(T,P+ Π)\) convertirlo a una presión diferente
\[μ^*(T,P+ Π) = μ^*(T,P) + \int_P^{P+ Π } V^*_{bar,1} dP \nonumber \]
Así conseguimos
\[μ^*(T,P) = μ^*(T,P+ Π)+ RT\ln a_1 \nonumber \]
\[μ^*(T,P) = μ^*(T,P)+ ΠV^*_{bar,1}+ RT\ln a_1 \nonumber \]
Una vez más usando la aproximación ideal
\[\ln a_1 \ln x_1 ≈ -x_2 \nonumber \]
obtenemos:
\[RT x_2 = ΠV^*_{bar,1} \nonumber \]
\[x_2 = \dfrac{n_2}{n_1+n_2}≈\dfrac{n_2}{n_1} \nonumber \]
La combinación da una expresión que involucra la molaridad.
\[Π=RTc \nonumber \]
La ósmosis también se puede utilizar a la inversa, si aplicamos alrededor de 30 bar al agua de mar podemos obtener agua dulce del otro lado de una membrana adecuada. Este proceso se utiliza en algunos lugares, pero sería deseable mejores membranas. También se obstruyen fácilmente. El agua resultante no está completamente libre de sal y esto significa que si se usa para la agricultura la sal puede acumularse en el campo con el tiempo.
Determinación de Masas Molares
Tanto la depresión del punto de fusión como la elevación del punto de ebullición solo facilitan la determinación de pesos molares relativamente pequeños. La necesidad de tales mediciones ya no se siente porque ahora contamos con buenas técnicas para determinar la estructura de la mayoría de las moléculas pequeñas a medianas. Para los polímeros este es un asunto diferente. Suelen tener una distribución de peso molecular (masa) y determinarla es un tema importante de la ciencia de polímeros
La osmometría sigue siendo de cierta utilidad práctica. También es coligativo y capaz de medir hasta alrededor de 8000 daltons. Muchos polímeros son mucho más grandes que eso. Su distribución masiva suele estar determinada por diferentes medios. Los polímeros se disuelven y se llevan sobre una columna cromatográfica generalmente basada en la exclusión por tamaño. Luego se sondea el efluente en función del tiempo de elución mediante una combinación de técnicas:
- Absorción UV (determinar la concentración de monómero)
- Dispersión de luz láser de ángulo bajo (LALLS) y/o viscosimetría
Estos dos últimos proporcionan información sobre la distribución de la masa molar pero dan un momento diferente de esa distribución. La combinación de técnicas da una idea no sólo de cuánto material hay de una masa molar dada sino también de la linealidad o grado de ramificación de las cadenas.
Sin embargo, la depresión del punto de fusión todavía se usa en una aplicación algo diferente. Cuando un sólido ligeramente impuro se funde su punto de fusión se deprime. Además, el proceso de fusión no es repentino sino que tiene lugar a lo largo de toda la trayectoria desde típicamente una temperatura eutéctica más baja hasta el punto de fusión deprimido (la línea de líquido en el diagrama de fases). En la síntesis orgánica el comportamiento de fusión se utiliza a menudo como una primera indicación conveniente de pureza. En un experimento de calorimetría diferencial de barrido (DSC), el pico de fusión se vuelve progresivamente sesgado hacia temperaturas más bajas a mayores niveles de impurezas. La forma de la curva se puede modelar con una versión modificada de la expresión de depresión del punto de fusión. Esto produce un valor para el nivel total de impurezas en el sólido. Esta técnica es utilizada en la industria farmacéutica con fines de control de calidad.

