29.9: El Mecanismo Michaelis-Menten para Catálisis Enzimática
- Page ID
- 79453
Las enzimas son catalizadores biológicos y proteínas funcionales. Las enzimas contienen especificidad en su estructura proteica para tener su función especializada. Por lo general, contiene más de una subunidad y son críticas para sostener la vida. Las enzimas pueden aumentar las reacciones químicas en las células vivas. Sin embargo, las enzimas no se consumen en la reacción y su función principal es ayudar a unir los sustratos para que puedan experimentar una reacción normal más rápido.
La primera enzima se encontró en el proceso de fermentación en leche y alcohol durante el siglo XIX. Posteriormente a principios de la década de 1830, se utilizó el término enzima para sustituir al término fermento. Algunos científicos creen que los fermentos deben contener células vivas y algunos piensan que los fermentos podrían ser células no vivas. Finalmente, en la década de 1920, Sumner purificó la estructura de la enzima y luego se entendieron más claramente las propiedades de la enzima. Hasta hoy, las enzimas siguen siendo el campo de investigación popular que muchas personas están sujetas a estudio.
Cinética de Michaelis-Menten
En los sistemas biológicos, las enzimas actúan como catalizadores y juegan un papel crítico en la aceleración de las reacciones, en cualquier lugar de\(10^3\) to \(10^{17}\) times faster than the reaction would normally proceed. Enzymes are high-molecular weight proteins that act on a substrate, or reactant molecule, to form one or more products. In 1913, Leonor Michaelis y Maude Menten propusieron el siguiente mecanismo de reacción para enzimáticos reacciones:
\[\text{E} + \text{S} \overset{k_1}{\underset{k_{-1}}{\rightleftharpoons}} \text{ES} \overset{k_2}{\rightarrow} \text{E} + \text{P} \nonumber \]
donde\(\text{E}\) is the enzyme, \(\text{ES}\) is the enzyme-substrate complex, and \(\text{P}\) is the product. In the first step, the substrate binds to the active site of the enzyme. In the second step, the substrate is converted into the product and released from the substrate. For this mechanism, we can assume that the concentration of the enzyme-substrate comple x,\(\text{ES}\), es pequeño y emplea una aproximación en estado estacionario:
\[\dfrac{d \left[ \text{ES} \right]}{dt} = k_1 \left[ \text{E} \right] \left[ \text{S} \right] - k_{-1} \left[ \text{ES} \right]_{ss} - k_2 \left[ \text{ES} \right]_{ss} \approx 0 \label{Eq22} \]
Además, debido a que la enzima permanece inalterada a lo largo de la reacción, expresamos la concentración total de enzima como una suma del complejo enzima-sustrato:
\[\left[ \text{E} \right]_0 = \left[ \text{ES} \right] + \left[ \text{E} \right] \label{Eq23} \]
Ecuación de taponamiento\(\ref{Eq23}\) into Equation \(\ref{Eq22}\), we obtain
\[0 = k_1 \left( \left[ \text{E} \right]_0 - \left[ \text{ES} \right]_{ss} \right) \left[ \text{S} \right] - k_{-1} \left[ \text{ES} \right]_{ss} + k_2 \left[ \text{ES} \right]_{ss} \label{Eq24} \]
Resolviendo para\(\left[ \text{ES} \right]_{ss}\)
\[\left[ \text{ES} \right]_{ss} = \dfrac{k_1 \left[ \text{E} \right]_0 \left[ \text{S} \right]}{k_1 \left[ \text{S} \right] + k_{-1} + k_2} = \dfrac{\left[ \text{E} \right]_0 \left[ \text{S} \right]}{\left[ \text{S} \right] + \dfrac{k_{-1} + k_2}{k_1}} \label{Eq25} \]
Luego podemos escribir la velocidad de reacción del producto como
\[\dfrac{d \left[ \text{P} \right]}{dt} = k_2 \left[ \text{ES} \right]_{ss} = \dfrac{k_2 \left[ \text{E} \right]_0 \left[ \text{S} \right]}{\left[ \text{S} \right] + \dfrac{k_{-1} + k_2}{k_1}} = \dfrac{k_2 \left[ \text{E} \right]_0 \left[ \text{S} \right]}{\left[ \text{S} \right] + K_M} \label{Eq26} \]
donde\(K_M\) is the Michaelis constante. Ecuación Ecuación de\(\ref{Eq26}\) is known as the Michaelis-Menten. El resultado para una cinética de Michaelis-Menten equivalente a la de una reacción en fase gaseosa unimolecular catalizada sobre una superficie sólida. En el límite donde hay una gran cantidad de sustrato presente\(\left( \left[ \text{S} \right] \gg K_M \right)\) Equation \(\ref{Eq26}\) reduces to
\[\dfrac{d \left[ \text{P} \right]}{dt} = r_\text{max} = k_2 \left[ \text{E} \right]_0 \label{Eq27} \]
que es una reacción de\(0^{th}\) orden, ya que\(\left[ \text{E} \right]_0\) is a constant. The value \(k_2 \left[ \text{E} \right]_0\) representa la velocidad máxima,\(r_\text{max}\), a la que puede proceder la reacción enzimática. La constante de velocidad,\(k_2\), is also known as the turnover number, which is the number of substrate molecules convertida en producto en un tiempo dado cuando todos los sitios activos en la enzima están ocupados. La Figura 29.9.4 muestra la dependencia de la velocidad de reacción de la concentración de sustrato, gráfica de\(\left[ \text{S} \right]\). This plot is known as the Michaelis-Menten. Examinando la cifra, podemos ver que la velocidad de reacción alcanza un valor máximo de\(k_2 \left[ \text{E} \right]_0\) at large values of \(\left[ \text{S} \right]\).
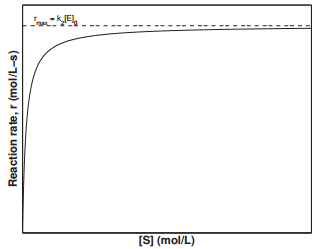
Otra gráfica comúnmente utilizada en el examen de la cinética enzimática es la gráfica Lineweaver-Burk, en con la inversa de la velocidad de reacción,\(1/r\), is plotted against the inverse of the substrate concentration \(1/\left[ \text{S} \right]\). Rearranging Equation \(\ref{Eq26}\),
\[\dfrac{1}{r} = \dfrac{K_M + \left[ \text{S} \right]}{k_2 \left[ \text{E} \right]_0 \left[ \text{S} \right]} = \dfrac{K_M}{k_2 \left[ \text{E} \right]_0} \dfrac{1}{\left[ \text{S} \right]} + \dfrac{1}{k_2 \left[ \text{E} \right]_0} \label{Eq28} \]
La gráfica Lineweaver-Burk da como resultado una línea recta con la pendiente igual a\(K_M/k_2 \left[ \text{E} \right]_0\) and \(y\)-intercept equal to \(1/k_2 \left[ \text{E} \right]_0\).

