5.2: Estereoisómeros
- Page ID
- 80564
Dos compuestos que tienen la misma fórmula y la misma conectividad no siempre tienen la misma forma. Hay dos razones por las que esto puede suceder. En un caso, la molécula puede ser flexible, de modo que puede torcerse en diferentes formas a través de la rotación alrededor de enlaces sigma individuales. Este fenómeno se llama conformación, y se cubre en un capítulo diferente. El segundo caso ocurre cuando dos moléculas parecen estar conectadas de la misma manera en papel, pero están conectadas de dos maneras diferentes en el espacio tridimensional. Estas dos moléculas diferentes se llaman estereoisómeros.
- Puede haber más de una manera de organizar los mismos grupos alrededor del mismo átomo con la misma geometría.
- Este fenómeno se llama estereoquímica.
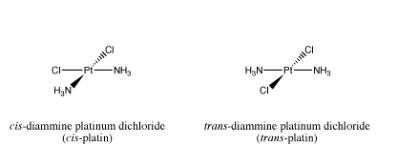
Un ejemplo simple de estereoisómeros de química inorgánica es dicloruro de diammina-platino, (NH 3) 2 PtCl 2. Este importante compuesto a veces se llama “platino” para abreviar. Como implica la fórmula, contiene un ion platino que se coordina a dos ligandos de amoníaco y dos ligandos de cloruro (recuerde, un ligando en química inorgánica es un donante de electrones que se une a un átomo metálico, donando un par de electrones para formar un enlace).
El platino es un ejemplo de un compuesto de coordinación. La forma en que las diferentes piezas de los compuestos de coordinación se unen entre sí se discute en el capítulo de ácidos y bases de Lewis.
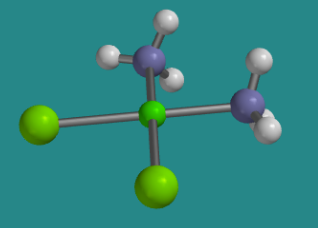
Ir a Animación SC2.1. Un modelo tridimensional de cis-platino.
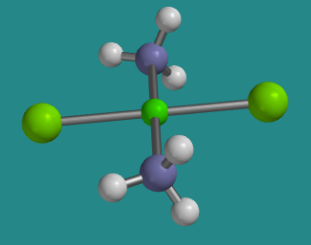
Ir a Animación SC2.2. Un modelo tridimensional de trans-platino.
Por razones derivadas de interacciones orbitales moleculares, el platino tiene una geometría plana cuadrada en el átomo de platino. Esa disposición da como resultado dos formas posibles de conectar los ligandos. Los dos conjuntos de ligandos similares podrían estar conectados en el mismo lado del cuadrado o en esquinas opuestas.
Estas dos disposiciones dan como resultado dos compuestos diferentes; son isómeros que difieren solo en el espacio tridimensional.
- El que tiene las dos minas uno al lado del otro se llama cis-platino.
- Estos dos ligandos son 90 grados uno del otro.
- El que tiene las minas una frente a la otra es trans-platino.
- Estos dos ligandos están a 180 grados uno del otro.
Aunque estos dos compuestos son muy similares, tienen propiedades físicas ligeramente diferentes. Ambos son compuestos amarillos que se descomponen cuando se calientan a 270 grados C, pero el trans-platino forma cristales de color amarillo pálido y es más soluble que el cisplatino en agua.
- Los isómeros cis y trans tienen diferentes propiedades físicas.
El cis platino tiene importancia clínica en el tratamiento de los cánceres ováricos y testiculares. Durante mucho tiempo se sospechó que el mecanismo biológico de la acción del fármaco implicaba la unión del platino por el ADN. Más detalles fueron trabajados por el químico del MIT Steve Lippard y la estudiante de posgrado Amy Rosenzweig en la década de 1990. Dentro del núcleo celular, las dos minas en cis-platino pueden ser reemplazadas por donantes de nitrógeno de una cadena de ADN. Para donar al platino ácido de Lewis, la molécula de ADN debe doblarse ligeramente. Normalmente esa curva es detectada y reparada por proteínas en la célula. Sin embargo, las células ováricas y testiculares contienen una proteína que tiene la forma correcta para encajar alrededor de esta cadena de ADN ligeramente doblada. La cadena de ADN se aloja en la proteína y no se puede desplazar, por lo que es incapaz de unirse con otras proteínas utilizadas en la replicación del ADN. La célula se vuelve incapaz de replicarse, por lo que se detiene el crecimiento canceroso.
- Los isómeros cis y trans tienen diferentes propiedades biológicas.
Ejercicio\(\PageIndex{1}\)
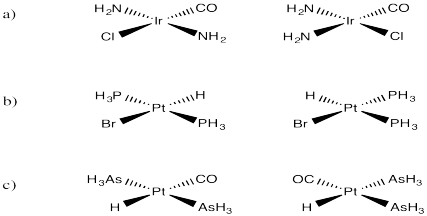
Dibujar los isómeros cis y trans de los siguientes compuestos:
a) (NH 3) 2 IRCl (CO) b) (H 3 P) 2 PTHBr c) (aSH 3) 2 PTh (CO)
- Responder
-
Ejercicio\(\PageIndex{2}\)
Solo es posible un isómero de (tmeda) PtcL 2 [tmeda = (CH 3) 2 NCH 2 CH 2 N (CH 3) 2; ambos nitrógenos se conectan al platino]. Dibuja este isómero y explica por qué el otro isómero no es posible.
- Responder
-
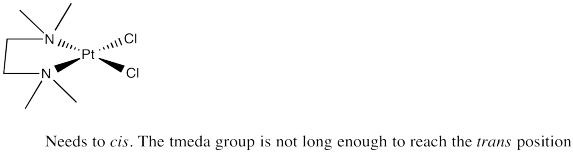
Fotos fijas de modelos obtenidos usando Spartan 14 de Wavefunction, Inc., Irvine, California.

