5.4: Enantiómeros
- Page ID
- 80476
Un átomo con cuatro grupos unidos a él también puede adoptar una geometría tetraédrica. Esta geometría suele ocurrir cuando el átomo central es un poco más pequeño. Una geometría tetraédrica permite que los grupos vecinos se alejen un poco más entre sí. El siguiente modelo de metano muestra un ejemplo bastante sencillo. La bola gris es un átomo de carbono y las cuatro bolas blancas son átomos de hidrógeno.

Ir a Animación SC3.1. Un modelo tridimensional de metano, CH 4.
A diferencia de los compuestos planos cuadrados, los compuestos tetraédricos simples no tienen el mismo tipo de isómeros cis y trans. Es decir, no se pueden colocar dos grupos en un tetraedro para que estén uno frente al otro o uno al lado del otro. La relación entre dos grupos cualesquiera en un tetraedro es la misma que la relación entre otros dos grupos en un tetraedro.
El diclorodimetilsilano es un compuesto que se puede utilizar para elaborar polímeros de silicona. Al igual que el platino, tiene dos cada uno de dos grupos unidos al átomo central. Sin embargo, el tom central es tetraédrico. Sólo hay una manera de organizar estos cuatro grupos.
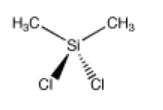
Ir a Animación SC3.1. Un modelo tridimensional de diclorodimetilsilano.
Sin embargo, si cuatro grupos diferentes están unidos a un átomo tetraédrico, los cuatro grupos pueden disponerse de dos formas posibles. Los dos compuestos que resultan son imágenes especulares entre sí. Estos dos isómeros se denominan enantiómeros.
Por ejemplo, supongamos que el átomo de silicio tetraédrico tenía cuatro grupos diferentes unidos a él: un átomo de hidrógeno, un átomo de cloro, un grupo metilo (es decir, un carbono con tres hidrógenos) y un grupo hidroxi (es decir, un oxígeno con un hidrógeno). Habría dos formas ligeramente diferentes de organizar esos cuatro grupos en el espacio. En la siguiente imagen, el hidrógeno es blanco, el cloro es verde y el oxígeno es rojo, mientras que el silicio y el carbono son grises.
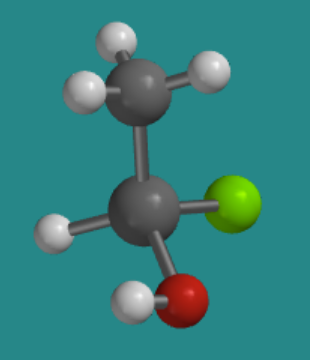
Ir a Animación SC3.2. Un modelo tridimensional de R-clorohidroximetilsilano.
Ejercicio\(\PageIndex{1}\)
Gire el modelo para que el hidrógeno unido al silicio quede oculto detrás de la molécula. ¿En qué dirección viajarías si trazaras desde el cloro hasta el oxígeno hasta el carbono: en sentido horario o antihorario?
- Contestar
-
En sentido horario
Esta siguiente imagen muestra una molécula muy similar. Los mismos grupos están unidos al átomo central de silicio, pero los están dispuestos de una manera ligeramente diferente.
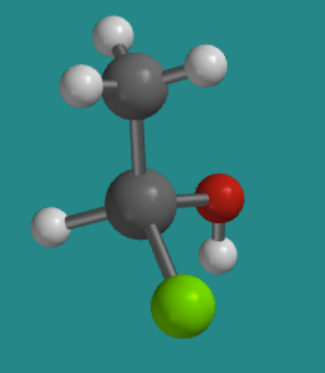
Ir a Animación SC3.3. Un modelo tridimensional de S-clorohidroximetilsilano.
Ejercicio\(\PageIndex{2}\)
Gire el modelo para que el hidrógeno unido al silicio quede oculto detrás de la molécula. ¿En qué dirección viajarías si trazaras desde el cloro hasta el oxígeno hasta el carbono: en sentido horario o antihorario?
- Contestar
-
En sentido antihorario
Divulgación completa: la molécula que estamos viendo no es realmente un compuesto estable que se pueda verter de una botella del almacén de química. Eso es porque una molécula reaccionaría con otra igual, y luego otra, y así sucesivamente para formar una cadena larga llamada polímero de silicona. Ese es el tipo de material que se encuentra en cosas como masilla tonta y calafateo de silicona.
Ejercicio\(\PageIndex{3}\)
Intentemos trabajar sin el modelo tridimensional. La siguiente imagen de bola y barra muestra un silicio unido a un bromo (rojo), un cloro (verde), un flúor (amarillo) y un hidrógeno. Si estuvieras mirando la molécula con el hidrógeno oculto detrás de ella, ¿en qué dirección viajarías si trazaras desde el bromo hasta el cloro hasta el flúor: en el sentido de las agujas del reloj o en sentido contrario a las agujas del reloj?
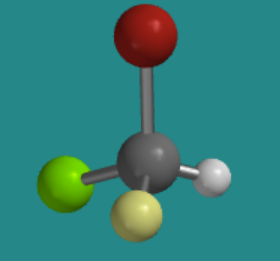
\(\PageIndex{5}\)Figura:RespuestaContra-relojModelo de ball-and-stick de un átomo sp3 con cuatro grupos diferentes unidos a él. El bromo está en la parte superior, el cloro está en la parte posterior izquierda, el hidrógeno está en la parte posterior derecha y el flúor apunta hacia la cámara.
Ejercicio\(\PageIndex{4}\)
Si estuvieras mirando la molécula con el hidrógeno escondido detrás de ella, ¿en qué dirección viajarías si trazaras desde el bromo hasta el cloro hasta el flúor: en el sentido de las agujas del reloj o en sentido contrario a las agujas del reloj?
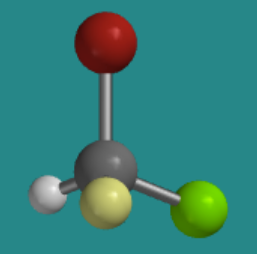
\(\PageIndex{6}\)Figura:RespuestaModelo de balón-y-palo de un átomo sp3 con cuatro grupos diferentes unidos a él. El bromo está en la parte superior. El cloro está en la parte posterior derecha. El hidrógeno está a la parte posterior izquierda. Flúor apunta hacia la cámara.
No tiene que haber cuatro átomos diferentes unidos al átomo central para obtener dos estereoisómeros. Sólo tiene que haber cuatro grupos diferentes. Incluso si los cuatro átomos unidos al central son iguales, si tienen cosas diferentes unidas a ellos, entonces son posibles dos arreglos tridimensionales. Los siguientes compuestos ilustran un ejemplo más sutil como ese. Este compuesto, por cierto, es estable y puede aislarse y almacenarse; es un compuesto real.
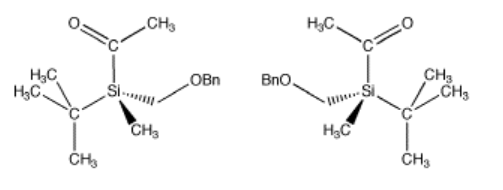
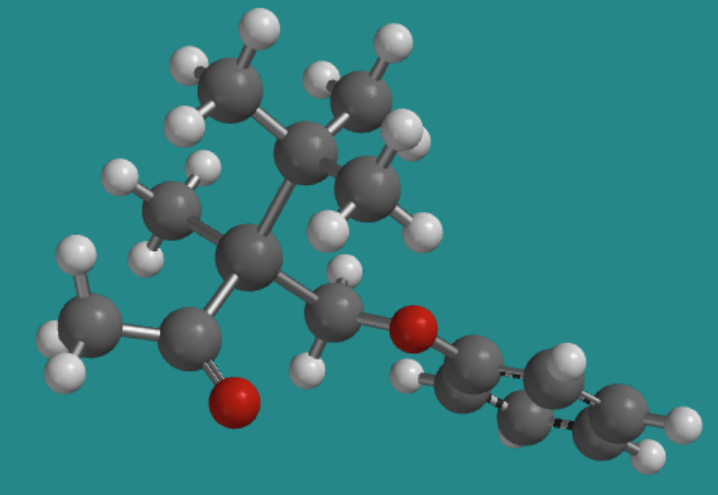
Ir a Animación SC2.1. Un modelo tridimensional del enantiómero (-)
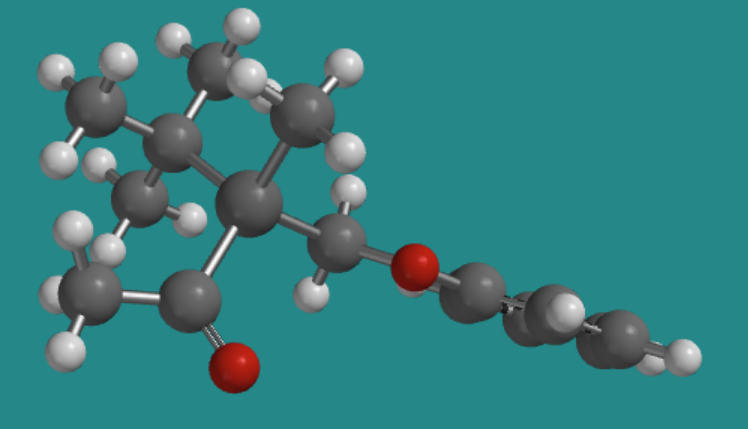
Ir a Animación SC2.1. Un modelo tridimensional del enantiómero (+).
- Los enantiómeros son pares de compuestos con exactamente la misma conectividad pero formas tridimensionales opuestas.
- Los enantiómeros no son iguales entre sí; un enantiómero no puede superponerse al otro.
- Los enantiómeros son imágenes especulares entre sí.
Dos compuestos con la misma conectividad exacta, que son imágenes especulares entre sí pero que no son idénticos entre sí se denominan enantiómeros. La definición más común de un enantiómero es que no es superponible en su imagen especular. Se puede distinguir fácilmente de su imagen especular, así como una mano derecha se puede identificar y distinguir fácilmente de una mano izquierda.
- Los compuestos que ocurren en estos pares se denominan “quirales”.
- “Quiral” proviene de la palabra griega para “mano”.
Se puede demostrar usando la teoría de grupos, las matemáticas de la simetría, que un enantiómero también puede definirse como una molécula que no contiene un plano espejo, lo que significa que no puede dividirse en dos mitades idénticas y opuestas.
- Los enantiómeros no contienen planos especular.
- Los enantiómeros no contienen dos mitades iguales y opuestas.
A diferencia de los isómeros cis y trans, dos enantiómeros tienen las mismas propiedades físicas. tienen el mismo punto de fusión, la misma solubilidad, y así sucesivamente. Dos compuestos que son casi idénticos, pero imágenes especulares entre sí, tienen exactamente los mismos tipos de atracción intermolecular, por lo que puede que no sea una sorpresa que sus propiedades físicas sean idénticas.
- Los enantiómeros son otro ejemplo de un tipo de estereoisómeros.
- Dos enantiómeros tienen propiedades físicas idénticas, a excepción de la rotación óptica.
La rotación óptica implica la interacción de la luz polarizada plana con un material. Si un material no es simétrico, la luz que pasa a través de él se rotará. Eso significa que si las ondas que componen la luz oscilan en una dirección a medida que ingresan al material, se habrán inclinado ligeramente para oscilar en otra dirección cuando emerjan del material. Vamos a ver este fenómeno más adelante.
- Dos enantiómeros tienen un efecto rotacional igual pero opuesto sobre la luz polarizada en el plano.
- (+) los enantiómeros giran la luz en el sentido de las agujas del reloj.
- (-) los enantiómeros giran la luz en sentido contrario a las agujas del reloj.
Por ejemplo, en el compuesto de silicio quiral mostrado anteriormente, el enantiómero (+) gira la luz polarizada en el plano en el sentido de las agujas del reloj. Tiene una “rotación óptica estándar” de [a] = +12 (+/-2) o. El enantiómero (-) gira la luz polarizada en el plano en sentido contrario a las agujas del reloj. Tiene una “rotación óptica estándar” de [a] = -9.9 (+/-2) o.
Ejercicio\(\PageIndex{5}\)
Un determinado compuesto existe en dos formas; el enantiómero A y el enantiómero B. El enantiómero A tiene un peso molecular de 126 g/mol, una densidad de 0.995 g/ml, una rotación óptica de [a] = 26 o, un punto de fusión de 65 o C, un punto de ebullición de 225 o C, y olor a cítricos. ¿Qué se puede decir sobre las propiedades correspondientes del enantiómero B?
- Contestar
-
El enantiómero B tiene un peso molecular de 126 g/mol, una densidad de 0.995 g/mL, una rotación óptica de [a] = -26 o, un punto de fusión de 65 o C y un punto de ebullición de 225 o C.
Ejercicio\(\PageIndex{6}\)
¿Estas moléculas son quirales?
Dibuja la imagen especular de cada compuesto y determinar si es superponible.
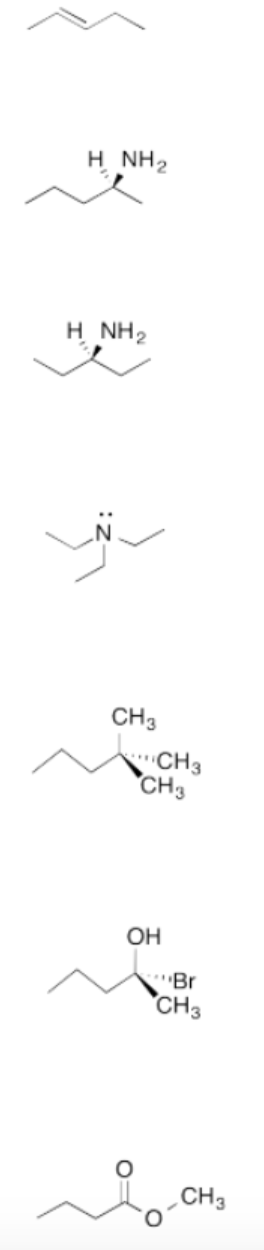
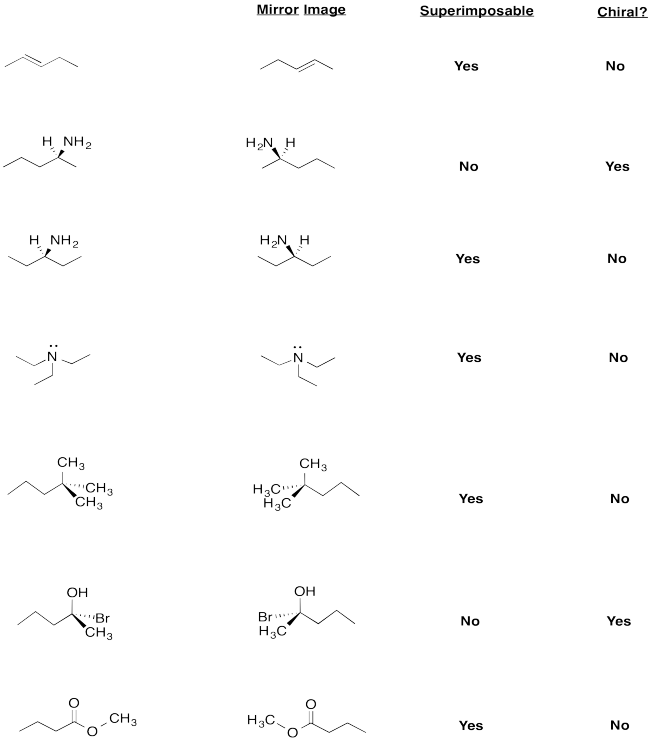
Siete moléculas diferentes. De arriba a abajo: 2-penteno, pentan-2-amina, pentan-3-amina, pentano, 2-bromo-2-pentanol, metil butanoa.Figura:Respuesta\(\PageIndex{10}\)
Ejercicio\(\PageIndex{7}\)
Encuentra un plano de simetría especular en las siguientes moléculas. Algunos pueden no tener planos espejo y por lo tanto son quirales. (Algunos pueden tener varios planos especulares, pero sólo es necesario encontrar uno para determinar que la molécula no es quiral). HINT: hay pocas barreras para la rotación sobre la mayoría de los bonos simples. Si se puede dibujar algún conformador en el que una molécula tenga un plano espejo, la molécula no será quiral.
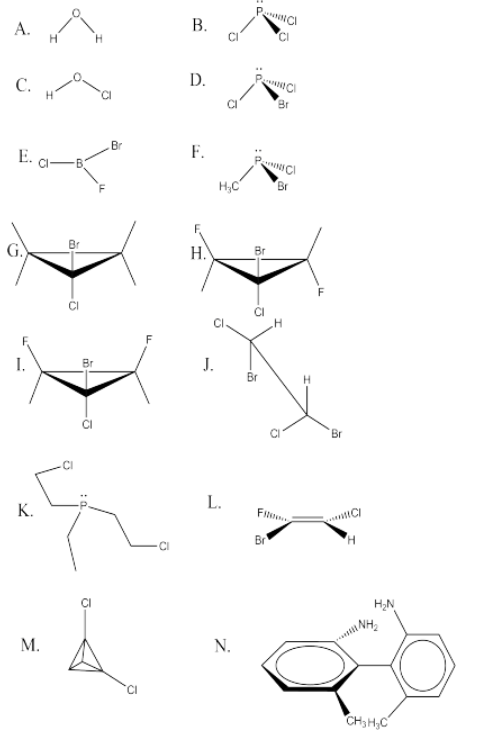
Figura:Respuesta\(\PageIndex{11}\) A.El plano de la página es un plano espejo. También hay una perpendicular a la página que refleja una H en la otra.Respuesta B.El plano de la página contiene un enlace P-Cl y biseca el otro CL's.Respuesta C.El plano de la página es un plano espejo.Respuesta D.Plano espejo contiene enlace P-Br y biseca el CL's.Respuesta E.No hay pareja solitaria en la B. Por lo tanto, todos los átomos se encuentran en un plano espejo.Respuesta F.No hay planos espejo—la molécula es por lo tanto quiral.Respuesta G.Hay un plano perpendicular a la página que contiene el Br y Cl y biseca el anillo de ciclopropano.Respuesta H.Sin planos espejo—la molécula es por lo tanto quiral.Respuesta I.Hay un plano perpendicular a la página que contiene el Br y Cl y biseca el anillo de ciclopropano.Respuesta J.El enlace C-C se puede girar 60 grados para que haya un plano perpendicular al eje de enlace C-C.Respuesta K.La unión C-C en uno de los brazos que contienen cloro se puede girar para que haya un plano espejo que pasa por el grupo etilo (sin Cl) y la P, y un brazo que contiene cloro es el reflejo del otro.Respuesta L.Como un doble enlace es plano, hay un plano espejo que contiene los seis átomos.Respuesta M.Hay un plano espejo que contiene dos C's y biseca los dos Cls.Respuesta N.No hay planos espejo —la molécula es por lo tanto quiral. Los anillos no están en el mismo plano debido a los grupos CH3 y NH2, que chocan entre sí. También evitan la rotación alrededor de la unión C-C entre los anillos.
Ejercicio\(\PageIndex{8}\)
Seleccione la imagen que ilustra un plano de simetría especular en el siguiente compuesto.
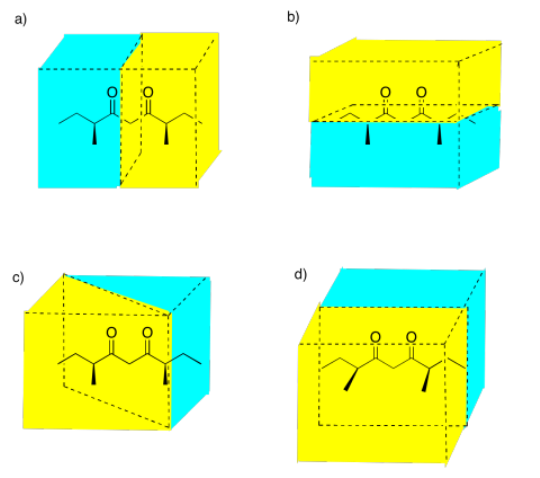
Figura:RespuestaImagen\(\PageIndex{12}\) (a) Posibles respuestas al Ejercicio 5.4.8, mostrando diferentes planos especulares entre una molécula de (3S,7S) -3,7-dimetilnonano-4,6-diona
Ejercicio\(\PageIndex{9}\)
Seleccione la imagen que ilustra un plano de simetría especular en el siguiente compuesto.
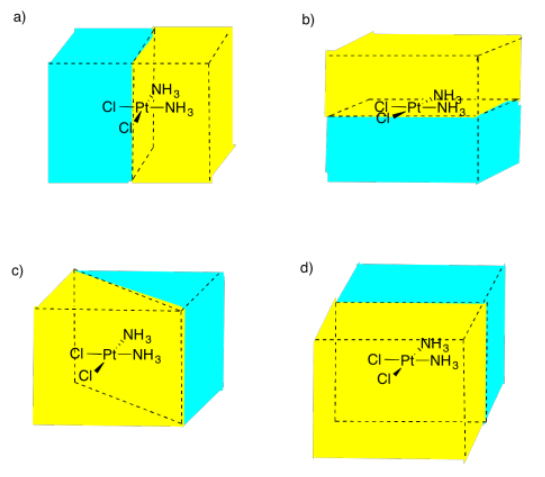
Figura:RespuestaImagen\(\PageIndex{13}\) (b) Posibles respuestas al Ejercicio 5.4.9, mostrando diferentes planos especulares entre una molécula de platino con dos átomos de cloro y dos grupos de amoníaco.
Ejercicio\(\PageIndex{10}\)
Seleccione la imagen que ilustra un plano de simetría especular en el siguiente compuesto.
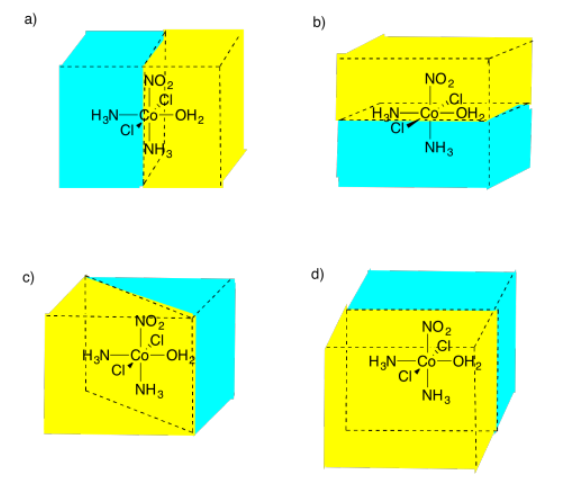
Figura:RespuestaImagen\(\PageIndex{14}\) (d) Posibles respuestas al Ejercicio 5.4.10, mostrando diferentes planos especulares entre una molécula de cobalto con dos átomos de cloro, dos grupos amoníaco, un grupo nitrato y un grupo OH2 unidos.
Ejercicio\(\PageIndex{11}\)
Seleccione la imagen que ilustra un plano de simetría especular en el siguiente compuesto.
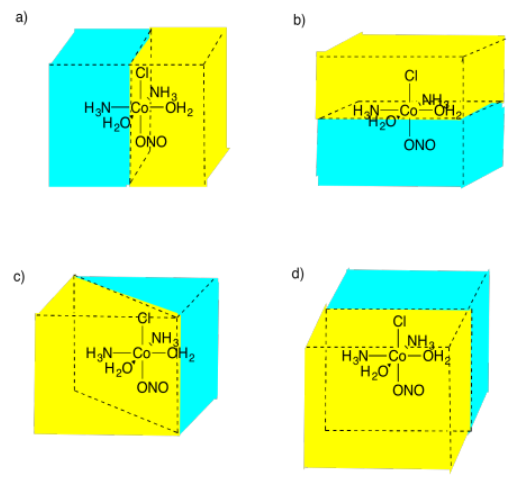
Figura:RespuestaImagen\(\PageIndex{15}\) (c) Posibles respuestas al Ejercicio 5.4.11, mostrando diferentes planos especulares entre una molécula de cobalto con un grupo nitrato, dos grupos de agua, dos grupos de amoníaco y un átomo de cloro.
Fotos fijas de modelos obtenidos usando Spartan 14 de Wavefunction, Inc., Irvine, California.

