5.6: Moléculas Biológicas Pequeñas
- Page ID
- 80570
Hay una serie de biomoléculas importantes que podrían ocurrir como enantiómeros, incluyendo aminoácidos y azúcares. En la mayoría de los casos, solo se produce un enantiómero (aunque algunos hongos, por ejemplo, son capaces de producir formas de imagen especular de estos compuestos). Luego veremos algunas de estas biomoléculas, pero primero veremos un compuesto que se presenta de forma natural en ambas formas enantioméricas.
La carvona es un metabolito secundario. Eso significa que es un compuesto de origen natural que no está directamente conectado a las funciones muy básicas de una célula, como la autorreplicación o la producción de energía. El papel de los metabolitos secundarios en la naturaleza suele ser difícil de determinar. Sin embargo, estos compuestos a menudo juegan un papel en la autodefensa, actuando como disuasores contra especies competidoras en una especie de escenario de guerra química a pequeña escala. También se utilizan con frecuencia en las comunicaciones; este papel ha sido estudiado más extensamente entre los insectos, que utilizan muchos compuestos para enviarse información entre sí.
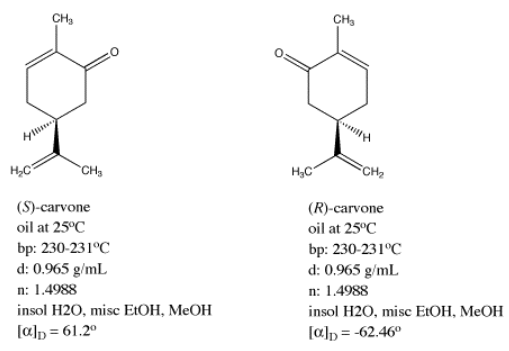
La carvona se produce en dos formas enantioméricas. Una de estas formas, llamada (-) -carvona, se encuentra en las hojas de menta, y es un contribuyente principal del olor distintivo de la menta. La otra forma, (+) -carvona, se encuentra en las semillas de comino. Esta forma tiene un olor muy diferente, y generalmente se usa para dar sabor al pan de centeno y otros alimentos de Europa del Este. La conectividad estructural en estos dos compuestos parece ser idéntica, pero no lo son en tres dimensiones, como encontrarás si construyes modelos de ellos. En cambio, (+) - y (-) -carvone son imágenes especulares entre sí, como una mano derecha y una mano izquierda.
Figura\(\PageIndex{2}\): Modelo de bola y varilla de (R) -carvona.
Ir a Animación SC5.1. Un modelo tridimensional de (R) -carvona.
Ir a Animación SC5.2. Un modelo tridimensional de (S) -carvona.
Tenga en cuenta que (+) -carvone es lo mismo que (S) -carvone. La designación (+) se basa en su valor de rotación óptica positiva, el cual se mide experimentalmente. La designación (S) está determinada por las reglas de Cahn-Ingold-Prelog para designar estereoquímica, las cuales tratan de observar los grupos adscritos a un centro quiral y asignar prioridad en función del número atómico. Sin embargo, el centro quiral de carvone en realidad tiene tres carbonos unidos a él; todos tienen el mismo número atómico. Necesitamos una nueva regla para romper el empate.
- Si dos grupos sustituyentes tienen el mismo número atómico, ir un enlace más allá al siguiente átomo.
- Si hay una diferencia entre el segundo nivel de átomos, detente.
- El grupo en el que te has encontrado con un número atómico mayor obtiene la máxima prioridad.
- Si no hay una diferencia clara, proceda un enlace adicional al siguiente conjunto de átomos, y así sucesivamente, hasta que encuentre una diferencia.
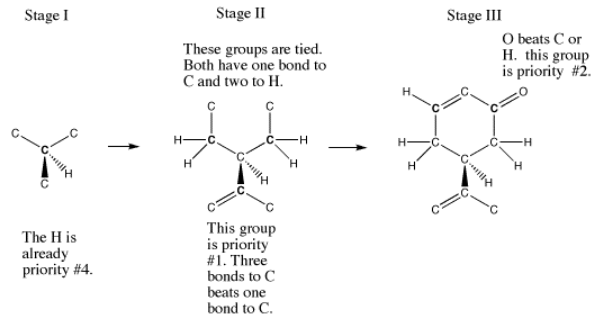
En carvone, este árbol de decisión funciona de la siguiente manera:
- El centro quiral está conectado a una H, una C, una C y una C.
- La H es la prioridad más baja.
- Una C eventualmente conduce a una C=O; sin embargo, en el segundo enlace desde el centro quiral, esta C está conectada a una C y dos H's.
- Una segunda C también forma parte del anillo de seis miembros, pero el C=O está más lejos en esta dirección. En el segundo enlace desde el centro quiral, esta C está conectada a una C y dos H's, igual que la primera.
- La tercera C es parte de un pequeño grupo de tres carbonos unido al anillo de seis miembros. En el segundo enlace desde el centro quiral, se conecta a una sola H y tiene dos enlaces a otra C (esto se cuenta como dos enlaces a C y uno a H).
- Esos dos primeros grupos de carbono son idénticos hasta el momento.
- Sin embargo, el tercer grupo es diferente; tiene un enlace extra a C, mientras que los otros tienen un enlace extra a H. C tiene un número atómico mayor que H, por lo que este grupo tiene mayor prioridad.
- La segunda prioridad más alta es la rama que alcanza el oxígeno en el tercer enlace desde el centro quiral.
¿Qué tan diferentes son exactamente estos dos compuestos, (+) - y (-) -carvona? ¿Son isómeros completamente diferentes, con diferentes propiedades físicas? En la mayoría de los sentidos, la respuesta es no. Estos dos compuestos tienen la misma apariencia (aceite incoloro), el mismo punto de ebullición (230 ° C), el mismo índice de refracción (1.499) y gravedad específica (0.965). Sin embargo, tienen rotaciones ópticas que son valores casi exactamente opuestos.
- Dos enantiómeros tienen las mismas propiedades físicas.
- Los enantiómeros tienen rotaciones ópticas opuestas.
Claramente tienen diferentes propiedades biológicas; ya que tienen olores ligeramente diferentes, deben encajar en receptores nasales ligeramente diferentes, señalando al cerebro si la persona a tu lado está masticando una barra de chicle o un trozo de pan de centeno. Esta complimentariedad de forma diferente no es sorprendente, así como no es sorprendente que una mano izquierda solo cabe en un guante de béisbol zurdo y no en uno diestro.
Hay otras razones por las que podríamos preocuparnos por una comprensión de los enantiómeros, aparte de las preferencias dietéticas y olfativas. Quizás el ejemplo más dramático de la importancia de los enantiómeros se puede encontrar en el caso de la talidomida. La talidomida fue un medicamento comúnmente recetado durante los años 50 y 60 para aliviar las náuseas y otros síntomas de las náuseas matutinas. De hecho, solo un enantiómero de talidomida tuvo algún efecto terapéutico al respecto. El otro enantiómero, además de ser terapéuticamente inútil en esta aplicación, posteriormente se encontró que era un teratógeno, lo que significa que produce pronunciados defectos congénitos. Obviamente esto no era algo bueno recetar a mujeres embarazadas. Los trabajadores de la industria farmacéutica son ahora mucho más conscientes de este tipo de consecuencias, aunque por supuesto no todos los problemas con los medicamentos pasan desapercibidos incluso a través de los extensos ensayos clínicos requeridos en Estados Unidos. Desde la era de la talidomida, sin embargo, se ha dedicado una tremenda cantidad de investigación en el campo de la química orgánica sintética a métodos para producir solo un enantiómero de un compuesto útil y no el otro. Este esfuerzo probablemente representa el objetivo más grande de la química orgánica sintética a lo largo del último cuarto de siglo.
- Los enantiómeros pueden tener propiedades biológicas muy diferentes.
- La obtención de compuestos enantioméricamente puros es muy importante en la medicina y la industria farmacéutica.
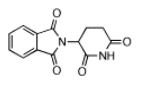
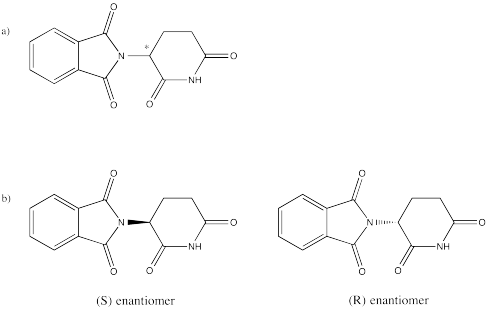
Ejercicio\(\PageIndex{1}\)
a) Dibujar talidomida e identificar el centro quiral con un asterisco.
b) Dibujar las dos posibles formas enantioméricas de talidomida.
- Contestar
-
Ejercicio\(\PageIndex{2}\)
Dibujar las dos formas enantioméricas del 2-butanol, CH 3 CH (OH) CH 2 CH 3. Etiquetar sus configuraciones.
- Contestar
-

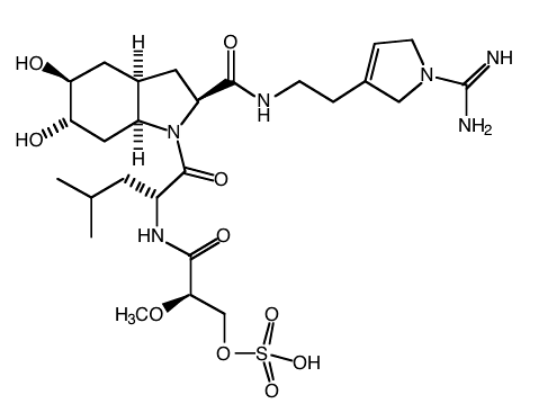
Ejercicio\(\PageIndex{3}\)
En ocasiones, los compuestos tienen muchos centros quirales en ellos. Para los siguientes compuestos, identificar cuatro centros quirales en cada uno, marcarlos con asteriscos e identificar cada centro como configuración R o S.
A continuación se presenta la estructura de la disinosina A, un potente inhibidor de trombina que en consecuencia previene la coagulación de la sangre.
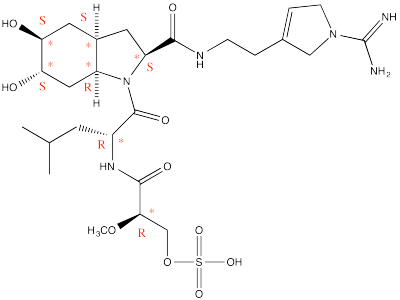
Figura\(\PageIndex{6}\) Respuesta
El ginkgolido B (abajo) es un metabolito secundario del árbol ginkgo, cuyos extractos se utilizan en la medicina china.

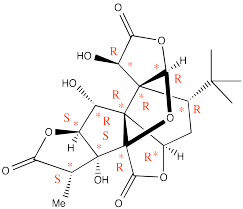
Figura:Respuesta\(\PageIndex{7}\)
La sanglifehrin A, que se muestra a continuación, es producida por una bacteria que puede encontrarse en el suelo de las plantaciones de café en Malawi. También es un candidato prometedor para el tratamiento de pacientes trasplantados de órganos debido a su potente actividad inmuno-supresora.

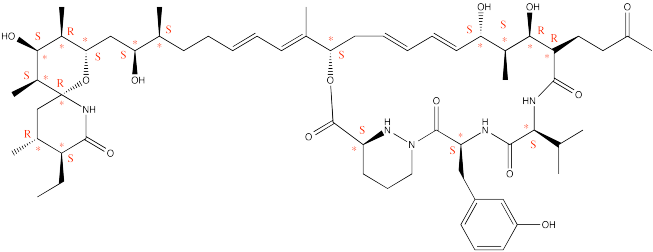
Figura:Respuesta\(\PageIndex{8}\)

