5.17: Estereoisómeros en Otras Geometrías- Octaedros
- Page ID
- 80507
Nota
Esta página muestra ejemplos de complejos de coordinación, en los que una serie de grupos llamados “ligandos” se unen a un átomo o ion metálico central. Para obtener más información sobre estos complejos, consulte la breve introducción aquí.
Anteriormente observamos los isómeros cis y trans en complejos planos cuadrados de platino. Otros complejos de metales de transición presentan isomería cis-trans. Los complejos octaédricos también pueden tener dos ligandos particulares adyacentes entre sí o en lados opuestos del átomo metálico. Por ejemplo, el catión [(NH 3) 4 CoCl 2] + tiene un isómero cis y un isómero trans.
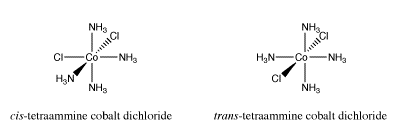
Ir a Animación SC17.1. Un modelo tridimensional de cis - (NH 3) 4 CoCl 2.
Ir a Animación SC17.2. Un modelo tridimensional de trans - (NH 3) 4 CoCl 2.
Ejercicio\(\PageIndex{1}\)
Dibujar isómeros cis y trans para los siguientes compuestos.
a) [Cr (OH 2) 4 Cl 2] + b) [Co (OH 2) 4 (SCN) 2] + c) [Co (NH 3) 4 (ONO) 2] + d) Pt (NH 3) 2 Cl 4 e) [Pt (NH 3) ) 4 Cl 2] 2+
- Responder
-
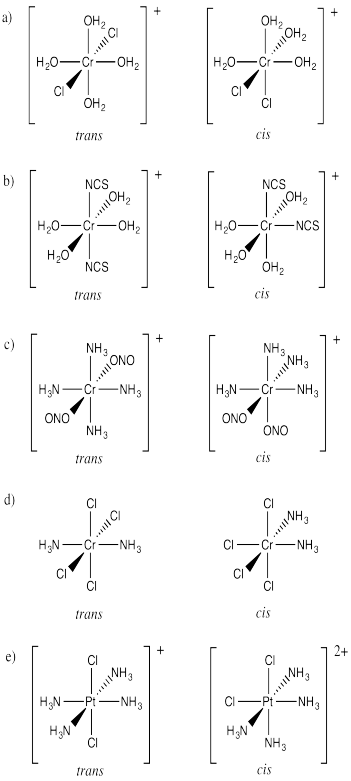
Los isómeros cis y trans se encuentran cuando hay dos ligandos cuya relación espacial puede describirse fácilmente como “uno al lado del otro” o “uno frente al otro”. ¿Y si hay más de dos ligandos que pueden adoptar diferentes arreglos geométricos alrededor de un metal?
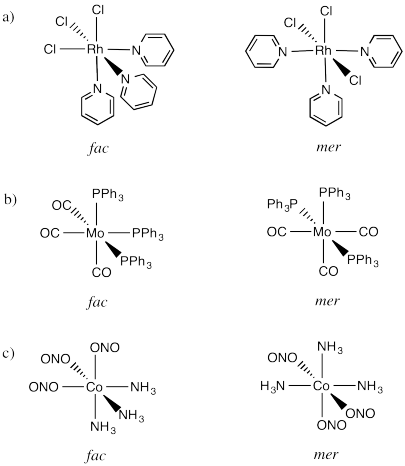
Un ejemplo lo encontramos en el complejo Co (NH 3) 3 Cl 3. En ese compuesto, que tiene una geometría octaédrica, los tres cloros podrían encontrarse todos en una fila, o podrían encontrarse agrupados en un triángulo. Cuando se encuentran tres ligandos seguidos en un octaedro, la geometría se llama "meridional" o simplemente "mer”. Cuando los tres se agrupan juntos en un triángulo, la relación geométrica se llama “facial" o simplemente "fac”.
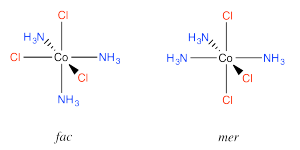
Ir a Animación SC17.3. Un modelo tridimensional de fac - (NH 3) 3 CoCl 3.
Ir a Animación SC17.4. Un modelo tridimensional de mer - (NH 3) 3 CoCl 3.
La designación fac se deriva de la ubicación de los tres ligandos cuyas posiciones se comparan: todos se encuentran a lo largo de una de las caras de un octaedro.
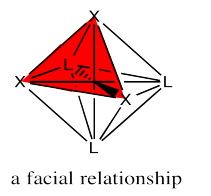
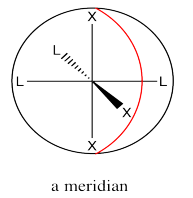
La designación mer proviene del hecho de que los tres ligandos se encuentran a lo largo de un meridiano. Un meridiano es simplemente una línea desde un ápice del compuesto hasta el vértice opuesto. Es como un meridiano en la tierra, desde el polo norte hasta el polo sur.
Ejercicio\(\PageIndex{2}\)
Dibujar isómeros fac y mer de los siguientes compuestos.
- RHCl 3 py 3 (py es un anillo de seis elementos con cinco carbonos y un nitrógeno)
- Mo (CO) 3 (PPh 3) 3
- Co (NH 3) 3 (NO 2) 3
- Responder
-
Algunos de los compuestos de esta página demuestran otro tipo de isomería. Se llama “isomería de enlace” e implica cuál de los átomos en el ligando está conectado al metal. Por ejemplo, los átomos en cada extremo de un ion tiocianato, SCN -, ambos tienen pares solitarios. Uno u otro podría unirse a un metal bajo diferentes circunstancias. El azufre podría estar unido al metal, o bien podría ser el nitrógeno. Estas dos opciones forman dos isómeros de enlace diferentes.
A menudo, para comunicar de qué isómero de enlace estamos hablando, el isómero deseado se indica colocando primero el átomo unido al metal en la fórmula del compuesto. Por ejemplo, escribir la fórmula [Co (OH 2) 4 (SCN) 2] + sugiere el isómero en el que el azufre está unido al cobalto. Escribir la fórmula [Co (OH 2) 4 (NCS) 2] + sugiere que el nitrógeno está unido al cobalto.
Ejercicio\(\PageIndex{3}\)
Dibujar estructuras para los siguientes isómeros de enlace.
- [Co (NH 3) 4 (NO 2) 2] + y [Co (NH 3) 4 (ONO) 2] +
- [Co (OH 2) 4 (SCN) 2] + y [Co (OH 2) 4 (NCS) 2] +
- [Cr (OH 2) 5 (CN)] 2+ y [Cr (OH 2) 5 (NC)] 2+

