5.18: Enantiómeros en Complejos Octaédricos
- Page ID
- 80548
Los enantiómeros son otro tipo de isómero que se presentan en los complejos metálicos octaédricos. Al igual que los complejos planos cuadrados de platino vistos antes, estos compuestos consisten en iones metálicos con otros átomos o grupos unidos a ellos. Más información sobre la unión de ligandos a metales se encuentra en la sección sobre ácidos y bases de Lewis.
Estos grupos que se unen a iones metálicos se denominan ligandos. Un ejemplo de un tipo de compuestos octaédricos que pueden formar enantiómeros son los complejos bidentados. En complejos bidentados (del griego dos dientes) o complejos quelantes (del cangrejo griego), un ligando se une muy fuertemente al metal porque se sujeta al metal a través de más de un átomo. La etilendiamina es un ejemplo de un ligando bidentado.
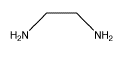
- Los ligandos bidentados se unen muy fuertemente a un metal porque forman dos enlaces con él, en lugar de solo uno.
- En un complejo octaédrico, los dos átomos donantes en un ligando bidentado se unen cis entre sí. No pueden alcanzar todo el camino alrededor de la molécula para unirse trans entre sí.
La relación espacial entre el metal y los dos átomos conectados a él desde el mismo ligando forma un plano. Si más de un ligando bidentado está conectado al metal, la orientación relativa de un plano a otro crea la posibilidad de imágenes especulares. Un complejo que contiene tres ligandos bidentados puede tomar la forma de una hélice zurda o una hélice diestra.
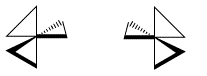
Si girabas esta hélice, ¿en qué dirección se empujaría el aire? A lo mejor es un propulsor de avión o tal vez es una aspa de ventilador. Si giraba una aspa de ventilador lambda en sentido contrario a las agujas del reloj, soplaría aire frío sobre usted. Tendrías que girar un ventilador delta en sentido horario para refrescarte.

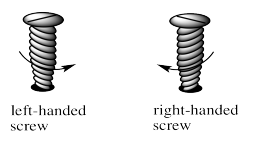
Estas formas se describen alternativamente como un tornillo para zurdos y un tornillo para diestros. Si quieres atornillar un tornillo diestro en un piso, giras el destornillador en el sentido de las agujas del reloj. Si quieres atornillar un tornillo diestro en un piso, giras el destornillador en sentido contrario a las agujas del reloj. Los tornillos son quirales de la misma manera que una hélice es quiral. Las roscas en el ciclo del tornillo ya sea en sentido horario o antihorario ya que corren por la longitud del tornillo.
Si puedes imaginarte girando la forma del propulsor “delta” o “lambda” para que se atornille en la página detrás de él, ¿en qué dirección la girarías?

Girarías el tornillo lambda en sentido antihorario para enviarlo a la página detrás de él. Tendrías que girar el tornillo delta en sentido contrario; girarlo en sentido horario lo enviaría a la página.
Los ejemplos de esta relación enantiomérica incluyen complejos de cobalto de ligandos bidentados.
Ir a Animación SC17.3. Un modelo tridimensional de Δ-Co (en) 3.
Ir a Animación SC17.3. Un modelo tridimensional de λ-Co (en) 3.
Estas relaciones también se ven cuando solo hay dos ligandos bidentados en el compuesto.
Ir a Animación SC17.3. Un modelo tridimensional de λCO (en) 2 (NH 3 Cl.
Ir a Animación SC17.3. Un modelo tridimensional de ΔCo (en) 2 (NH 3 Cl.
¿Qué sabemos de los enantiómeros?
- los enantiómeros tienen idénticas propiedades físicas, excepto...
- los enantiómeros tienen rotación óptica opuesta.
Este tipo de complejos fueron históricamente importantes para demostrar cómo pequeñas moléculas e iones se unían a cationes metálicos. Al demostrar que algunos complejos metálicos eran quirales y mostraban actividad óptica, trabajadores de principios del siglo XX como Alfred Werner pudieron descartar algunas ideas en competencia sobre las estructuras de los compuestos metálicos.
Hoy en día, sabemos que los complejos metálicos juegan un papel importante en las enzimas en biología, y el trabajo de Werner sobre los complejos metálicos sentó las bases para cómo pensamos sobre estos complejos.
Además, la estereoquímica en los complejos metálicos se hizo muy importante a finales del siglo XX, especialmente porque las compañías farmacéuticas buscaron catalizadores que pudieran ayudar en la producción de un enantiómero de un fármaco, y no del otro, para maximizar la efectividad farmacéutica y minimizar los efectos secundarios.
Ejercicio\(\PageIndex{1}\)
Identificar las relaciones entre los siguientes pares de iones oxalato de hierro (III).
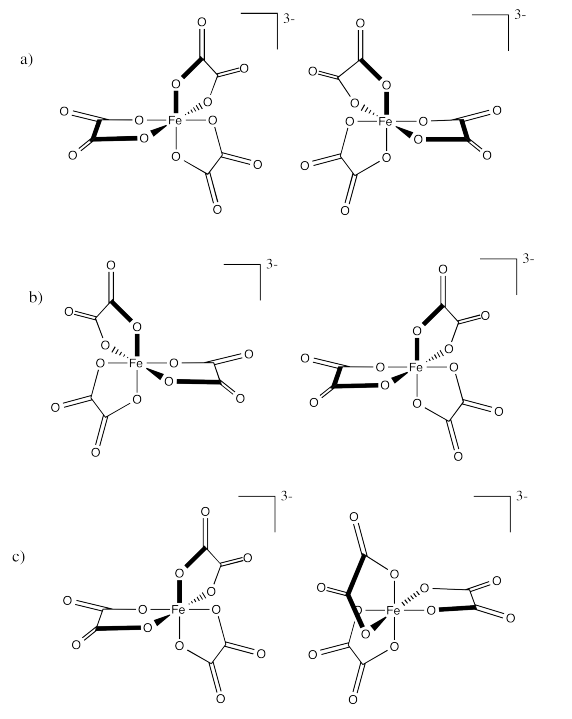
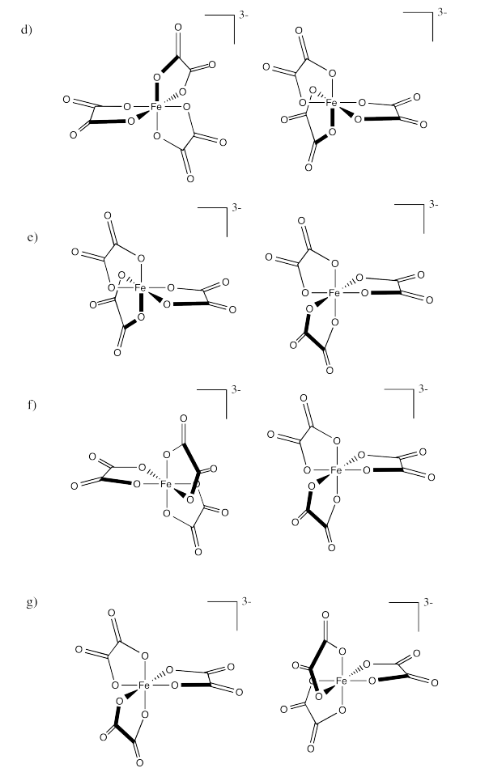
- Respuesta a:
-
Enantiómeros
- Respuesta b:
-
Enantiómeros
- Respuesta c:
-
idéntico
- Respuesta d:
-
idéntico
- Respuesta e:
-
Enantiómeros
- Respuesta f:
-
idéntico
- Respuesta g:
-
Enantiómeros
Ejercicio\(\PageIndex{2}\)
Indicar si cada uno de los siguientes compuestos es el isómero Δ o λ y extraer su enantiómero.
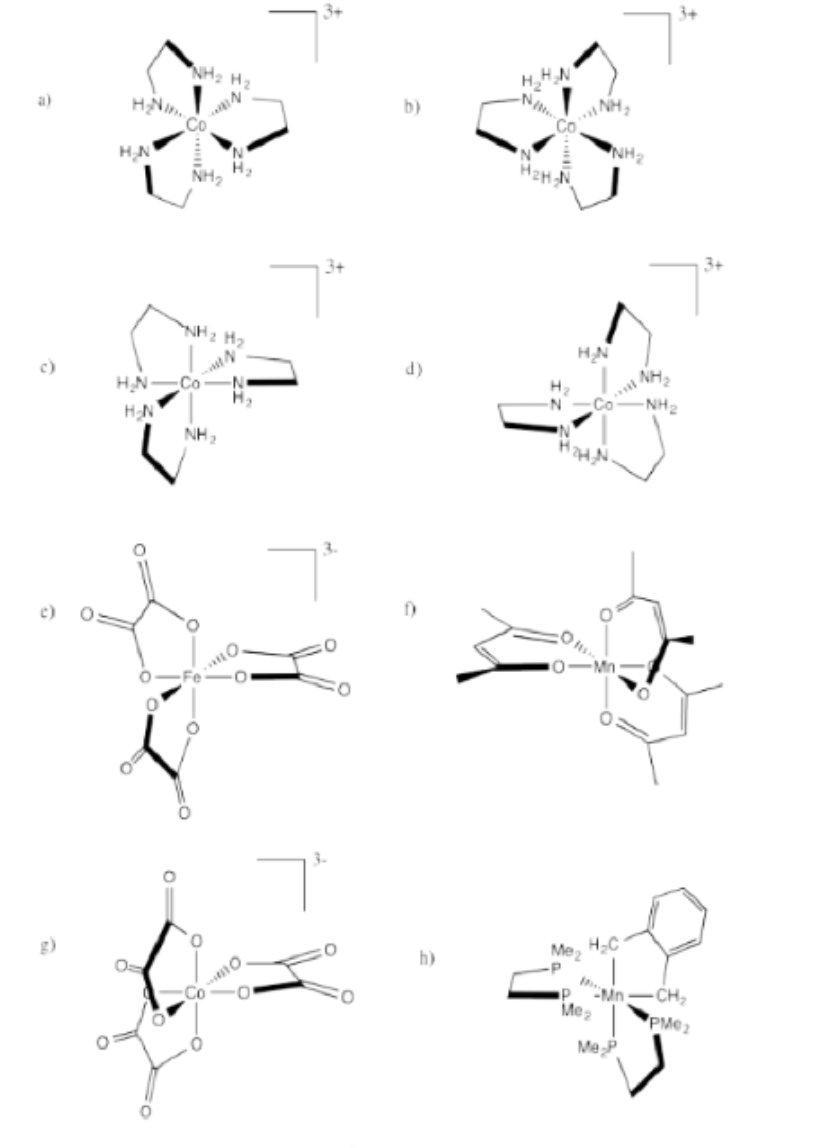
- Respuesta a:
-
Δ
- Respuesta b:
-
Λ
- Respuesta c:
-
Δ
- Respuesta d:
-
Λ
- Respuesta e:
-
Δ
- Respuesta f:
-
Δ
- Respuesta g:
-
Λ
- Respuesta h:
-
Λ
Ejercicio: ¿Cuántos estereoisómeros tiene un complejo octaédrico? (contribución de B.J. Johnson)

