12.9: Soluciones para problemas seleccionados
- Page ID
- 80647
Ejercicio 12.1.1:
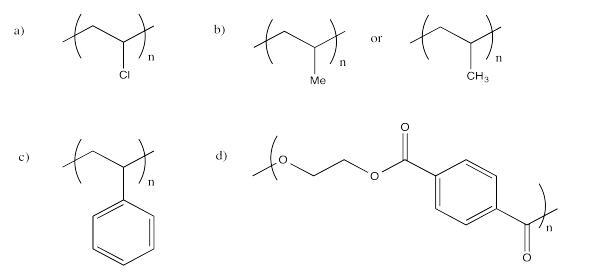
Ejercicio 12.1.2:
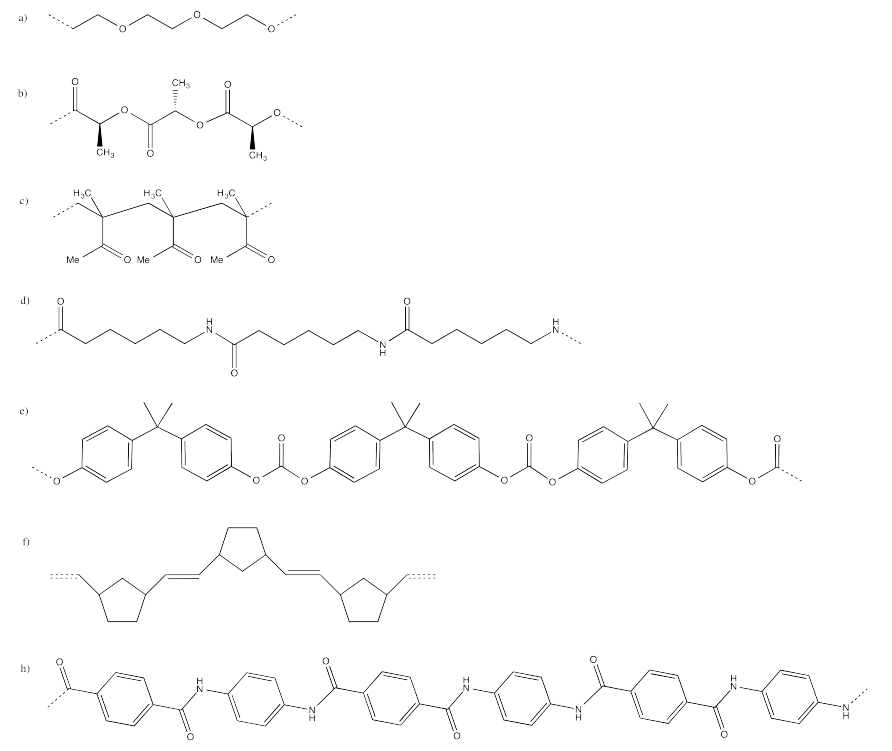
Ejercicio 12.1.4:
b) Las cadenas de HDPE son capaces de empaquetarse más firmemente que el LDPE, en las que las ramas evitan el empaquetamiento apretado de la columna vertebral. Esa diferencia hace que el LDPE sea menos denso que el HDPE.
Ejercicio 12.2.1:
- El agua puede en principio formar cuatro enlaces de hidrógeno: puede donar dos y aceptar dos. El etilenglicol tiene dos grupos OH, por lo que puede donar dos enlaces H y aceptar cuatro. Esa adherencia mejorada es responsable de su mayor viscosidad.
- El aceite de oliva no enlaza hidrógeno; ni siquiera es muy polar. Sin embargo, es un triglicérido y sus cadenas de ácidos grasos son aproximadamente 80% de ácido oleico y ácido linoleico, que son ambas cadenas de 18 carbonos. Por lo que la molécula promedio de aceite de oliva contiene tres 18 ramas de carbono, lo que lleva a un modesto nivel de enredo. Su viscosidad es mucho mayor que la del agua.
- El metanol solo tiene un enlace OH, por lo que tiene un poco menos de enlaces de hidrógeno que el agua, pero no lo suficiente de nada más para formar otras interacciones. Su viscosidad es un poco menor que la del agua.
- La 2-propanona no tiene ningún enlace de hidrógeno, aunque sí tiene un momento dipolar para mantener unidas diferentes moléculas. Su viscosidad es un poco menor que la del metanol.
- El hexano no tiene dipolo ni enlaces de hidrógeno. Realmente es demasiado corto para enredarse. Las moléculas solo se atraen entre sí a través de interacciones débiles de dispersión de Londres. Su viscosidad es un poco menor que la de 2-propanona.
Ejercicio 12.2.2:
Cuanto mayor sea el número de unidades repetitivas, mayor será el peso molecular. Además, cuanto mayor sea el número de unidades repetitivas, mayor será el enredo y mayor será la viscosidad.
Ejercicio 12.3.1:
Puedes pensar en un largo de cadena flotando sobre una hebra vecina como un gancho de agarre, luego tirando de sí misma a medida que el enlace continúa girando, saltando sobre la otra cadena.
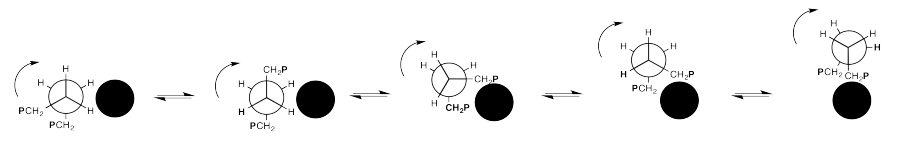
Ejercicio 12.3.2:
- Cuanto mayor sea el número de unidades repetitivas, mayor será el enredo. El enredo actúa como impedimento del movimiento de las cadenas, aumentando la temperatura a la que se restringe el movimiento de la cadena (es decir, aumentar el volumen mínimo necesario para que las cadenas vuelvan a moverse). Por ejemplo, el polipropileno tiene un T g mayor que el polietileno, y el del poliestireno es aún mayor (aunque factores adicionales influyen en la T g de PS).
- El aumento de la polaridad aumenta la atracción entre cadenas e incluso puede conducir a la formación de reticulaciones físicas entre cadenas. Esta mayor interacción impide que las cadenas se muevan libremente y eleva la temperatura de transición vítrea. Por ejemplo, la polilactida, el poli (cloruro de vinilo) y el poli (metacrilato de metilo) tienen valores mucho más altos de T g que el polipropileno.
- Si la columna vertebral es rígida, la reptación se ve obstaculizada porque la cadena no puede adoptar diferentes conformaciones. El flujo de la cadena se restringe más fácilmente y la T g es mayor. Tanto el kevlar como el polinorborneno tienen esqueletos rígidos debido a los anillos aromáticos y alifáticos, respectivamente, que forman parte de la cadena principal. Ambos polímeros tienen valores de T g mucho más altos que el poliestireno, en el que los aromáticos cuelgan de una cadena flexible.
Ejercicio 12.3.5:
a) cauchoso b) vítreo c) vítreo d) gomoso
Ejercicio 12.4.1:
Puede haber diferentes arquitecturas que se prestan a las mismas aplicaciones.
- Una estructura de cadena regular podría enrollarse en un hilo fácilmente. Habría suficiente enredo para mantener unidos a los tres.
- La estructura unida al otro ayudaría a que una banda de goma se recuperara de nuevo a su forma original. Sin embargo, demasiada reticulación haría que fuera demasiado difícil estirar la banda de goma.
- Un dendrímero tiene muchos rincones y grietas que podrían usarse para esponjar los productos farmacéuticos y liberarlos lentamente más tarde.
- Una estructura ramificada o reticulada podría formar una buena red bidimensional para proporcionar un recubrimiento protector.
Ejercicio 12.5.1:
El bloque polar de acetato de vinilo del primer polímero contiene grupos carbonilo que se atraerían entre sí por interacciones dipolo-dipolo. Es fácil imaginar estos segmentos formando reticulaciones físicas. La cadena hidrocarbonada en el bloque medio proporcionaría flexibilidad.
Aunque no polares, los grupos benceno en el estireno son planos y pueden apilarse junto con fuerzas de dispersión relativamente fuertes en Londres. La mayor Tg de poliestireno haría que estos bloques fueran mucho más rígidos que el bloque de poliisopreno más flexible en el medio.
Ejercicio 12.6.1:
El polímero telequélico tiene dos extremos de crecimiento por cadena, por lo que crece dos veces más rápido que una cadena normal.
Ejercicio 12.6.2:
Si esta cadena alcanzara el 100% de conversión, entonces el grado de polimerización sería 500. A 85% de conversión, DP = 425.
Ejercicio 12.6.3:
A medida que aumenta el número de unidades repetidas, el peso molecular aumenta.
Ejercicio 12.7.2:
El peso molecular es la suma de los pesos de todas las unidades repetidas más el peso de los grupos terminales.
- \(MW = 1000 units \times 104.15 \frac{Da}{unit} + 2 Da = 104152 Da\)
- \(MW = 200 units \times 72.06 \frac{Da}{unit} + 2 Da = 14412 Da\)(basado en 200 simples unidades repetitivas, pero este es un caso complicado. En la práctica común, el PLA se elabora a partir de un monómero dimérico, formando cada monómero dos unidades repetidas en la cadena, por lo que un grado de polimerización de 200 corresponde realmente a 400 unidades repetidas en la cadena, lo que tendría el doble de peso molecular).
- \(MW = 50 units \times 44.05 \frac{Da}{unit} + 2Da = 2202 Da\)
- \(MW = 100000 units \times 42.08 \frac{Da}{unit} + 2 Da = 4208002 Da\)
Tenga en cuenta que, en este caso, los grupos finales no hacen ninguna diferencia apreciable en el peso porque son muy pequeños.
Ejercicio 12.7.3:
MW = peso (en g)/moles
- 5827 Da
- 1052 Da
- 703,000 Da o 703 kDa
Ejercicio 12.7.4:
= M w/M n
- 1.14
- 1.22
- 1.56
- 1.76
- 1.62
Ejercicio 12.7.5:
- 3,000 D
- 5,000 D
Ejercicio 12.7.6:
Cuanto más larga es la cadena en el polímero A, más grande es la esfera en la que se enrolla. No hay mucho problema comparando muestras de polímero A entre sí, siempre que tengamos alguna manera de calibrar el tamaño de la esfera con la longitud de la cadena.
Sin embargo, el polímero B parece estar más enrollado que A. Una esfera relativamente pequeña podría empaquetar mucha más cadena. Tendríamos que ser cautelosos al comparar el tamaño de la esfera de B con el de A y sacar conclusiones sobre la longitud de la cadena o el peso molecular.
Ejercicio 12.7.7:
Ejercicio 12.7.8:
16:1.
Ejercicio 12.7.9:
Es\(OH + 4 \times (CH_{2}CH_{2}O) + H.\) Eso es\(17 + (4 \times 44) + 1 = 18 + 176=194D\)
Ejercicio 12.7.10:
La relación de c a b es 145:18 = 8:1. Sin embargo, el número de hidrógenos en la unidad repetida c es 4; el número de hidrógenos en el grupo final b es 2. Esa relación es 2:1. Eso significa que la comparación que necesitamos es (145/4)/(18:2) = 4:1. El grado de polimerización es 4.
Ejercicio 12.8.1:
a) La viscosidad está relacionada con la cantidad de arrastre en el fluido. Cuanto más arrastre, los solutos más lentos serán capaces de moverse, por lo que el coeficiente de difusión está inversamente relacionado con la viscosidad (es decir, un coeficiente de difusión mayor debería correlacionarse con menor viscosidad).
b) El polímero de cadena regular se difunde más fácilmente que el copolímero injerto/ensamblaje supramolecular porque las cadenas colgantes en este último conducen a un mayor enredo.
Ejercicio 12.8.2:
b) Los pares solitarios en los oxígenos en el huésped se sentirían atraídos por los nitrógenos cargados positivamente en el huésped. Los grupos N-H en el huésped incluso actuarían como donantes de enlaces de hidrógeno a los oxígenos.
c) Este ensamblaje supramolecular forma una arquitectura reticulada.
d) El gel es elástico porque, aunque contiene cadenas flexibles y puede distorsionarse hasta cierto punto, en algún momento las reticulaciones lo tiran de nuevo a su posición original.
e) Cuando se corta el gel, probablemente algunos invitados son alejados de sus anfitriones a lo largo de la superficie del corte. Cuando los bordes se vuelven a colocar juntos, los invitados pueden encontrar nuevos anfitriones y volver a formar la estructura reticulada.
Ejercicio 12.8.3:
- El paladio en el complejo es Pd (II), por lo que es d8 y la estructura de la reticulación es cuadrada plana en paladio. El intercambio de ligandos probablemente ocurre a través de un proceso asociativo. Eso significa que antes de que la PVP se disocie, se uniría un nuevo ligando; este ligando es probablemente una molécula solvente, DMSO.
- El aumento del hacinamiento en el ligando sustituido con etilo, en comparación con el metilo, dificultaría la aproximación del DMSO durante la sustitución, ralentizando la reacción.
- K b se define como k a/k d, la constante de velocidad para el paso de asociación sobre la constante de velocidad para la etapa de disociación. Es la constante de unión para la formación de PvP-Pd.
- El paladio es un metal de transición de segunda fila mientras que el platino es un metal de transición de tercera fila. Los metales de la tercera fila tienen mayores energías de división del campo ligando que los metales de la segunda fila y generalmente son menos lábiles.

