13.8: Simetría y Mezcla
- Page ID
- 80455
Al principio, aproximamos y dijimos que sólo orbitales del mismo tipo pueden interactuar entre sí: s orbitales con s orbitales, p x orbitales con p x orbitales, y así sucesivamente. Una de las diferencias cualitativas entre un cálculo real de MO y nuestro enfoque de scrap-paper es que la mezcla ocurre entre diferentes tipos de orbitales. No obstante, siguen aplicándose restricciones.
Las interacciones orbitales se rigen por la simetría. Sin tomar un curso completo de Teoría de Grupos (la rama de las matemáticas que se ocupa de la simetría), podemos aprender un poco sobre la simetría tal como la necesitamos.
Uno de los aspectos más básicos de la simetría molecular se aplica a las moléculas diatómicas. Ese elemento es la simetría alrededor del eje del enlace. Si una molécula gira alrededor de su eje de enlace —como si los dos átomos fueran las dos ruedas de un eje de un vagón o de un automóvil—, ¿cambia la orientación orbital?
- Un s orbital es tan simétrico que se ve igual desde cualquier dirección. No importa cómo lo gires, se ve igual. En una molécula diatómica, una órbita s es simétrica con respecto a la rotación alrededor del eje del enlace.
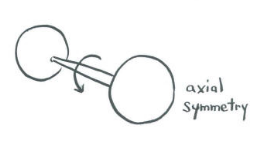
- ¿Y qué pasa con los orbitales p? Supongamos que el eje de unión es el eje z. La rotación alrededor del eje z no produce ningún cambio en la orientación de un orbital pz. El orbital gira pero no se mueve a través del espacio.
- La rotación alrededor del eje z produce un cambio visible en la orientación de un orbital p x. El orbital gira como una hélice alrededor del eje.
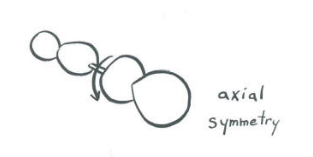
La rotación alrededor del eje z produce un cambio visible en la orientación de un orbital p y. El orbital gira como una hélice alrededor del eje.

Nuestra imagen de las diatómicas del grupo principal cambia ligeramente con esta noticia. Los orbitales de unión p permanecen inalterados. Sin embargo, los orbitales de unión comparten simetría axial. Eso significa que los orbitales de unión s, lejos de mantenerse completamente separados entre sí, en realidad se mezclan en algunos casos. Eso significa que puede haber un orbital que esté compuesto por un orbital s y pz de un átomo, así como un orbital s y pz del otro. La única restricción es que, debido a que se permite mezclar cuatro orbitales atómicos, se deben producir cuatro nuevos orbitales moleculares.
- Como resultado, en la diatómica, una órbita s comparte un elemento de simetría con una orbital p, pero no con las otras.
- Las reglas de las matemáticas y la mecánica cuántica permiten que los orbitales de las diatómicas interactúen con un orbital p con el que comparte simetría, pero no con los otros dos.
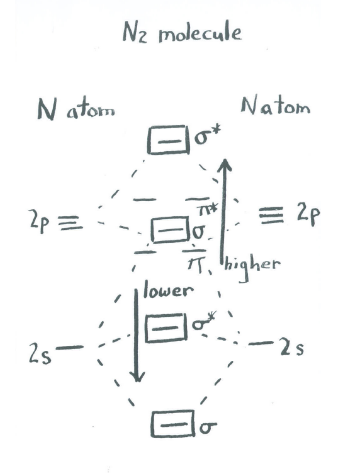
Otra forma de pensar sobre este efecto de mezcla es tomar la imagen orbital molecular que ya hicimos para dinitrogen y luego decir que los orbitales de unión sigma pueden interactuar entre sí. Eso significa que pueden empujarse entre sí hacia arriba o hacia abajo en energía, mezclándose para crear nuevas combinaciones con nuevas energías. La extensión de esta mezcla varía a lo largo de la tabla periódica.
Para las diatómicas del grupo principal como\(\ce{N2}\), el efecto es disminuir la energía de los orbitales sigma inferiores (relacionados con los niveles atómicos s) y elevar la energía de los orbitales sigma superiores (relacionados con los niveles atómicos p). El resultado es que el segundo orbital sigma más alto se desplaza ligeramente por encima de la energía de los niveles pi, en lugar de estar ligeramente por debajo de ellos. Esto no cambia mucho las conclusiones generales, pero es una interacción favorable porque los niveles sigma inferiores, que están ocupados por electrones, se mueven hacia una energía más baja.

