13.9: Cuando diferentes átomos se unen entre sí
- Page ID
- 80514
Dos átomos diferentes del grupo principal a menudo se unen para formar moléculas diatómicas. En la mayoría de los casos, el panorama orbital molecular no cambia mucho de lo que ya hemos visto.
Desde el punto de vista de Lewis, algunos compuestos muy simples incluyen los halogenuros de hidrógeno. Por ejemplo, HF contiene un hidrógeno unido a un flúor.
Una imagen orbital molecular de HF podría involucrar un orbital s sobre hidrógeno interactuando con un orbital s en flúor. Puede ser que los orbitales de tres p sobre flúor se mantengan fuera del camino, no interactúen con el hidrógeno y permanezcan inalterados en la molécula. En ese caso, estamos ante una imagen de dos s orbitales combinándose, como en dihidrógeno.
La única diferencia está en los niveles de energía de partida de los electrones atómicos. Los electrones en flúor están a menor energía que el electrón en hidrógeno. Así, la imagen orbital molecular está sesgada, con un lado del diagrama a menor energía que el otro.
- Las diferencias energéticas de los dos átomos se muestran en el diagrama de interacción orbital molecular.
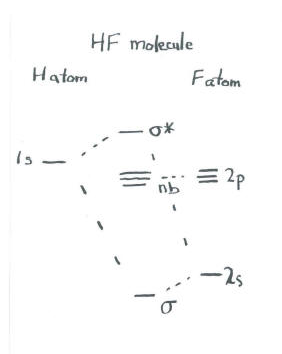
Hay una interpretación física para este desnivel. Observe que el orbital de enlace está más cerca en energía al flúor que al hidrógeno. A menudo, la similitud energética se correlaciona con la similitud estructural. Pensamos que estos electrones de unión están físicamente más cerca del flúor también. En otras palabras, los electrones en este enlace no son igualmente compartidos, sino que son retenidos más de cerca por el flúor.
- Una similitud más energética con un átomo implica que los electrones se encuentran más cerca de ese átomo.
Esta idea es consistente con nuestras ideas sobre la unión entre átomos disímiles. Pensaríamos en el enlace H-F como un enlace polar, covalente.
La idea de que los electrones del flúor están a menor energía puede ser confusa. Un electrón 1s en flúor está ciertamente a menor energía que un electrón 2s o 2p en flúor. Sin embargo, un electrón 1s en hidrógeno no está necesariamente a una energía menor que un electrón 2s o 2p en flúor. Todos los electrones en flúor están a menor energía que el electrón en hidrógeno porque el flúor tiene una carga nuclear mucho mayor, con relativamente poco blindaje de sus propios electrones 1s. El flúor tiene un alto eff Z, como lo demuestra su alta afinidad electrónica (alta atracción para más electrones) y alto potencial de ionización (gran cantidad de energía necesaria para despojar un electrón).
Ejercicio\(\PageIndex{1}\)
Construir diagramas de interacción orbitales moleculares para las siguientes moléculas diatómicas. En cada caso, ¿cuál es la orden de fianza? ¿El compuesto es diamagnético o paramagnético?
- monóxido de carbono, CO.
- óxido nitroso, NO.
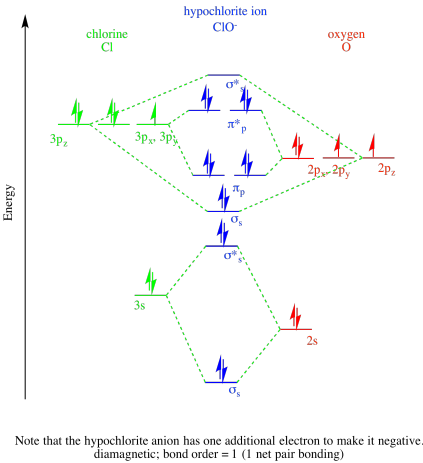
- ion hipoclorito, ClO -.
- Contestar a
-
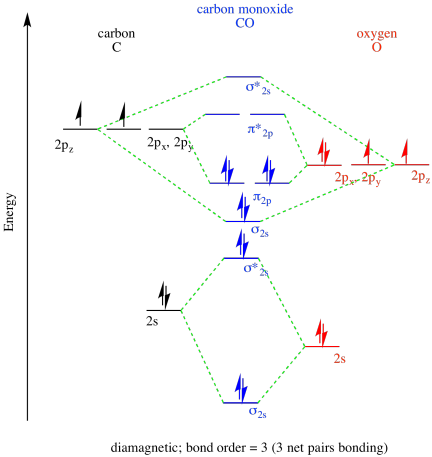
- Respuesta b
-
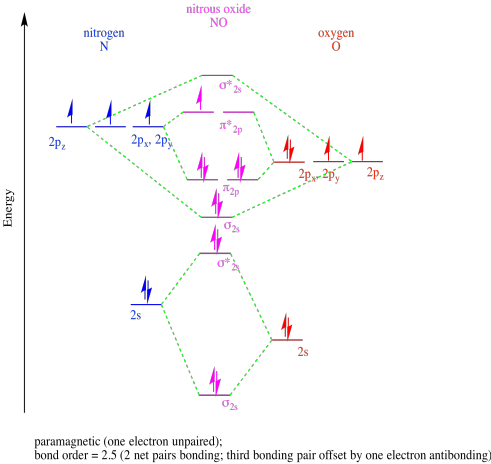
- Respuesta c
-