13.10: Otra complicación en la mezcla HF- Orbital
- Page ID
- 80526
Anteriormente, hablamos del hecho de que los orbitales axialmente simétricos pueden mezclarse para producir nuevas combinaciones. En HF, observamos el solapamiento del orbital 2s en flúor con el orbital 1s en hidrógeno. Sin embargo, uno de los orbitales 2p puede estar a lo largo del eje del enlace y compartir simetría axial con el orbital de hidrógeno 1s.
Llamaremos a este orbital de flúor el orbital 2p z. También podríamos etiquetarlo p x o p y, pero muchas personas se refieren al orbital p a lo largo del eje del enlace como la p z. Tenga en cuenta que los orbitales 2p que son perpendiculares al eje del enlace no pueden interactuar con el orbital de hidrógeno 1s. Debido a que el eje del enlace cruza el orbital p en un nodo, donde el orbital p cambia de fase, el átomo de hidrógeno no puede formar una combinación en fase o fuera de fase con este orbital p. En realidad estaría en fase con una parte de la órbita y fuera de fase con la otra. En cambio, estos orbitales simplemente no interactúan.
- El hidrógeno 1s se puede combinar con el flúor 2s y el flúor 2p z.
- Ahora hay tres orbitales que pueden combinarse. Producirán tres nuevos orbitales.
- Deberíamos considerar juntos estos tres orbitales. ¿Qué diferentes combinaciones pueden hacer?
- Los orbitales podrían estar todos en fase, es decir, los 1s de hidrógeno están en fase con los 2s de flúor, y también en fase con la parte del 2p z que se solapa con él.
- Esta será una combinación de unión de baja energía.
- Los orbitales podrían estar completamente desfasados. Los 1s de hidrógeno están desfasados con los 2s de flúor, y también desfasados con la parte del 2p z que se solapa con él.
- Esta será una combinación de alta energía, antiadhesión.
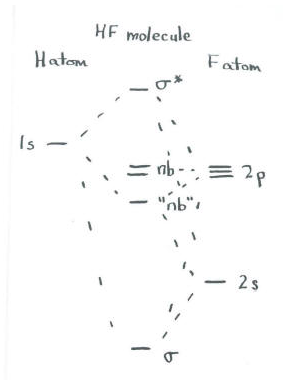
La tercera combinación es un poco más sutil. La otra posibilidad es que el orbital 1s del hidrógeno esté en fase con uno orbital de flúor, pero fuera de fase con el otro. Sin embargo, eso significa que podría estar en fase con los 2s pero fuera de fase con el 2p z, o viceversa. Eso significa que hay dos combinaciones más, para un total de cuatro. Sin embargo, dado que estamos utilizando sólo tres orbitales atómicos, podemos producir sólo tres orbitales moleculares. Estas dos posibles combinaciones deben de alguna manera reducirse matemáticamente a una sola.
Una vez más, la mezcla que ocurre a partir de la simetría tiene algunos efectos cuantitativos sobre las energías de los electrones, pero en este caso el efecto cualitativo es un cambio sutil en el orden de los niveles de energía.
- Una tercera combinación será parcialmente adhesiva y parcialmente antiadhesión.
- Esta combinación será algo así como un orbital no enlazante (aunque su energía exacta puede estar ligeramente estabilizada o desestabilizada con respecto a los átomos originales).

