13.11: Geometría y contribución orbital a la unión
- Page ID
- 80485
¿Y si una molécula tuviera tres o más átomos en ella? Ya no podemos dibujar un simple diagrama de interacción orbital molecular, en el que mostramos en el átomo en cada lado y los resultados moleculares en el medio, porque no tenemos dos átomos que se unan para compartir electrones.
En cambio, miramos diagramas MO ligeramente simplificados en los que hacemos un seguimiento del resultado de todos esos orbitales atómicos que se unen para hacer nuevos orbitales. A un nivel muy simple, el resultado cualitativo es siempre el mismo y puede predecirse aproximadamente con base en la estructura de Lewis.
- Hay un MO de vinculación por cada vínculo que veas en la estructura de Lewis. Estos niveles son bajos en el diagrama.
- Cada MO de unión tiene un MO antiadhesión correspondiente. Estos niveles son altos en el diagrama.
- Los pares solitarios en la estructura de Lewis corresponden a orbitales no vinculantes. Estos niveles son intermedios en el diagrama.
- El diagrama está poblado por el mismo número de electrones que se ve en la estructura de Lewis.
Ejercicio\(\PageIndex{1}\)
a) Este es el diagrama MO para etano.
Dibuja una estructura Lewis de etano.
Rellene los electrones en el diagrama MO.
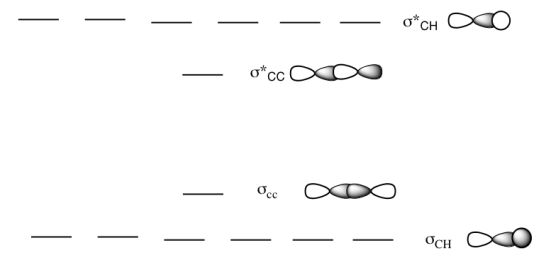
Contestar a-

b) Este es el diagrama MO para propano.
Dibuja una estructura Lewis de propano.
Rellene los electrones en el diagrama MO.
Agrega las caricaturas MO faltantes para los diferentes niveles.
Etiquetar el HOMO y LUMO.
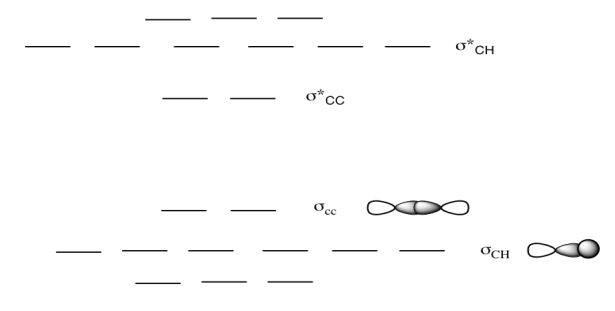
Respuesta b-

c) Este es el diagrama MO para butano.
Dibuja una estructura Lewis de butano.
Rellene los electrones en el diagrama MO.
¿Qué sucede con el diagrama MO a medida que aumenta la longitud de la cadena de alcanos?
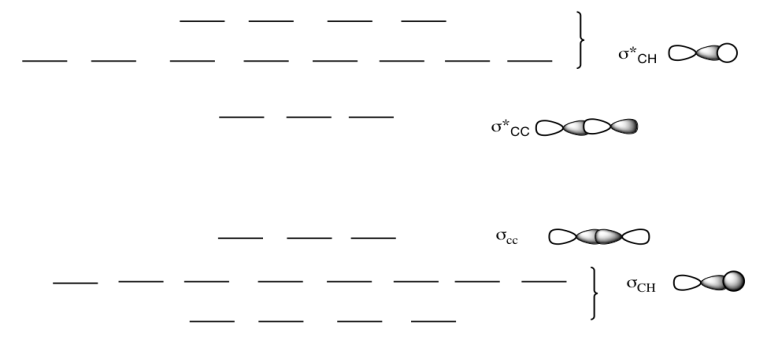
Respuesta c-

Ejercicio\(\PageIndex{2}\)
a) Este es el diagrama MO para el eteno.
Dibuja una estructura Lewis de eteno.
Rellene los electrones en el diagrama MO.
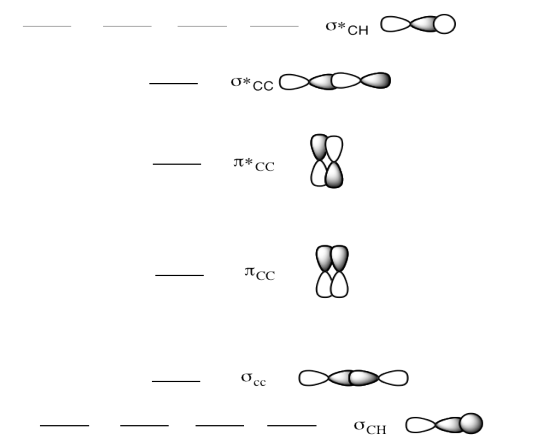
- Contestar a
-

b) Este es el diagrama MO para propeno.
Dibuja una estructura Lewis de propeno.
Rellene los electrones en el diagrama MO.
Agrega las caricaturas MO faltantes para los diferentes niveles.
Etiquetar el HOMO y LUMO.
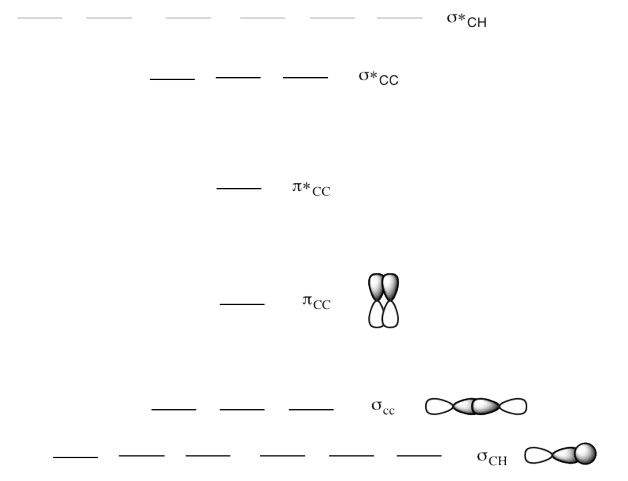
Respuesta b-

c) Este es el diagrama MO para 1-buteno.
Dibuja una estructura Lewis de 1-buteno.
Rellene los electrones en el diagrama MO.
¿Qué sucede con el diagrama MO a medida que aumenta la longitud de la cadena de alcanos?
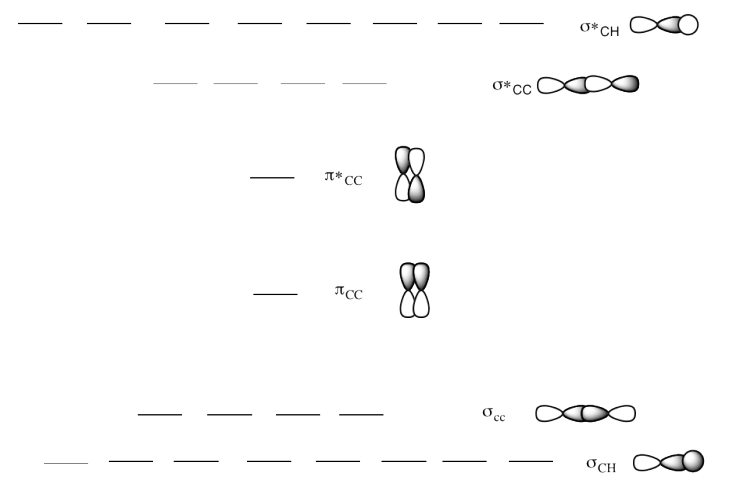
Respuesta c-

d) Este es el diagrama MO para 2-buteno.
Dibuja una estructura Lewis de 2-buteno.
Rellene los electrones en el diagrama MO.
¿La ubicación del enlace pi cambia el diagrama MO?
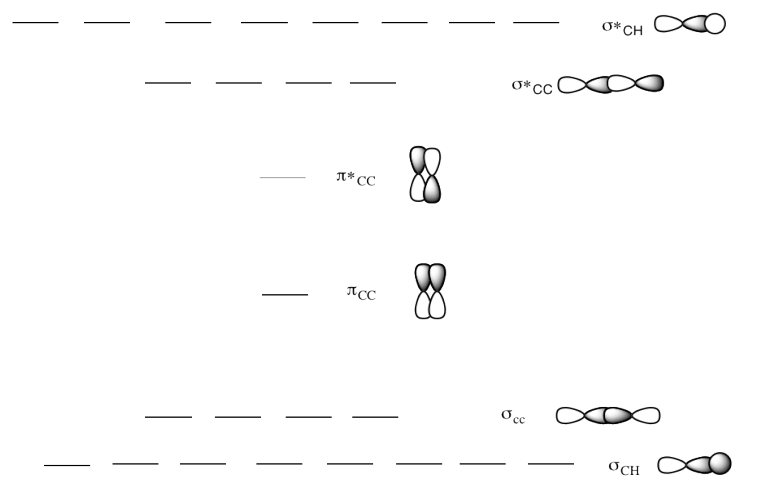
Respuesta d-

e) Este es el diagrama MO para 1-butino.
Dibuja una estructura Lewis de 1-butino.
Rellene los electrones en el diagrama MO.
¿Cómo cambia un alquino el diagrama MO?
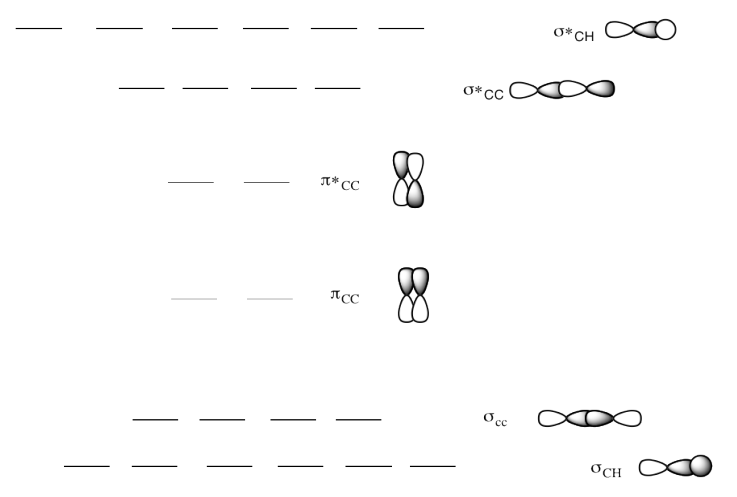
Respuesta e-

El metano es una molécula moderadamente pequeña. Su estructura Lewis es bastante fácil de dibujar, con un carbono en el medio unido a cuatro hidrógenos. Tratar de encontrar las interacciones de los orbitales de hidrógeno 1s con los orbitales sobre el carbono podría ser un desafío. Sin embargo, los cálculos orbitales moleculares generalmente comienzan con una buena conjetura sobre la geometría de la estructura.
En los cálculos cuantitativos, esa geometría inicial a menudo se modifica después de que se ha calculado la energía de la molécula. Se realiza una larga serie de cálculos iterativos, cambiando las longitudes de enlace o los ángulos de unión cada vez, hasta que se haya encontrado la geometría con la menor energía posible. Si esta geometría tiene la energía más baja, entonces es probablemente la forma que la molécula realmente adoptaría en la naturaleza. De hecho, se supone en la química cuántica que si se puede encontrar una estructura energética más baja, siempre es una imagen más precisa de la molécula real (asumiendo que no se han cometido errores en el cálculo).
Dado que el carbono en el metano tiene cuatro grupos unidos a él, podemos estar bastante seguros de que el carbono es tetraédrico.
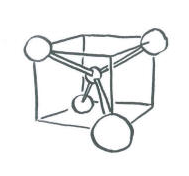
Supondremos que los cuatro hidrógenos están dispuestos en las esquinas de un tetraedro alrededor del carbono central. La superposición con la órbita de carbono 2s es fácil de ver, ya que la órbita s puede superponerse con vecinos en todas las direcciones. Por supuesto, podría haber una combinación en fase y una combinación fuera de fase.
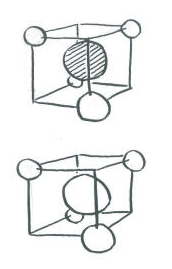
La parte complicada surge cuando queremos introducir los electrones de carbono y hacer que interactúen con los hidrógenos. No existe una orientación universal de p orbitales. ¿Qué camino deberían señalar?
En principio, no importa demasiado qué dirección escojamos para los orbitales p. Eventualmente deberíamos terminar con las mismas conclusiones al final. Sin embargo, las cosas pueden volverse extremadamente complicadas y es probable que ocurran errores si no elegimos una orientación que haga que las interacciones sean fáciles de ver. Como no importa a qué dirección apunten los orbitales p, debemos elegir una dirección que facilite el cálculo.
- En un tetraedro, las cuatro esquinas apuntan a esquinas alternas de un cubo.
- Los átomos de hidrógeno se encuentran en esquinas alternas de un cubo imaginario alrededor del átomo de carbono.
- La forma más sencilla de alinear los orbitales p es tenerlos apuntando a las caras del cubo.
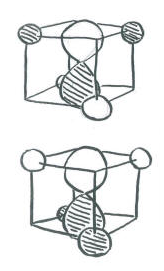
Orientar los orbitales p de esta manera simplifica mucho las cosas. Significa que cada lóbulo de cada orbital p está dirigido a un espacio (en la cara de un cubo) entre dos átomos de hidrógeno (en las esquinas opuestas de la cara). El otro lóbulo del mismo orbital p se dirige a un espacio (en la cara opuesta del cubo) entre los otros dos átomos de hidrógeno (en las esquinas opuestas de esa cara). Lo mismo es cierto para cada orbital p, pero apuntan a diferentes caras e interactúan con diferentes combinaciones de los mismos cuatro hidrógenos.
Como resultado de esta elección, en realidad solo hay algunas interacciones a considerar en el metano.
- El orbital de carbono 2s puede estar en fase o fuera de fase con todo el grupo de orbitales de hidrógeno. Eso hace dos combinaciones.
- Los orbitales de carbono 2p pueden estar en fase o fuera de fase con sus átomos de hidrógeno adyacentes. Con tres orbitales p, eso hace seis combinaciones más.
- Ocho orbitales atómicos se combinan para hacer ocho combinaciones orbitales moleculares.
Tenga en cuenta que aquí los átomos de hidrógeno a menudo se tratan como que están en fase entre sí, o al menos pares de ellos lo están. Esta suposición simplifica el cálculo y reduce el número de combinaciones no permitidas (es decir, combinaciones que producen el número total de orbitales sobre ocho).
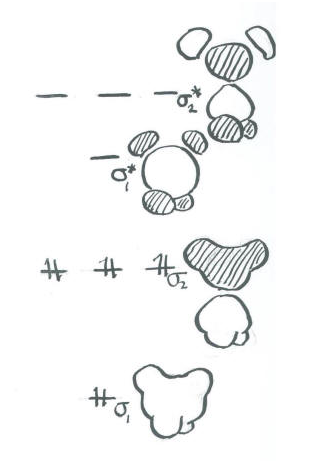
Organizar estas combinaciones en términos de energía:
- La combinación en fase de carbono 2s + H se une completamente. Es muy bajo en energía.
- La combinación desfasada de carbono 2s - H es completamente antiligante. Es muy alto en energía.
- Las combinaciones en fase de carbono 2p + H son principalmente de unión. Sin embargo, hay un nodo a través de la mitad de la molécula debido al nodo en el orbital p. Como resultado, los dos hidrógenos adyacentes a un lóbulo están desfasados con los dos hidrógenos en el otro. Esta combinación es media-baja en energía.
- Las combinaciones desfasadas de carbono 2p - H son altamente antiaglutinantes. Hay un nodo a través de la mitad de la molécula debido al nodo en el orbital p. También hay nodos entre los orbitales p y los orbitales de hidrógeno. Este orbital tiene la mayor cantidad de nodos a través de la estructura y por lo tanto corresponde a la longitud de onda más corta y la energía
En general, esta idea de que la geometría alrededor de un átomo determina qué orbitales atómicos se necesitan para formar enlaces directos (sigma) con sus vecinos está estrechamente ligada a la hibridación. Esa es la idea de que los orbitales s y p en el mismo caparazón necesitarán trabajar juntos para unirse a átomos vecinos. En las moléculas, a veces difuminamos la distinción entre las que se necesitan para formar este conjunto de enlaces, y en cambio nos referimos a ellas como “híbridos”. La hibridación está estrechamente ligada a la geometría del átomo central, tanto es así que los términos, geometría e hibridación, ocasionalmente se usan indistintamente.
- geometría lineal corresponde a hibridación sp
- Geometría plana trigonal correxponds a sp 2 hibridación
- Geometría tetraédrica corresponde a hibridación sp 3
Ejercicio\(\PageIndex{3}\)
Construir una imagen orbital molecular para anión borohidruro, BH 4 -.
a) Utilice la geometría para BH 4, que predeciría a partir de su estructura de Lewis.
b) Seleccionar una orientación para los orbitales p sobre boro.
c) ¿Qué interacción es posible entre el conjunto de hidrógenos y el orbital de boro 2s?
d) ¿Qué interacciones son posibles entre el conjunto de hidrógenos y un orbital de boro 2p?
e) ¿Qué interacciones son posibles entre el conjunto de hidrógenos y el segundo orbital de boro 2p?
f) ¿Qué interacciones son posibles entre el conjunto de hidrógenos y el tercer orbital de boro 2p?
g) ¿Pueden interactuar todos los orbitales de hidrógeno en cada caso? Si no, ¿por qué no?
h) Ordenar las combinaciones resultantes en energía, mostrar los niveles de energía resultantes y poblarlos con el número correcto de electrones.
- Contestar
-

Ejercicio\(\PageIndex{4}\)
Construir una imagen orbital molecular para borano, BH 3.
a) Utilice la geometría para BH 3 que predeciría a partir de su estructura de Lewis.
b) Seleccionar una orientación para los orbitales p sobre boro.
c) ¿Qué interacción es posible entre el conjunto de hidrógenos y el orbital de boro 2s?
d) ¿Qué interacciones son posibles entre el conjunto de hidrógenos y un orbital de boro 2p?
e) ¿Qué interacciones son posibles entre el conjunto de hidrógenos y el segundo orbital de boro 2p?
f) ¿Qué interacciones son posibles entre el conjunto de hidrógenos y el tercer orbital de boro 2p?
g) ¿Pueden interactuar todos los orbitales de hidrógeno en cada caso? Si no, ¿por qué no?
h) Ordenar las combinaciones resultantes en energía, mostrar los niveles de energía resultantes y poblarlos con el número correcto de electrones.
- Contestar
-

Ejercicio\(\PageIndex{5}\)
Con base en sus resultados de las dos preguntas anteriores sobre borano y borohidruro, comente sobre la energía involucrada en la adición de un ion hidruro (H -) al borano para producir borohidruro. Para esta pregunta, solo asumamos que los electrones de hidruro comienzan con una energía similar a los electrones 2p del boro.
Ejercicio\(\PageIndex{6}\)
Construir una imagen orbital molecular para carbeno, CH 2, de dos maneras diferentes.
a) En un enfoque, supongamos que el H-C-H forma un ángulo de 180 grados (geometría lineal). Sólo uno de los orbitales p yace a lo largo de esta línea.
b) En una segunda aproximación, supongamos que el H-C-H forma un ángulo de 120 grados (geometría angular). Estos tres átomos definen un plano. Dos de los orbitales p pueden estar en el plano de estos tres átomos.
c) Con base en sus diagramas de nivel de energía orbital molecular, ¿cuál de estas dos posibilidades cree que es más favorable?

