13.12: Aproximaciones en estructuras más complicadas
- Page ID
- 80500
Muy a menudo, en las discusiones cualitativas de la teoría orbital molecular, se hacen aproximaciones para simplificar enormemente la visión de la molécula. La información se pierde cada vez que aproximamos, por lo que esto no es tan bueno como un enfoque más cuidadoso. Sin embargo, hay casos en los que queremos enfocarnos en un aspecto de la molécula y no queremos que una imagen complicada distraiga de ese enfoque.
Por ejemplo, una aproximación común de la estructura del metano implica hacer dos realizaciones:
- Esta estructura requiere que el carbono forme enlaces con hidrógenos dispuestos en tres dimensiones a su alrededor. Un s orbital podría hacer esto fácilmente, porque es simétrico en todas las direcciones y puede superponerse con vecinos en cualquier dirección.
- Para unirse con hidrógenos en tres dimensiones, se requerirán los tres orbitales p, ya que juntos sus ejes definen el espacio tridimensional.
En un enfoque aproximado, no nos preocupamos por las interacciones específicas entre pares específicos de orbitales. Simplemente decimos que los orbitales de carbono 2s y 2p actuarán todos juntos para unirse con los cuatro hidrógenos vecinos.
-
- Esta estructura requiere que el carbono forme enlaces con hidrógenos dispuestos en tres dimensiones a su alrededor. Un s orbital podría hacer esto fácilmente, porque es simétrico en todas las direcciones y puede superponerse con vecinos en cualquier dirección.
- Para unirse con hidrógenos en tres dimensiones, se requerirán los tres orbitales p, ya que juntos sus ejes definen el espacio tridimensional.
- El resultado son cuatro orbitales de unión y cuatro orbitales antiadhesión.
- No nos preocupamos por las energías relativas de los cuatro orbitales vinculantes; asumimos que todas son similares.
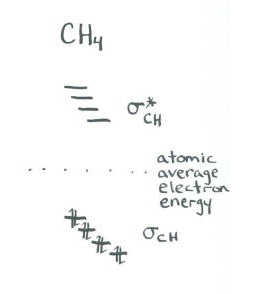
Este resultado no es consistente con la espectroscopía fotoelectrónica. Nuestro enfoque más riguroso del metano es más consistente con los datos experimentales. Sin embargo, este atajo, que a veces se conoce como un enfoque de “hibridación”, a menudo se usa para discutir moléculas más complicadas.
- Un átomo tetraédrico puede utilizar un orbital s y tres orbitales p para unirse con sus vecinos.
- Cuando se utiliza un modelo de hibridación, un átomo tetraédrico. A veces es referido por la etiqueta “sp 3 hybrid”.
Ejercicio\(\PageIndex{1}\)
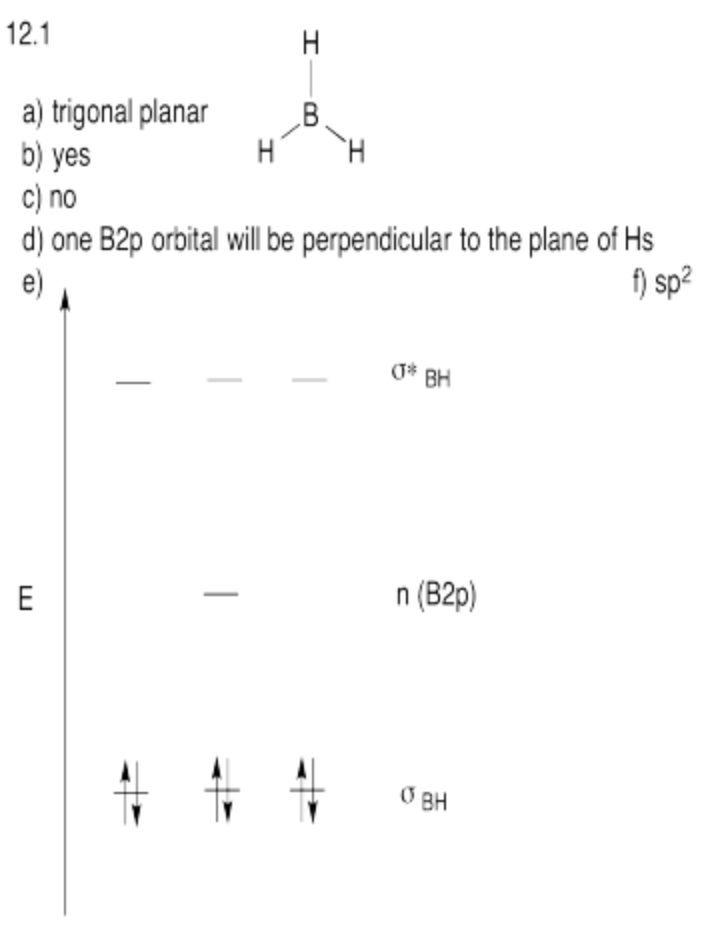
Supongamos que desea utilizar un enfoque de hibridación para mostrar un diagrama orbital molecular aproximado para borano, BH 3.
a) ¿Cuál es la geometría esperada al boro en el borano?
b) ¿Podría el enlace orbital s con los hidrógenos?
c) Dada la geometría del boro, ¿podrían unirse todos los orbitales p con los hidrógenos?
d) ¿Algún orbitales no está adecuadamente orientado para unirse con los hidrógenos? Si es así, estarían sin unión y no subirían ni bajarían de energía tras la formación de la molécula.
e) Mostrar el diagrama de nivel de energía orbital molecular resultante para borano.
f) Los átomos tetraédricos se denominan sp 3. ¿Qué etiqueta híbrida le darías a tu boro con esta geometría?
- Contestar
-
Ejercicio\(\PageIndex{2}\)
Supongamos que desea utilizar un enfoque de hibridación para mostrar un diagrama orbital molecular aproximado para hidruro de berilio, BeH 2.
a) ¿Cuál es la geometría esperada en berilio?
b) ¿Podría el enlace orbital s con los hidrógenos?
c) Dada la geometría del berilio, ¿podrían unirse todos los orbitales p con los hidrógenos?
d) ¿Algún orbitales no está adecuadamente orientado para unirse con los hidrógenos? Si es así, estarían sin unión y no subirían ni bajarían de energía tras la formación de la molécula.
e) Mostrar el diagrama de nivel de energía orbital molecular resultante para hidruro de berilio.
f) Los átomos tetraédricos se denominan sp 3. ¿Qué etiqueta híbrida le darías a tu berilio con esta geometría?
- Contestar
-

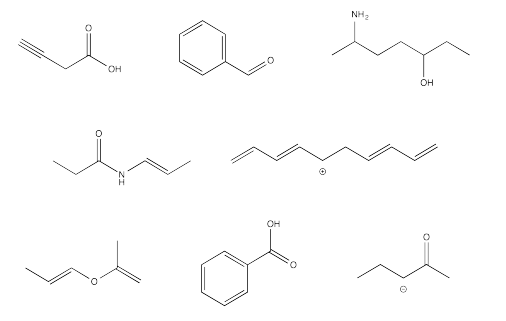
Ejercicio\(\PageIndex{3}\)
Indicar hibridación de cada átomo de carbono en las siguientes moléculas.
Contestar-


