13.13: Construyendo una Molécula a partir de Piezas
- Page ID
- 80501
En ocasiones, los compuestos son lo suficientemente complicados como para que sea más fácil pensar en la unión en una porción de la molécula a la vez. El etano, por ejemplo, no contiene un átomo central como lo hace el metano. Contiene dos átomos que pensaríamos que son tetraédricos. Eso hace que las posibles interacciones orbitales sean un poco más difíciles de pensar.
Eso no quiere decir que este cálculo plantee ningún problema para un químico computacional. Un enfoque orbital molecular cuantitativo en una computadora comenzaría con una hoja de cálculo de datos para presentar para los cálculos. Estos datos incluirían una lista de todos los átomos en la estructura y la posición aproximada de cada átomo en el espacio tridimensional. Estas posiciones podrían pensarse en coordenadas cartesianas (x, y, z), coordenadas polares (r, q, f) o coordenadas internas (un sistema ligeramente complicado que relaciona las posiciones relativas de los átomos entre sí: el átomo B es x distancia del átomo A; el átomo C es y distancia del átomo B y A-B-C forma un ángulo de z grados, y así sucesivamente). La computadora no necesita saber dónde están los enlaces o dónde están los electrones; lo resolverá a partir de sus cálculos. El etano resultaría muy sencillo de calcular con una computadora.
En el papel, tal vez necesitemos descomponer el etano en pedazos más fáciles. Lo obvio que hay que hacer es romper el etano en dos partes más pequeñas y luego juntar esas partes. El etano podría pensarse fácilmente como dos unidades CH 3 interactuando entre sí.
La geometría de una unidad CH 3 puede ser discutible. Como esperamos que el carbono sea tetraédrico en etano, probablemente sea más fácil pensar en CH 3 como piramidal, en términos de la relación de los cuatro átomos. Los tres hidrógenos forman un triángulo en la base de la pirámide, con el carbono en el ápice de la pirámide.
Ahora tenemos dos grupos metilo. Podemos unirlos a ambos y permitir que los orbitales previamente no vinculantes interactúen entre sí.
- Si tomamos un enfoque híbrido para el grupo metilo, podemos usar el orbital 2s y los tres orbitales 2p para unirnos con los hidrógenos.
- Solo hay tres hidrógenos, por lo que solo necesitamos tres del conjunto orbital sp3 para unirse con los hidrógenos.
- Habrá tres combinaciones de unión usando estos orbitales y tres combinaciones antiadhesión.
- Estas interacciones describen los enlaces C-H.
- El último del conjunto sp 3 quedará sin unión. No nos importa qué orbital sea esto porque estamos tomando un atajo.
- El orbital restante del conjunto sp 3 en un metilo interactúa con el orbital restante del conjunto sp 3 en el otro metilo.
- Hay una combinación de unión y antiadhesión.
- Esta interacción describe el enlace C-C.
- El enlace C-C probablemente no esté al mismo nivel de energía que los enlaces C-H.
- Sabemos por experimento que los enlaces C-C son más débiles que los enlaces C-H, por lo que los colocaremos más altos en energía que los enlaces C-H.
Este enfoque no concuerda bien con los niveles exactos de energía de los enlaces C-H determinados tanto por la teoría orbital molecular cuantitativa como por la espectroscopia fotoelectrónica. No obstante, es un método que nos permitirá abordar problemas mayores sin preocuparnos por algunos de los detalles.
Ejercicio\(\PageIndex{1}\)
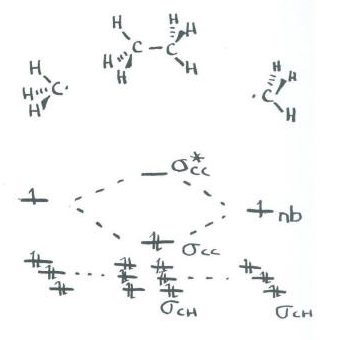
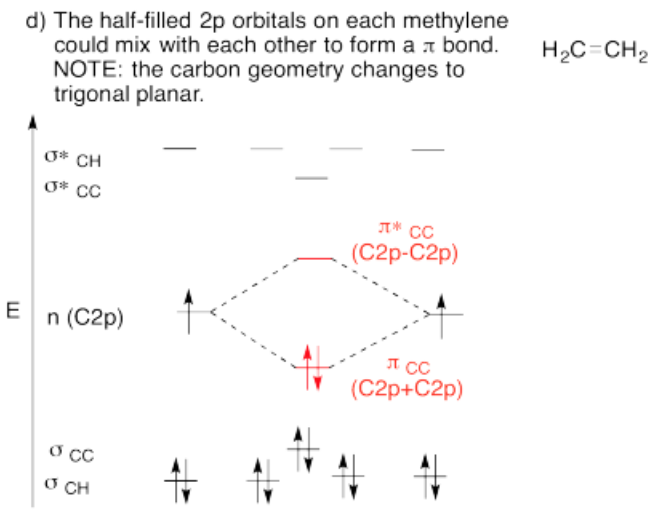
Utilizar el enfoque de estructura parcial, con un modelo de hibridación, para construir un diagrama de interacción orbital molecular aproximado de eteno, conectado CH 2-CH 2 (dos H en el primer carbono, dos H en el segundo, los dos carbonos conectados entre sí).
- Construye este modelo a partir de dos grupos metileno, CH 2 y CH 2. ¿Cuál será la geometría de cada carbono en etileno?
- Dada esa geometría, elija el conjunto apropiado de orbitales s & p de carbono para unirse a los vecinos. Construir el diagrama de nivel de energía orbital molecular de metileno.
- Reúne los dos metilenos. Deje que un orbital no utilizado de su conjunto híbrido interactúe con el mismo tipo de orbital del otro metileno.
- Al terminar, ¿hay otros orbitales atómicos no utilizados en cada metileno? Si es así, ¿podrían formar un bono adicional?
- Contestar a
-

- Respuesta b
-
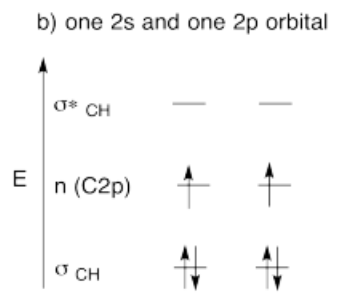
- Respuesta c
-
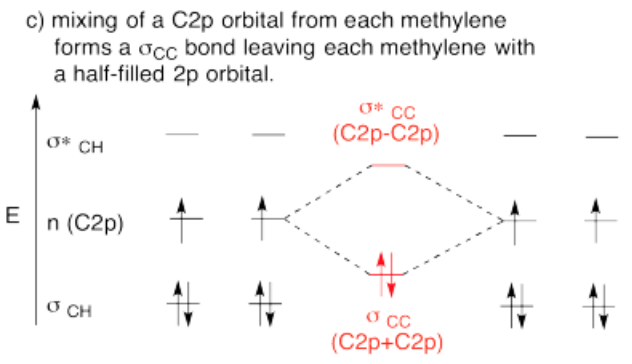
- Respuesta d
-
Ejercicio\(\PageIndex{2}\)
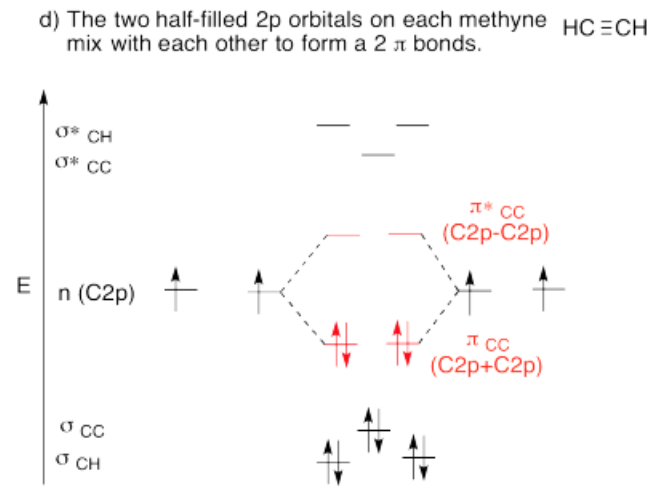
Utilizar el enfoque de estructura parcial, con un modelo de hibridación, para construir un diagrama de interacción orbital molecular aproximado de etino, CH-CH conectado (una H en el primer carbono, una H en el segundo, los dos carbonos conectados entre sí).
- Construye este modelo a partir de dos grupos de metino, CH y CH. ¿Cuál será la geometría de cada carbono en etino?
- Dada esa geometría, elija el conjunto apropiado de orbitales s & p de carbono para unirse a los vecinos. Construir el diagrama de nivel de energía orbital molecular de metino.
- Reúne las dos metinas. Deje que un orbital sin usar de su conjunto híbrido interactúe con el mismo tipo de orbital del otro metino.
- Al terminar, ¿hay otros orbitales atómicos no utilizados de cada metino? Si es así, ¿podrían formar un bono adicional?
- Contestar a
-

- Respuesta b
-
- Respuesta c
-
- Respuesta d
-
Ejercicio\(\PageIndex{3}\)
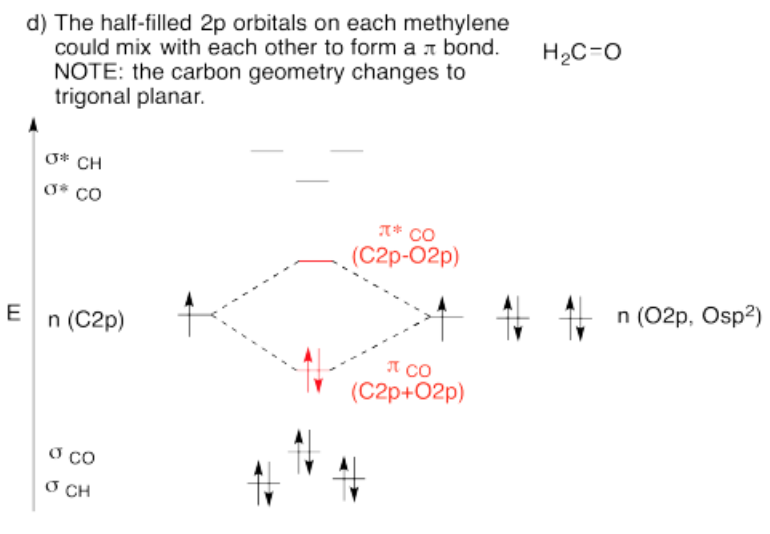
Utilizar el enfoque de estructura parcial, con un modelo de hibridación, para construir un diagrama de interacción orbital molecular aproximado de formaldehído, conectado CH 2-O (dos H en el carbono, carbono conectado al oxígeno).
- Construye este modelo a partir de un grupo metileno, CH 2. ¿Cuál será la geometría de cada carbono en etileno? ¿Qué conjunto de orbitales s & p de carbono se unirá a los vecinos? Construir el diagrama de nivel de energía orbital molecular de metileno.
- Trae el metileno con un oxígeno. Deja que un orbital sin usar de tu conjunto híbrido en metileno interactúe con cualquier orbital que creas que se superpondrá con él en el oxígeno
- Al terminar, ¿hay otros orbitales atómicos no utilizados en el metileno? Si es así, ¿podrían formar un enlace adicional con algún orbital atómico sobre el oxígeno?
- Contestar a
-
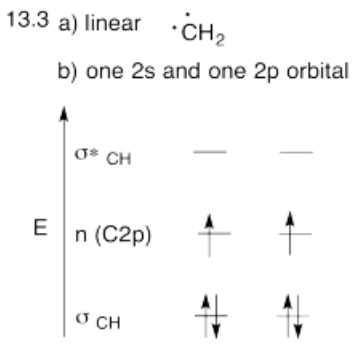
- Respuesta b
-
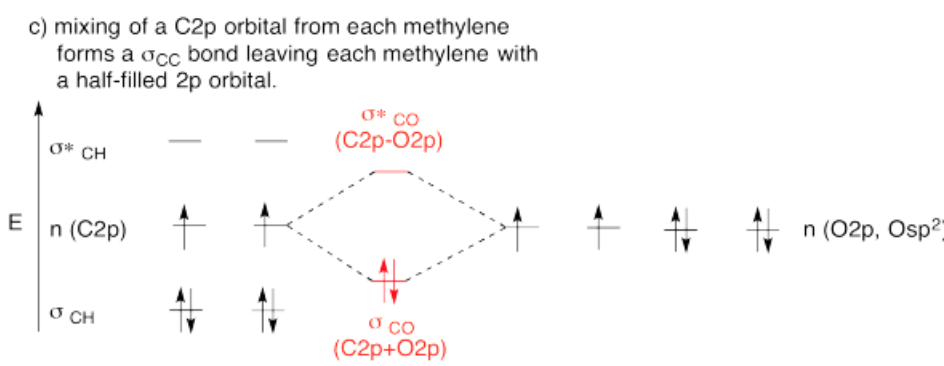
- Respuesta c
-