13.14: Deslocalización
- Page ID
- 80454
El ozono es una molécula bastante simple, con sólo tres átomos. Sin embargo, para enfocarnos en un aspecto de la estructura del ozono, utilizaremos una aproximación híbrida para simplificar la imagen.
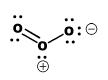
La estructura Lewis del ozono es algo insatisfactoria. Eso se debe a que la verdadera estructura del ozono no se puede dibujar fácilmente usando las convenciones de Lewis. El ozono es una estructura angular en la que ambos enlaces oxígeno-oxígeno tienen aproximadamente 1.278 Angstroms de largo.
Sin embargo, la estructura Lewis del ozono no refleja esa realidad. En la estructura de Lewis, un par de oxígenos es de doble enlace y el otro es de enlace simple. Si esto fuera cierto, habría dos longitudes de enlace diferentes en el ozono. Un enlace tendría aproximadamente 1.49 Angstroms de largo, como el enlace O-O en peróxido. El otro enlace tendría aproximadamente 1.208 Angstroms de largo, como el enlace O=O en dioxígeno. El enlace en el ozono se ve bastante cerca de un doble enlace, ¿no es así? Es sólo un poco más largo, sin embargo.
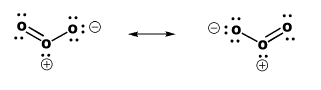
En las estructuras de Lewis, arreglamos esta discrepancia dibujando dos estructuras de resonancia para el ozono. En una estructura, el doble enlace se encuentra entre un par de oxígenos. En la otra estructura, el doble enlace se encuentra entre el otro par. Las estructuras de resonancia implican que la estructura real se encuentra en algún lugar entre las dos que se muestran. En términos generales, debería haber enlaces de uno y medio entre los oxígenos vecinos. Sin embargo, las estructuras de Lewis tienen problemas para ilustrar la naturaleza del doble enlace en el ozono, que parece estar ahí y no al mismo tiempo.
Ejercicio\(\PageIndex{1}\)
El catión alílico, CH 2 =CHCH 2 +, es otro sistema conjugado. Utilizar estructuras de resonancia para mostrar cómo se deslocaliza su doble enlace.
- Contestar
-
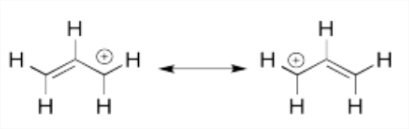
Estas dos estructuras de resonancia siguen las reglas de Lewis, pero ambas son necesarias para ilustrar los electrones deslocalizados
Ejercicio\(\PageIndex{2}\)
Usar estructuras de resonancia para mostrar que la carga negativa en un ion formiato (HCO 2 -, C está en el medio y unida a los otros tres átomos) se extiende (deslocaliza) sobre más de un átomo de oxígeno.
- Contestar
-
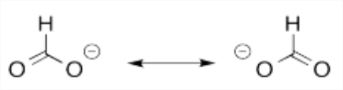
Estas dos estructuras de resonancia siguen las reglas de Lewis, pero ambas son necesarias para ilustrar los electrones deslocalizados
Podríamos tener otra mirada a la unión en el ozono usando un enfoque orbital molecular. Básicamente nos ocupa una pregunta: ¿cuál es la naturaleza del doble vínculo?
Ya sabemos de los dobles enlaces. Los hemos visto en compuestos como el nitrógeno. Un segundo enlace generalmente se realiza a través de una interacción de unión pi. Por lo tanto, sólo nos vamos a preocupar por los orbitales que formarán enlaces pi.
Tenemos tres orbitales para combinar. Por lo tanto, habrá tres combinaciones.
- El ozono está hecho de tres átomos en ángulo entre sí. Son, por definición, un plano.
- Un sistema plano puede ser descrito en un modelo de hibridación simple usando el orbital s y dos orbitales p en cada oxígeno.
- Supondremos que alguna combinación de estos orbitales interactúan dentro del plano para formar los primeros enlaces entre los oxígenos. No nos preocuparemos por los detalles.
- Cada oxígeno en ozono tiene un orbital p que quedó fuera de este conjunto sp 2.
- Estos orbitales p sobrantes podrían interactuar entre sí para formar un enlace pi.
Tenemos tres orbitales para combinar. Por lo tanto, habrá tres combinaciones.
- En una combinación, los tres orbitales están en fase. Esta combinación tendrá un nodo a través del plano de la molécula (porque son p orbitales) pero ninguno cortando la molécula transversalmente. Esta es una combinación de baja energía y alta unión.
- En otra combinación, los tres orbitales están desfasados. Esta fase tendrá un nodo a través del plano de la molécula (porque son p orbitales) y dos nodos más cortando a través de la molécula transversalmente. Esta es una combinación de alta energía y altamente antiadhesión.
- En una tercera combinación, el orbital p medio puede considerarse desfasado con un vecino pero en fase con el otro. Esta fase tendrá un nodo a través del plano de la molécula (porque son p orbitales) y uno más nodos cortando a través de la molécula transversalmente. Debido a que las interacciones de unión y antiunión dentro de este orbital se cancelan, esta es una combinación no enlazante.
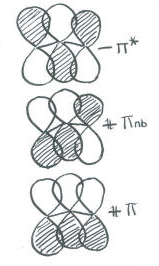
- Más correctamente, esta combinación generalmente se dibuja como un orbital p en cada extremo de la molécula, fuera de fase entre sí. El orbital p medio bien podría sentarse porque en general no está haciendo nada. Este estilo de representación tiene un nodo que corta la molécula transversalmente, y es energéticamente equivalente a la otra forma en que la dibujamos. No obstante, la primera forma en que la dibujamos es descalificada por las reglas de simetría (está demasiado desequilibrada).
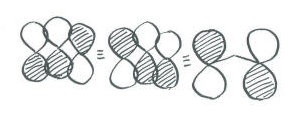
Poblar estos orbitales, y obtener una energía exacta, no es posible dadas las enormes aproximaciones que hemos hecho. No obstante, al enfocarnos en la vinculación pi, vemos algo que no podemos ver en términos de Lewis. Realmente hay un enlace pi que se extiende por toda la longitud de la molécula de ozono. Esta es la combinación de energía más baja, con una longitud de onda de esteretching más del doble de la longitud de la molécula.
- La unión de Pi en el ozono se deslocaliza sobre los tres oxígenos.
- La deslocalización es altamente estabilizante.
- La deslocalización permite que los electrones logren una longitud de onda más larga y menor energía
Debido a que es baja en energía, es bastante seguro que el enlace pi extendido estará poblado por electrones, y hará alguna contribución a la estructura del ozono. El impacto que tenga dependerá de la población de las otras combinaciones, que no podemos predecir sin un enfoque más cuidadoso.
Ejercicio\(\PageIndex{3}\)
Hay deslocalización en las siguientes especies.
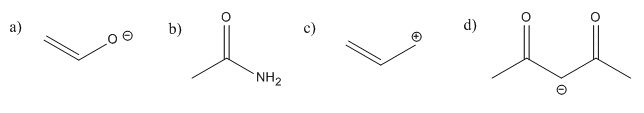
En cada caso:
- añadir los pares solitarios faltantes.
- muestran deslocalización usando estructuras de resonancia.
- mostrar deslocalización utilizando dibujos de los orbitales utilizados en la unión pi.
- Contestar a
-
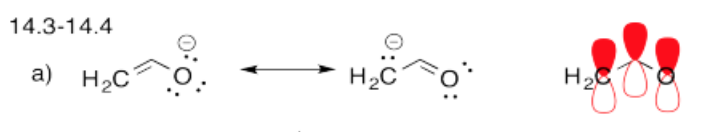
- Respuesta b
-
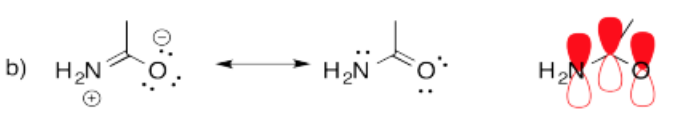
- Respuesta c
-
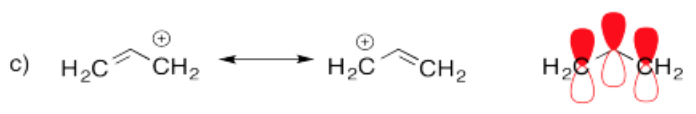
- Respuesta d
-
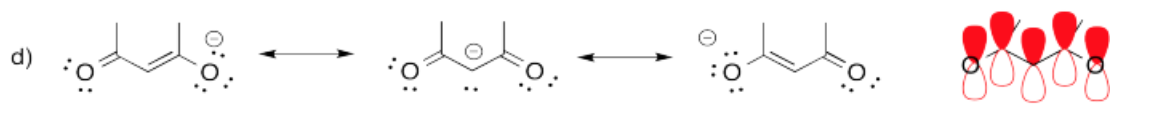
Ejercicio\(\PageIndex{4}\)
Construir un diagrama MO de Huckel para cada uno de los casos en Problema MO14.3.
- Contestar a
-
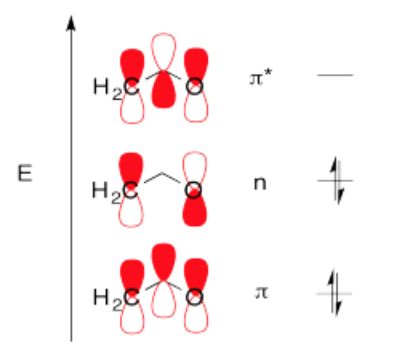
- Respuesta b
-
- Respuesta c
-
- Respuesta d
-
Ejercicio\(\PageIndex{5}\)
En cada uno de los siguientes casos, puede o no haber conjugación que involucre pares solitarios y enlaces pi. Mostrar por qué o por qué no, utilizando dibujos de los orbitales involucrados.
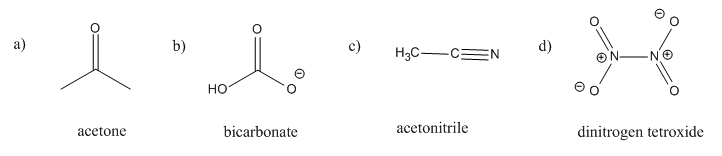
- Contestar a
-

- Respuesta b
-

- Respuesta c
-

- Respuesta d
-

Ejercicio\(\PageIndex{6}\)
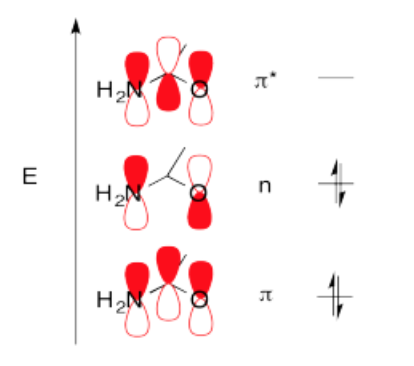
La molécula acetamida se muestra en el problema MO14.1. Explique las siguientes características estructurales.
a. En acetamida, las longitudes de los enlaces C-N y C-O son 1.334 y 1.260 angstroms, respectivamente. Para comparación, algunas longitudes de enlace típicas son C-N (1.47 A); C=N (1.38 A); C-O (1.43 A), C=O (1.20 A).
b. Los dos átomos de C, más el O, el N y los dos hidrógenos en el N se encuentran en un plano.
c. La barrera a la rotación alrededor del enlace C-N es de aproximadamente 11 kcal/mol, mientras que la barrera a la rotación alrededor del enlace C-N en CH3NH2 es de aproximadamente 2.4 kcal/mol.
d. Los dos hidrógenos en el N no se encuentran en ambientes químicos idénticos.
- Contestar
-
Todas las respuestas dependen de una comprensión de las contribuciones de dos estructuras de resonancia al panorama general de la acetamina, o alternativamente, que la actetamida forma un sistema pi conjugado con cuatro electrones deslocalizados sobre el O, C y N.

- Contestar a
-
La contribución de la segunda estructura de resonancia introduce algún carácter de doble enlace al enlace C-N y algo de carácter de enlace simple al enlace C-O. Así, ambos enlaces son de longitud intermedia entre enlaces simples y dobles.
- Respuesta b
-
Dado que los átomos C, N y O están hibridados sp2, el enlace pi C-N solo puede formarse si los orbitales p restantes en estos átomos se alinean. Esto coloca a los átomos que participan en los enlaces sigma sp2 en el mismo plano.
- Respuesta c
-
Debido al carácter de doble enlace parcial, existe una barrera de rotación mayor que la que se encuentra típicamente en moléculas con solo enlaces simples.
- Respuesta d
-
Debido al carácter de doble enlace parcial y la rotación restringida, las dos H no son idénticas. (Uno está más cerca del O y uno está más cerca del CH 3 y la rotación restringida impide su interconversión.

