14.3: Ácidos de Lewis
- Page ID
- 80594
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
El borano es inusual porque es un compuesto sin octeto. El átomo central de boro tiene sólo seis electrones de valencia. Se necesita un par más de electrones para obtener un octeto. El boro es un ácido de Lewis.

Figura\(\PageIndex{1}\): El borano es un ácido de Lewis. Puede aceptar electrones de un átomo donante. El cuadrado dibujado al lado del boro se utiliza para reforzar la idea de que allí hay un sitio vacante para electrones.
- Los ácidos de Lewis suelen estar cortos de un octeto completo.
En el grupo principal de la tabla periódica, los átomos de la columna del Grupo IIIA (incluyendo el boro y el aluminio) tienen tres electrones de valencia para compartir con el fin de hacer enlaces. Compartir estos electrones con tres electrones de vecinos haría tres enlaces, y proporcionaría seis electrones, no ocho, en el caparazón de valencia. Otro par de electrones debe ser aceptado de un donante para lograr un octeto.

- Los compuestos de boro, aluminio e indio suelen ser ácidos de Lewis.
La regla de ocho electrones no se mantiene en toda la tabla periódica. Para obtener configuraciones de gas noble, algunos átomos pueden necesitar dieciocho electrones en su caparazón de valencia. Por ejemplo, los metales de transición como el titanio suelen seguir una regla de dieciocho electrones. El titanio tiene cuatro electrones de valencia y puede formar cuatro enlaces en compuestos como tetraquis (isopropóxido) de titanio, a continuación, o tetracloruro de titanio, TiCl 4. Sin embargo, el átomo de titanio en ese compuesto tiene sólo ocho electrones de valencia, no dieciocho. Puede aceptar fácilmente electrones de donantes.

- Los metales de transición como el titanio, el hierro y el níquel pueden tener hasta dieciocho electrones y frecuentemente pueden aceptar pares de electrones de bases de Lewis. Los metales de transición suelen ser ácidos de Lewis.
- ¡Los lantánidos como el cerio y el samario podrían tener hasta treinta y dos electrones en sus conchas de valencia! Nunca lo hacen. Sin embargo, suelen ser ácidos de Lewis fuertes.
Los iones positivos suelen ser ácidos de Lewis porque tienen una atracción electrostática para los donantes de electrones. Los ejemplos incluyen metales alcalinos y alcalinotérreos en las columnas del grupo IA y IIA. K +, Mg 2 + y Ca 2 + a veces se ven como sitios ácidos de Lewis en biología, por ejemplo. Estos iones son formas muy estables de estos elementos debido a sus bajos potenciales de ionización de electrones. Sin embargo, sus cargas positivas atraen a donantes de electrones.

De manera similar, los metales de transición “tempranos” —aquellos que están cerca del lado izquierdo de la tabla periódica, especialmente en los grupos IIIB, IVB y VB— tienen bajos potenciales de ionización y tienen altas cargas positivas o estados de oxidación. Por ejemplo, Sc 3 +, Zr 4 + y V 5+ son formas comunes de algunos metales de transición tempranos, y son ácidos de Lewis fuertes.
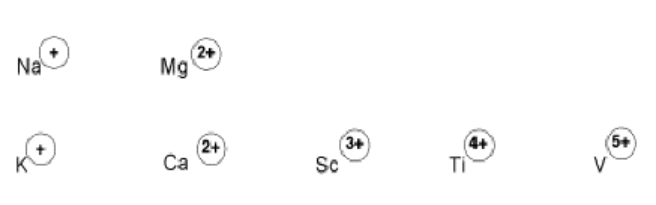
- Muchos cationes como Ca 2 + o Sc 3 + son buenos ácidos de Lewis. Sus cargas positivas atraen electrones.
El sodio, el potasio, el calcio y el magnesio son iones comunes en biología. El sodio, el potasio y el calcio tienen papeles bien conocidos en la señalización celular. La acumulación de estos iones en un lado u otro de una membrana celular da como resultado una separación de carga a través de la membrana, llamada potencial de membrana. Sin embargo, la acidez de Lewis de estos iones también es importante en biología. Debido a que atraen a los donantes de electrones, estos iones se encuentran generalmente en situaciones biológicas con moléculas de agua pegadas a ellos; recuerde que el átomo de oxígeno en el agua es básico de Lewis. Eso significa que las proteínas que forman canales iónicos en las membranas celulares deben de alguna manera hacer frente a las moléculas de agua que están alrededor cuando transportan iones de potasio o iones de sodio a través de las membranas. Un ion potasio cubierto en moléculas de agua es un objeto mucho más grande que un ion potasio por sí mismo. El poro que se abre entre las proteínas debe ser lo suficientemente grande como para permitir el paso de todo el complejo agua-potasio, o bien debe haber una manera de separar las moléculas de agua del ion potasio. Al mismo tiempo, el canal iónico puede explotar la acidez de Lewis del ión potasio; por ejemplo, las proteínas del canal pueden contener átomos de oxígeno situados de tal manera que dibujan el ion hacia el canal. Exactamente cómo funcionan los canales iónicos es un tema muy activo de la investigación actual en la interfaz de la química y la biología.
Existen otras situaciones biológicas en las que juega un papel la acidez de Lewis de estos iones. Por ejemplo, los iones potasio se unen a ácidos nucleicos en el ADN para formar los telómeros en los extremos de los cromosomas. Esta unión implica la donación de pares solitarios en los ácidos nucleicos (guanidinas en este caso) a un ion potasio. Otra estructura biológica común en la que los átomos donantes se unen a un ácido de Lewis es la clorofila, en la que un anillo de porfirina se une a un ion magnesio central. La clorofila está involucrada en la absorción de la luz solar y la iniciación del transporte de electrones al fotosistema I y II, que son los motores de la fotosíntesis. Uno de los papeles del ion magnesio en esta estructura es afectar el color de la clorofila y de ahí las longitudes de onda de la luz absorbida; cuando otros iones metálicos son unidos por la porfirina, se absorben diferentes colores.

Varias moléculas biológicas que contienen iones metálicos realizan tareas que requieren acidez de Lewis. Muchas enzimas que contienen iones metálicos, a veces llamadas metaloproteínas, se unen a un sustrato y llevan a cabo una transformación sobre él. El sustrato suele ser capaz de donar un par de electrones al ion metálico y adherirse a él mientras se produce una reacción. Por ejemplo, la bromoperoxidasa de vanadio es una proteína que se encuentra en algunos tipos de algas marinas. Puede unir moléculas de oxígeno disuelto así como iones bromuro del agua salada circundante. Una serie posterior de reacciones permite incorporar el átomo de bromo en grandes moléculas orgánicas. Los halógenos en las moléculas orgánicas son extremadamente raros en la naturaleza, pero quizás no sea sorprendente que los organismos rodeados de agua salada hayan logrado hacerlos. Los compuestos bromados resultantes parecen ser utilizados como defensas químicas, lo que hace que las algas sean menos propensas a comerse.
Varios otros iones metálicos son comunes en biología. El manganeso es prominente en el fotosistema I y II, el hierro se encuentra en la hemoglobina y el cobalto en la vitamina B12. La hemoglobina puede ser familiar por su papel en el transporte de oxígeno en la sangre.

Los átomos en la parte inferior de la tabla periódica suelen tener estados de oxidación variables. Pueden formar diferentes números de bonos. Aunque el carbono generalmente forma cuatro enlaces, formando compuestos como el tetracloruro de carbono, CCl 4, el estaño a veces puede formar dos enlaces así como cuatro. El estaño forma cloruro estañoso, SnCl 2, así como cloruro estánnico, SnCl 4. Es posible que el cloruro estañoso, con dieciséis electrones de valencia, pudiera aceptar otro par de electrones.
Puede ser sorprendente que el cloruro estánnico sea también un ácido de Lewis. El átomo de estaño en el cloruro estánnico tiene un octeto completo (dieciocho electrones de valencia), pero aún atrae a donantes de electrones. Dada la diferencia de electronegatividad entre el estaño y el cloro, sin embargo, parece razonable pensar en estos compuestos en términos de enlaces muy polares.

- Los átomos con un octeto aún pueden ser ácidos de Lewis si llevan una gran carga positiva parcial.
Los átomos de carbono pueden ser ácidos de Lewis aunque el carbono generalmente no forma enlaces iónicos. Por ejemplo, el cloruro de formilo, H- (C=O) -Cl, contiene un átomo de carbono que está unido a un cloro y también con doble enlace a un átomo de oxígeno. Aunque estos enlaces son ciertamente covalentes, la polaridad de los enlaces coloca una gran carga positiva parcial sobre el carbono. El cloruro de formilo atrae fácilmente un par de electrones de una base de Lewis.
Ejercicio\(\PageIndex{1}\)
¿Qué característica estructural se requiere para ser un ácido de Lewis?
- Contestar
-

Ejercicio\(\PageIndex{2}\)
¿Cuáles de los siguientes compuestos parecen ser ácidos de Lewis? Explica tu razonamiento en cada caso.
a) CeCl 3 b) BF 3 c) CH 4 d) CH 2 O e) N 2
- Contestar
-



Ejercicio\(\PageIndex{3}\)
El grupo de investigación Smith de la Universidad de Notre Dame ha estado trabajando con moléculas que pueden ser utilizadas para imágenes, detección y aplicaciones relacionadas con el cuidado de la salud.

- Encierra en círculo el anillo que contiene varios oxígenos.
- La parte de la molécula que has rodeado se uniría (elige una):
aniones cationes
c) Explicar cómo se unirían estos iones.
d) Poner una caja alrededor de la porción de la molécula capaz de actuar como donador de enlaces de hidrógeno.
e) La parte de la molécula que has marcado en un círculo se uniría (elige una):
aniones cationes
f) El laboratorio Smith ha demostrado que estas moléculas se unen a iones cloruro. Dibujar un ion cloruro en la posición correcta en la molécula.
g) En presencia de iones potasio, la molécula puede unirse tanto al potasio como al cloruro. Añadir ambos iones en las posiciones correctas en la molécula.
La medición del equilibrio de iones cloruro unidos vs. no unidos mostró que la unión a cloruro fue más fuerte cuando también se unieron iones potasio.
h) Explicar por qué la unión de cloruro es más fuerte cuando un ion potasio también se une a la molécula sensora.
- Contestar
-
a)
b) cationes
c) posiblemente fuerzas ión-dipolo; alternativamente, los átomos de oxígeno podrían actuar como bases de Lewis, donando pares solitarios a un catión.
d)
e) aniones
f)
g)
h) Cuando el ion cloruro se une a la molécula sensora, le da al complejo global una carga negativa y la adición del ion potasio cancela esta carga

