14.4: Complejos ácido-Base de Lewis y Orbitales Moleculares
- Page ID
- 80582
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Qué sucede cuando una base de Lewis dona un par de electrones a un ácido de Lewis? El formulismo de flecha que hemos estado usando para ilustrar el comportamiento de los ácidos de Lewis y las bases de Lewis pretende mostrar la dirección del movimiento de electrones desde el donante hasta el aceptor. Sin embargo, dado que un enlace puede pensarse como un par de electrones que se comparten entre dos átomos (en este caso, entre el donante y el aceptor), estas flechas también muestran dónde se están formando los enlaces.

Los electrones donados de una base de Lewis a un ácido de Lewis forman un nuevo enlace. Un nuevo compuesto más grande se forma a partir del ácido de Lewis y la base de Lewis más pequeños. Este compuesto se llama complejo ácido-base de Lewis.
Un ejemplo sencillo de complejación ácido-base de Lewis implica amoníaco y trifluoruro de boro. El átomo de nitrógeno tiene un par solitario y es un donador de electrones. El boro no tiene octeto y es un aceptor de electrones. Los dos compuestos pueden formar un complejo ácido-base de Lewis o un complejo de coordinación juntos.
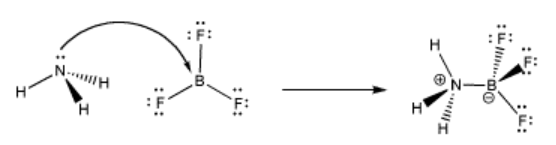
Cuando el nitrógeno dona un par de electrones para compartir con el boro, el enlace que se forma a veces se denomina enlace coordinado. Otro término para este tipo de vínculo es un vínculo dativo. Un enlace coordinado o dativo es cualquier enlace covalente que surgió porque un átomo trajo un par de sus electrones y los donó con otro.
Hay otra pieza de terminología a la que deberías acostumbrarte aquí. A veces, el donador de electrones se llama nucleófilo y el aceptor de electrones se llama electrófilo. El amoníaco es un nucleófilo y el trifluoruro de boro es un electrófilo.
- Debido a que las bases de Lewis son atraídas por átomos deficientes en electrones, y debido a que la carga positiva generalmente se asocia con el núcleo de un átomo, las bases de Lewis a veces se denominan “nucleófilos”. Nucleófilo significa amante de los núcleos.
- Debido a que los ácidos de Lewis atraen pares de electrones, los ácidos de Lewis a veces se llaman “electrófilos”. Electrophile meanse amante de los electrones.
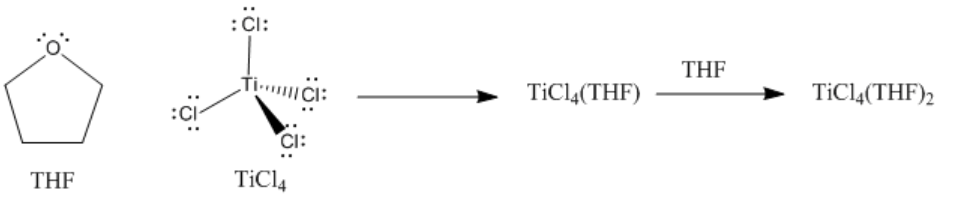
Los complejos ácido-base de Lewis frecuentemente tienen propiedades muy diferentes de los compuestos separados a partir de los cuales se formaron. Por ejemplo, el tetracloruro de titanio es un líquido amarillo a temperatura ambiente. Es tan ácido Lewis que reacciona con la humedad del aire, sometiéndose a una reacción que genera gas HCl en forma de humo blanco. El tetrahidrofurano (o THF), una base de Lewis suave, es un líquido incoloro. Cuando se combinan THF y TiCl 4, se forma un complejo ácido-base de Lewis, TiCl 4 (THF) 2. TiCl 4 (THF) 2 es un sólido amarillo a temperatura ambiente. Aunque todavía reacciona con el aire, lo hace muy lentamente, y no muestra ningún cambio visible cuando se expone al aire durante varios minutos.
Ejercicio\(\PageIndex{1}\)
Utilice la notación de flecha curva para mostrar el movimiento de electrones para las siguientes reacciones.

- Contestar
-

Ejercicio\(\PageIndex{2}\)
Mostrar, usando notación de flecha, la reacción en dos etapas entre THF y tetracloruro de titanio para formar el complejo ácido-base de Lewis, TiCl 4 (THF) 2. También se muestran las estructuras de los complejos intermedios y finales.
- Contestar
-

Ejercicio\(\PageIndex{3}\)
Se forma un complejo ácido-base similar de Lewis entre THF y borano, BH 3.
a) ¿Qué compuesto es el ácido de Lewis? ¿Cuál es la base de Lewis?
b) ¿Qué átomo en el ácido de Lewis es el sitio ácido? ¿Por qué?
c) ¿Qué átomo de la base de Lewis es el sitio básico? ¿Por qué?
d) ¿Cuántos donantes serían necesarios para satisfacer el sitio ácido?
e) Mostrar, usando notación de flecha, la reacción para formar un complejo ácido-base de Lewis.
f) El borano es altamente pirofórico; reacciona violentamente con el aire, estallando en llamas. Muestra, usando la notación de flecha, lo que podría estar sucediendo cuando el borano entra en contacto con el aire.
g) El complejo borano-THF es mucho menos pirofórico que el borano. ¿Por qué supone que es así?
- Contestar
-

Ejercicio\(\PageIndex{4}\)
Cuando un ácido de Lewis neutro se combina con una base de Lewis aniónica, el producto se denomina ion complejo. Lo mismo ocurre si un ácido de Lewis catiónico se combina con una base neutra de Lewis.
Mostrar la formación de los siguientes aniones poliatómicos a partir de los pares ácido-base de Lewis que se combinaron en cada caso.
a) BF 4 - b) PF 6 - c) AlCl 4 - d) AlH 4 - e) Ag (NH 3) 2
Ejercicio\(\PageIndex{5}\)
Considera la reacción a continuación.

• Dibujar un diagrama de mezcla MO para la reacción anterior, usando los siguientes pasos:
o Dibujar el orbital de la base que es probable que done sus electrones.
o Dibujar el orbital del ácido que es probable que acepte electrones.
o Complete el diagrama de mezcla MO de estos dos orbitales:
• Etiquetar el orbital donador de electrones
• Etiquetar el orbital aceptor de electrones
• Relaciona el diagrama de mezcla MO con electrones
o Dibuja una caricatura que muestre la mezcla de estos orbitales.
- Contestar
-

Ejercicio\(\PageIndex{6}\)
a) A continuación se muestra un par ácido/base típico de Lewis.
- Marque los dos compuestos siguientes como ácido de Lewis o base de Lewis.
- Dibuja flechas curvas para mostrar el movimiento de los electrones para formar un enlace.
- Dibuja el producto de la reacción.

b) El par Lewis de abajo reacciona para formar un aducto, pero mucho más lentamente que el anterior.

- Sugerir dos razones por las que el aducto ácido/base de Lewis se forma tan lentamente.
- Contestar
-
a)
b)
- Los anillos de benceno ocupan más espacio que un átomo de flúor; pueden interponerse en el camino, lo que hace más difícil que la molécula de agua se acerque.
Además, los anillos aromáticos pueden ser capaces de formar un sistema conjugado con el orbital p vacío; si ese orbital p está parcialmente lleno, el átomo de boro se vuelve menos ácido de Lewis.
- Un grupo mayor que el flúor puede causar más impedimento estérico. Reemplazar los dos flúor más cercanos al boro en cada areno (anillo aromático) por un grupo CH 3 o CF 3 ralentizaría la formación de un aducto. Alternativamente, un grupo menos electronegativo que el flúor también haría que el boro pareciera menos positivo; un CH 3 u OCH 3 son dos posibilidades.
- Un grupo aún más aceptor de electrones que el flúor haría que el ácido de Lewis fuera más reactivo. Los ejemplos incluyen grupos nitro (NO2) y carbonilo (tales como CH3C=0); estos grupos son extractores de resonancia. Alternativamente, un grupo más pequeño como hidrógeno disminuiría la resistencia estérica, pero también conduciría a una menor electrofilicidad en el boro, debido a la menor electronegatividad del hidrógeno en comparación con el flúor.
Las reacciones químicas involucran eventos de creación de enlaces y ruptura de enlaces, así como el movimiento de electrones. Cuando pensamos en reacciones químicas, a menudo pensamos en de dónde vienen los electrones, y hacia dónde van. En una imagen de la estructura de Lewis, la mayoría de las veces pensamos que los electrones provienen de un par solitario, un par de electrones que no se unen en un átomo en particular. Imaginamos que los electrones se vuelven atraídos hacia un átomo que carece de electrones, tal vez porque no tiene una capa de valencia llena, o tal vez porque tiene cierta cantidad de carga positiva.
Además de una imagen de Lewis, a menudo es útil pensar en reacciones en términos de interacciones orbitales moleculares. Ese tipo de consideración es especialmente útil en la química computacional donde, mediante el uso del software adecuado, podemos calcular los cambios de energía que ocurren en el transcurso de una reacción. También es útil desarrollar una cierta comprensión conceptual de estos enfoques cualitativamente. Este enfoque cualitativo de las interacciones orbitales moleculares es utilizado rutinariamente por los químicos debido a la perspicacia que puede dar a las reacciones.
Una forma común de pensar las reacciones de esta manera es a través del concepto de orbitales fronterizos. Esta idea dice que si una especie va a donar electrones a otra para formar un nuevo enlace, entonces lo más probable es que los electrones donados provengan del nivel energético más alto ocupado. En este nivel, llamado el orbital molecular más alto ocupado (HOMO), los electrones están más alejados del núcleo y por lo tanto menos apretados por los protones en el núcleo. Los electrones serían donados, a su vez, al nivel de energía vacía más bajo en la otra especie, llamada el orbital molecular desocupado más bajo (LUMO).

Consideremos un ejemplo de tal interacción, entre un ión hidróxido y un protón. Un ion hidróxido, HO -, es una base de Lewis. El átomo de oxígeno tiene tres pares solitarios, cualquiera de los cuales podría ser donado a un ácido de Lewis. Un protón, H +, es un ácido de Lewis. Para un átomo de hidrógeno, en la primera pequeña fila de la tabla periódica, la “regla del octeto” es de dos electrones, por lo que un protón podría aceptar un par de electrones de otro átomo y formar un enlace covalente.

El diagrama orbital atómico para un protón es muy sencillo. El hidrógeno solo tiene un orbital 1s, y en H + ese nivel de energía está vacío. Esta órbita corresponde a la LUMO para un protón.
El diagrama orbital molecular para el ion hidróxido no es mucho más complicado. Esta molécula es diatómica; proviene de la combinación de un átomo de oxígeno con un átomo de hidrogema, con la adición de un electrón extra para proporcionar la carga negativa del ion. En el siguiente diagrama, el átomo de hidrógeno interactúa con uno de los orbitales p en el oxígeno, pero no importa exactamente qué orbital de oxígeno usemos.

En la mayoría de los casos, podríamos idear el diagrama MO de otra manera. Si tomamos el atajo de elaborar un diagrama MO aproximado de una molécula basado en su estructura de Lewis, y sabemos que el ion hidróxido tiene un enlace O-H y tres pares solitarios en el oxígeno, entonces sabemos que debería haber un orbital de unión a baja energía, un orbital antiunión a alta energía, y tres no enlaces orbitales en el medio.
En una interacción ácido-base de Lewis, un par de electrones serían donados desde el nivel de no unión en hidróxido (el HOMO) al orbital 1s vacío en el protón (el LUMO).

Lo que tenemos aquí es una interacción entre dos orbitales. Un par de electrones en un orbital se está compartiendo con otro orbital. Ya sabemos que una interacción entre dos orbitales da como resultado dos nuevos orbitales. Uno de los nuevos orbitales, resultante de la interferencia constructiva, es menor en energía que cualquiera de los orbitales originales. El otro nuevo orbital resulta de interferencia destructiva y es más alto en energía que cualquiera de los orbitales originales.

Al final, los dos electrones que se donan se deslizan hacia abajo en energía para convertirse en un enlace O-H. La combinación que sube en energía realmente no importa porque no hay electrones en ese nivel, de todos modos. En general, la energía neta del protón y el ion hidróxido ha disminuido a medida que el par se unió para formar una molécula de agua.
Tenga en cuenta que el diagrama MO para la molécula de agua resultante vuelve a empacar lo que esperaríamos de su estructura de Lewis. Hay dos pares de unión O-H de baja energía y dos orbitales antiadherentes de alta energía correspondientemente. También hay dos pares no adherentes de nivel intermedio correspondientes a los dos pares solitarios que vemos en la estructura de Lewis.
Podemos usar el mismo enfoque para observar la interacción ácido-base de Lewis en moléculas más grandes. Los diagramas MO están un poco más ocupados, pero las ideas son las mismas. Por ejemplo, podríamos imaginar un ion fluoruro donando electrones a una molécula de borano, BH 3. El fluoruro es una base de Lewis porque tiene pares solitarios. El borano es un ácido de Lewis porque el átomo de boro carece de octeto; solo tiene seis electrones de valencia en su estructura.

En este caso, el borano contiene tres enlaces B-H, por lo que habrá tres pares de unión B-H y tres niveles antiadherentes B-H vacíos. También habría un orbital vacío, correspondiente a un orbital p vacío en el boro. Ese orbital p vacío es el orbital molecular desocupado más bajo (LUMO). Un ion fluoruro tendría cuatro pares solitarios, y probablemente imaginaríamos un par de electrones de uno de sus orbitales p como el orbital molecular más alto ocupado (HOMO). Por lo tanto, la interacción implica la donación de uno de estos orbitales sobre fluoruro al orbital p vacío en borano.

Una vez más, esta interacción daría como resultado una nueva molécula con un nuevo diagrama orbital molecular. Los únicos cambios apreciables implicarían los dos orbitales que interactúan entre sí, el HOMO y el LUMO. El diagrama para el ion BH3F- es realmente una superposición de los dos diagramas anteriores, excepto que el HOMO y LUMO han formado un nuevo orbital de unión y antiadhesión para el nuevo enlace B-F.


