14.14: La dirección del traslado de protones
- Page ID
- 80598
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La acidez Brønsted-Lowry es un caso especial de acidez de Lewis. En la acidez de Lewis, un donador de electrones comparte electrones con un aceptor de electrones, formando un enlace. En algunos casos, el aceptor de electrones es un protón.
Si el protón acepta electrones del donante, pero no cede su enlace a su pareja anterior, la interacción se llama enlace de hidrógeno.
Si el protón intercambia un nuevo enlace con el donante por un enlace antiguo con su pareja anterior —si libera un par de electrones a su parte ya que acepta un par de electrones del nuevo donante— el evento se llama transferencia de protones.
El compuesto que proporcionó el protón se llama ácido de Brønsted-Lowry. El compuesto que donó el nuevo vínculo al protón se llama la base Brønsted-Lowry.
Debido a que el protón permitió a su ex pareja tomar el par de electrones de su antiguo enlace, ese socio se convierte en una base de Lewis. En una transferencia de protones, el protón se mueve de una base de Lewis a otra. El protón podría posiblemente volver a su pareja original, sin embargo. El socio original podría simplemente donar su par de electrones al protón nuevamente. Desplazaría al nuevo compañero y recuperaría el protón.
A esta situación se le llama reversibilidad. Las reacciones a menudo pueden moverse hacia adelante y hacia atrás. Para transmitir esta idea, al ilustrar o escribir sobre estas reacciones, se utilizan un par de flechas opuestas para mostrar que la reacción puede ir de izquierda a derecha como está escrita, así como de derecha a izquierda.
- En una reacción reversible, el cambio que se produce en la reacción se puede deshacer. La reacción puede avanzar y retroceder.
En la mayoría de los casos, la reacción se asienta en un lado u otro. O la reacción va mayormente hacia adelante o va mayormente hacia atrás. El punto donde se asienta la reacción se denomina equilibrio. En equilibrio, los reactivos que se unen pueden convertirse en su mayoría en nuevos productos. Al observar una ecuación o diagrama de la reacción,, se dice que el equilibrio “se encuentra a la derecha”, porque los productos de la reacción suelen estar escritos en el lado derecho de la flecha de reacción o flecha de equilibrio. Algunas reacciones “mienten a la izquierda”, lo que significa que muy pocos de los reactivos originales se convierten en última instancia a los productos que muestran.
- El equilibrio es el equilibrio establecido entre los productos formados y los reactivos originales en una reacción reversible.
En una transferencia de protones, el equilibrio está determinado por la fuerza que mantiene el protón por cada ácido de Brønsted. El protón simplemente permanecerá unido a cualquier compuesto que lo une más fuertemente. Si la diferencia en la vinculación es grande, el equilibrio estará lejos a la izquierda o muy a la derecha. Si la diferencia en la unión de protones es pequeña, habrá una mezcla, en la que el protón podría estar en cualquiera de las posiciones.
Recuerde, la mayoría de las reacciones involucran trillones de moléculas. Hay mucho espacio para mezclas.
Podemos predecir dónde terminará el protón mirando las PKAs.
- Un pKa más alto significa que el protón está más apretado.
- Al comparar los pKa de los ácidos de Brønsted en ambos lados de la ecuación, podemos determinar qué compuesto retendrá el protón.
- El equilibrio se situará hacia el compuesto con el pKa más alto.
Esta idea se ilustra en el equilibrio entre el ión hidronio y el ion amonio.
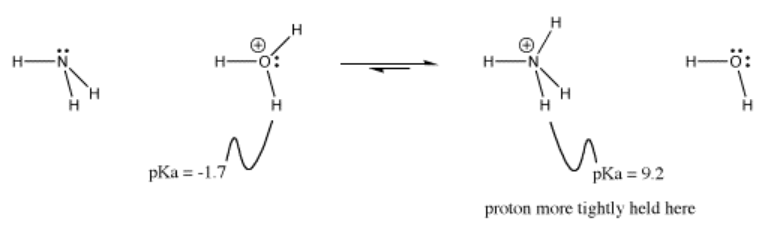
Como otro ejemplo, si el cloruro de hidrógeno se disuelve en agua, el HCl puede ceder su protón al agua. El agua tiene un par solitario y puede actuar como base. Sin embargo, al hacerlo, el agua formará ión hidronio, H 3 O +. El ion hidronio es ácido de Brønsted y puede proporcionar un protón a otra cosa que tenga un par solitario, como un ion cloruro. Esta reacción podría ir y venir. ¿Dónde se asentará?
HCl tiene un pKa de -8. El ion hidronio tiene un pKa de aproximadamente -1.7. El equilibrio en la reacción descrita anteriormente se encuentra a la derecha, hacia el ion hidronio producido cuando el cloruro de hidrógeno se disocia. El protón permanecerá en el oxígeno.
Ejercicio\(\PageIndex{1}\)
Escribe una ecuación para las reacciones de transferencia de protones que puedan ocurrir en cada una de las siguientes mezclas. Usa estructuras en tus ecuaciones. Predecir la posición del equilibrio en cada caso.
a) HF más agua b) CH 3 CO 2 H más amoníaco
c) fenol (C 6 H 5 OH) más carbonato de sodio d) HCN más acetonitrilo
- Contestar a
-

- Respuesta b
-

- Respuesta c
-

- Respuesta d
-

Ejercicio\(\PageIndex{2}\)
Use flechas curvas para mostrar la reacción de transferencia de protones entre los siguientes compuestos.
Predecir los productos para estas reacciones de transferencia de protones.
Use pKa para determinar si cada reacción está favorecida por el reactivo O mezcla OR producto favorecido.

- Contestar
-




