14.15: Aminoácidos y Péptidos
- Page ID
- 80599
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Saber algo sobre la transferencia de protones cambia la forma en que vemos algunas biomoléculas importantes. Los aminoácidos son los bloques de construcción fundamentales de péptidos y proteínas. Los péptidos, que son cadenas de aminoácidos, se utilizan frecuentemente como moléculas de señalización dentro del cuerpo (algunas hormonas son péptidos). Las proteínas, que son péptidos muy grandes, tienen una variedad de usos. Forman los componentes clave de los músculos, por ejemplo, y también forman enzimas que llevan a cabo multitud de reacciones químicas necesarias para la vida.
Los aminoácidos se llaman así porque todos contienen dos componentes comunes. Una es una amina, o un nitrógeno tetraédrico unido a un carbono. El otro es un ácido carboxílico, que es un carbono que está doblemente unido a un oxígeno y también unido a un grupo OH o hidroxilo.
Hemos visto que los ácidos carboxílicos son moderadamente ácidos. La mayoría de ellos tienen pKa de 3 a 5. Eso significa que una pequeña fracción de los grupos OH están ionizados en un gran grupo de ácidos carboxílicos.

También hemos visto que los nitrógenos tetraédricos son algo básicos de Lewis. El nitrógeno puede donar su par solitario a los átomos ácidos de Lewis. Los protones son buenos ácidos de Lewis. Las aminas se protonan fácilmente si hay protones disponibles.

Debido a que el ácido carboxílico es una fuente bastante buena de protones y debido a que los protones se unen bastante bien a las aminas, parece razonable que pueda ocurrir una transferencia de protones de un sitio a otro.

¿Una de estas formas domina el equilibrio? Compara los pKa. El pKa del ácido está cerca de 5, y el pKa del amonio está cerca de 9. El amonio sostiene el protón con más fuerza que el ácido. El protón permanece en el nitrógeno.
Los aminoácidos son zwitteriónicos. Un zwitterion es un compuesto que no tiene carga general pero que tiene separación de carga dentro de él. La naturaleza zwitteriónica de los aminoácidos influye en sus propiedades. Por ejemplo, suelen ser bastante solubles en agua y otros solventes polares.

Los aminoácidos se unen a través de “enlaces amida” para formar péptidos y proteínas. En estas estructuras, los aminoácidos individuales ya no tienen el mismo grupo ácido carboxílico ácido; el carbonilo (o C=O) ya no tiene un grupo hidroxilo unido. Los aminoácidos ya no contienen aminas, tampoco; un nitrógeno unido a un C=O tiene propiedades muy diferentes que un nitrógeno regular unido al carbono. Solo el “extremo N” y el “extremo C” son iónicos. Los nitrógenos a lo largo de la cadena no son muy básicos y no están protonados.

Ejercicio\(\PageIndex{1}\)
Explique por qué un nitrógeno amida no es muy básico.
- Contestar
-

Ejercicio\(\PageIndex{2}\)
El sitio favorecido de protonación en una amida es el oxígeno carbonílico. Mostrar por qué.
- Contestar
-

Los grupos ácidos y básicos que se encuentran en los aminoácidos individuales están enmascarados en péptidos y proteínas. Sin embargo, los péptidos y proteínas tienen sitios básicos y ácidos. Estos sitios se encuentran en las cadenas laterales de los aminoácidos, la parte que varía de un aminoácido a otro. En algunos casos, la cadena lateral contiene un grupo ácido. Los ejemplos son el ácido aspártico y el ácido glutámico.

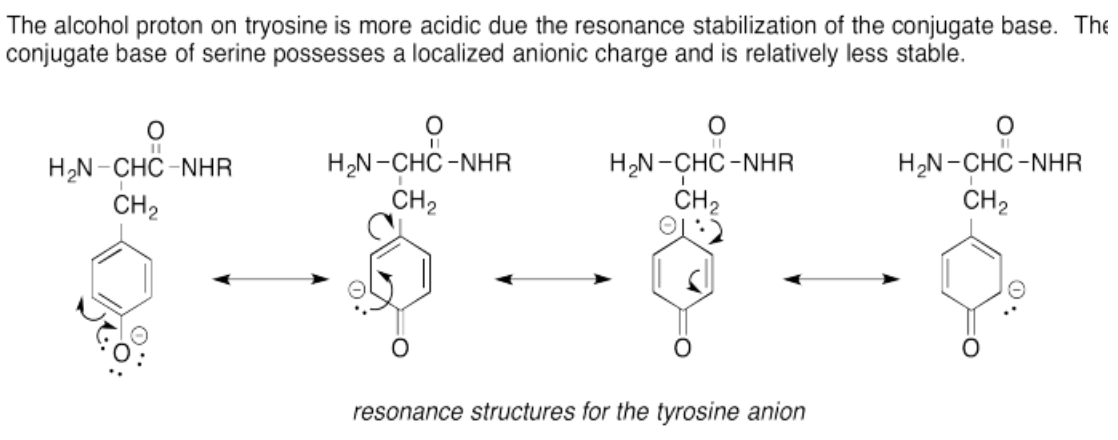
Hay otras cadenas laterales que son débilmente ácidas. Por ejemplo, la tirosina a veces es capaz de suministrar protones, y también lo es la cisteína. El protón proviene de los grupos OH y SH, respectivamente, sobre estos dos compuestos. Sin embargo, ninguno de estos compuestos puede suministrar protones tan fácilmente como el ácido aspártico o el ácido glutámico. Además, la serina, que también tiene un grupo OH, no es realmente capaz de suministrar protones tan fácilmente.
Ejercicio\(\PageIndex{3}\)
Explicar la diferencia de acidez entre serina y tirosina, que ambas contienen grupos OH.
- Contestar
-
Ejercicio\(\PageIndex{4}\)
Explicar la diferencia de acidez entre serina y cisteína, las cuales tienen estructuras muy similares pero con un átomo de azufre en lugar de un oxígeno.
- Contestar
-
El protón tiol sobre la cistina es más ácido debido a la polarizabilidad del anión azufre estabilizando la carga aniónica de la base conjugada. El anión oxígeno es menos polarizable y por lo tanto menos estable, lo que hace que el protón alcohol sea menos ácido.
A veces la cadena lateral de aminoácidos contiene un grupo básico. Los ejemplos son histidina, lisina y arginina. Hay una gran diferencia de basicidad entre estos tres compuestos. La diferencia se puede observar observando los pKa de los ácidos conjugados en cada caso. Cuanto mayor sea el pKa del ácido conjugado, más estrechamente se mantiene el protón, y por lo tanto más básico es el átomo de nitrógeno. La arginina es con mucho la más básica y la histidina es la menos básica.

Ejercicio\(\PageIndex{5}\)
Mostrar por qué el nitrógeno indicado en la cadena lateral de la arginina está protonado, y no los demás. También, explicar la diferencia de basicidad entre arginina y lisina.
- Contestar
-


Ejercicio\(\PageIndex{6}\)
Explicar la diferencia de basicidad entre histidina y lisina.
- Contestar
-

En contraste con los aminoácidos básicos mostrados anteriormente, otros aminoácidos con nitrógeno en sus cadenas laterales no se consideran básicos. Estos compuestos no se protonan fácilmente en sus cadenas laterales.

Ejercicio\(\PageIndex{7}\)
Explique por qué los tres aminoácidos no básicos no son fácilmente protonados en sus átomos de nitrógeno de cadena lateral.
- Contestar
-


