14.16: Condiciones Relativas y pKa
- Page ID
- 80613
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
La reactividad se ve fuertemente afectada por el ambiente alrededor de las moléculas que están reaccionando. Por lo general, el ambiente es un solvente; un solvente es un líquido en el que se disuelven las moléculas. Los efectos de los disolventes (cómo se comportan los diferentes disolventes) y la solvatación (cómo se organizan los disolventes alrededor de una molécula de soluto) son muy importantes a considerar al pensar en la acidez
La solvatación es muy importante. Cuando las moléculas se disuelven en un líquido, pueden moverse fácilmente y mezclarse con otras moléculas. Esa facilidad de movimiento facilita las reacciones. En contraste, las moléculas en estado sólido apenas se mueven en absoluto. Las reacciones en estado sólido son muy, muy lentas porque las moléculas no pueden entrar fácilmente en contacto entre sí. Si se mezclan dos sólidos, las moléculas en la superficie de los granos sólidos pueden reaccionar, pero las moléculas enterradas en su interior quedarán intactos.
Para que un compuesto se disuelva en otro, deben estar presentes algunas atracciones intermoleculares. Para maximizar estas interacciones, las moléculas solventes probablemente necesiten organizarse de alguna manera.
Esta organización de moléculas solventes se vuelve aún más importante cuando están involucrados iones que cuando se disuelven moléculas neutras. Cuando los iones se disuelven, los aniones se separan de los cationes. Las moléculas de solvente deben ser capaces de interactuar con los iones para mitigar los costos energéticos de la separación de carga.
Al organizarse alrededor de una molécula de soluto, se alteran las interacciones habituales entre las moléculas de disolvente. La molécula de soluto ocupa un hueco en las moléculas de disolvente. Por ejemplo, si el solvente es agua, debe haber una ruptura en los enlaces de hidrógeno entre las moléculas de agua para permitir que el soluto nade entre las aguas.
Anteriormente vimos que los átomos más grandes pueden acomodar más fácilmente la carga. Esta regla no se extiende al tamaño de las moléculas. Un ion molecular más grande generalmente no es tan fácil de solvatar como uno pequeño. Los iones más grandes requieren mucha más organización de moléculas de solvente. Además, se deben renunciar a las interacciones entre las moléculas de disolvente (generalmente muy favorables en disolventes como el agua) para que las moléculas de disolvente puedan alejarse entre sí para abrir espacio para los iones huéspedes.


- El tamaño de un ion molecular que se acomoda en una matriz solvente tiene un efecto sobre la estabilidad iónica.
Los diferentes efectos de los disolventes surgen en parte debido a las diferentes atracciones intermoleculares disponibles para las moléculas de disolvente. Algunos disolventes son enlaces de hidrógeno. El agua es un ejemplo muy común, al igual que los alcoholes como el metanol. Otros solo aceptan enlaces de hidrógeno, pero no donadores de enlaces de hidrógeno. La acetona y el acetonitrilo son ejemplos.
Algunos disolventes pueden estabilizar de manera más eficiente los aniones que se forman cuando se desprotonan los ácidos de Brønsted. Como resultado, los valores de pKa pueden ser diferentes cuando se miden en diferentes disolventes. Por ejemplo, el pKa del agua se reporta como 15.7 en agua pura, pero cuando se disuelve en DMSO se reporta como 32. El agua es mucho menos ácida en DMSO que cuando es pura.
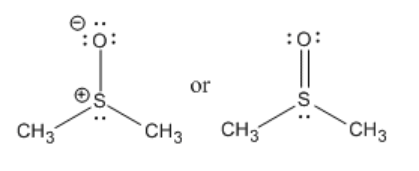
El DMSO tiene algo en común con el agua. El agua es muy polar, con un enlace O-H polar. El DMSO es muy polar, teniendo un enlace S-O fuertemente polarizado. El agua puede enlazarse con hidrógeno. El DMSO es capaz de aceptar enlaces de hidrógeno. Eso significa que el DMSO puede usar sus pares solitarios para donar a protones en otras moléculas. Sin embargo, el DMSO es aprótico. No tiene hidrógenos muy positivos que puedan participar en los enlaces de hidrógeno. Eso significa que una molécula de DMSO no puede unirse por hidrógeno a otra molécula de DMSO como la lata de agua. En consecuencia, no es capaz de donar enlaces de hidrógeno a los aniones, como puede hacerlo el agua. Por lo tanto, el agua es más capaz de estabilizar aniones, por lo que las moléculas pueden ionizarse más fácilmente en agua que en DMSO.
- Los enlaces de hidrógeno pueden ser importantes en la estabilización aniónica.
Hay otra razón para estar al tanto de los efectos de los disolventes en las reacciones de transferencia de protones. A veces, los solventes pueden involucrarse en reacciones ácido-base.
Por ejemplo, el agua es un ácido muy débil, pero puede renunciar a un protón. Cuando lo hace, forma un ion hidróxido. El agua podría dar su protón hasta otro anión si ese anión pudiera unirse a un protón más fuertemente de lo que podría hidratar.
Un ejemplo de esta situación ocurriría si la amida de sodio se disolviera en agua. El amoníaco une su protón con más fuerza que el agua. Así, si la amida de sodio se disolviera en agua, inmediatamente se convertiría en amoníaco, eliminando un protón del agua y formando hidróxido de sodio.
Como resultado, el pKa del amoníaco no pudo medirse fácilmente en agua debido a que su base conjugada no existe realmente en el agua. Evaluar un pKa requiere comparar la cantidad de un compuesto que permanece protonado y compararlo con la cantidad de ioniza del compuesto. Al final resulta que el pKa del amoníaco ronda los 41. Eso es lo suficientemente alto como para que este valor no se determinara directamente. En cambio, se tuvo que extrapolar en comparación con otros datos.
- En ocasiones, los solventes participan en las reacciones. No siempre son transeúntes inocentes.
Ejercicio\(\PageIndex{1}\)
Explicar por qué el bromuro de amonio, NH 4 Br, es más soluble en agua que el bromuro de sodio, NaBr.
- Contestar
-
El bromuro de amonio es más soluble porque en el agua puede participar tanto en el dipolo iónico como en los enlaces de hidrógeno, mientras que el bromuro de sodio solo se beneficia de las interacciones ión-dipolo.
Ejercicio\(\PageIndex{2}\)
El pKa del cianuro de hidrógeno, HCN, es aproximadamente 13 en DMSO. Predecir cualitativamente cómo cambiaría el pH si se mide en a) agua o b) pentano, CH 3 CH 2 CH 2 CH 2 CH 3.
- Contestar a
-
El cianuro de hidrógeno tendrá un pKa más bajo en agua ya que el anión cianuro resultante se estabilizará mediante interacciones ión-dipolo y enlaces de hidrógeno.
- Respuesta b
-
El cianuro de hidrógeno tendría un pK a mayor en pentanos ya que el anión cianuro resultante solo experimentaría interacciones dipolares inducidas por iones que son relativamente débiles.

