14.17: El significado de la relación pKa- producto a reactivo y la constante de equilibrio
- Page ID
- 80590
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
El índice que hemos utilizado para evaluar la acidez de Brønsted, pKa, es una cantidad medible. Se determina midiendo la relación de productos a reactivos en una reacción de transferencia de protones.

Por ejemplo, si el HCl se disuelve en agua, gran parte del mismo se ioniza, transfiriendo un protón al agua para formar iones hidronio y aniones cloruro. Las concentraciones de estas cuatro especies pudieron medirse y compararse. La relación de productos a reactivos se denomina constante de equilibrio, o K eq:
\[K_{eq} = \frac{[H_{3}O^{+}][Cl^{-}]}{[H_{2}O][HCl]} \nonumber\]
Las concentraciones de estas especies generalmente se reportan en moles por litro. Un lunar, ya sabrás, es una unidad utilizada para contar números muy grandes de moléculas. Dado que las moléculas son muy pequeñas, solemos tratar con un número muy grande de ellas a la vez.
Por convención, la concentración de agua en sí misma se define como 1. Eso lleva a una expresión ligeramente diferente.
\[K_{eq}' = \frac{[H_{3}O^{+}][Cl^{-}]}{[HCl]} \nonumber\]
Esta relación, que se ocupa de la transferencia de protones, también se llama la constante de acidez, Ka.
\[K_{a}= \frac{[H_{3}O^{+}][Cl^{-}]}{[HCl]} \nonumber\]
Ejercicio\(\PageIndex{1}\)
Escribe la expresión para el Ka en cada una de las siguientes mezclas.
a) HCN en agua b) H 2 S en agua c) NH 3 en DMSO (DMSO = (CH 3) 2 SO)
- Contestar a
-

- Respuesta b
-

- Respuesta c
-
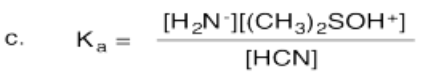
El Ka suele ser un número muy, muy pequeño o uno muy, muy grande. En el caso del HCl en agua, el Ka es de aproximadamente 1 x 10 -8. Tratar con exponentes puede ser engorroso. Para simplificar las comparaciones, la constante de equilibrio se expresa logarítmicamente.
\[pKa = -\log K_{a} \nonumber\]
El Ka suele ser un número muy, muy pequeño o uno muy, muy grande. En el caso del HCl en agua, el Ka es de aproximadamente 1 x 10 -8. Tratar con exponentes puede ser engorroso. Para simplificar las comparaciones, la constante de equilibrio se expresa logarítmicamente.
Ejercicio\(\PageIndex{2}\)
Convierte los siguientes Ka en pKa.
a) 1 x 10 6 b) 1 x 10 -9 c) 3.5 x 10 -25 d) 8.5 x 10 -17
- Contestar a
-
pKa = -6
- Respuesta b
-
pKa = 9
- Respuesta c
-
pKa = 24
- Respuesta d
-
pKa = 16
Ejercicio\(\PageIndex{3}\)
Convierte los siguientes pKa en Ka.
a) -3.5 b) 4.3 c) 9 d) 25
- Contestar a
-
Ka = 10 3.5
- Respuesta b
-
Ka = 10 -4.3
- Respuesta c
-
Ka = 10 -25
- Respuesta d
-
Ka = 10 -9
Las constantes de equilibrio no están restringidas a la transferencia de protones. Se pueden utilizar para describir el grado en que ocurre cualquier reacción. Por ejemplo, pueden escribirse para otros procesos reversibles que involucren química ácido-base.
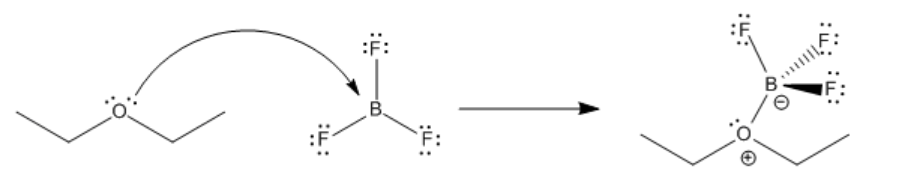
Las interacciones ácido-base de Lewis son muy a menudo reversibles. Por ejemplo, una base de Lewis como éter puede donar un par de electrones a un ácido de Lewis como BF 3. El éter puede recuperar sus electrones de nuevo y dejar atrás al BF 3, también. La fuerza con la que el BF 3 mantiene el éter se denomina constante de unión. En este caso,
\[K_{eq}= \frac{[BF_{3}][Et_{2}O]}{[BF_{3}OEt_{2}]} \nonumber\]
En este caso, se ha reportado que la constante de equilibrio es de aproximadamente 0.25.
Ejercicio\(\PageIndex{4}\)
¿Qué le dice la constante de equilibrio para la formación de un complejo entre BF 3 y éter dietílico (arriba) sobre la posición del equilibrio?
- Responder
-
En el equilibrio se favorece ligeramente la formación del complejo ácido-base de Lewis.
Ejercicio\(\PageIndex{5}\)
La constante de equilibrio para la formación de complejos entre éter dimetílico (CH 3 OCH 3) y BF 3 es 4.2. Compare este valor con el del éter dietílico y explique la diferencia.
- Responder
-
En equilibrio, la formación del complejo ácido-base de Lewis de dimetiléter y BF 3 es más favorecida que el correspondiente complejo de éter dietílico BF 3. Esto probablemente se deba a la disminución del volumen estérico de los grupos methy en comparación con los grupos etilo.
Ejercicio\(\PageIndex{6}\)
Escribir expresiones para la constante de enlace en los siguientes casos.
- (NH 3) 2 PTCl 2 pierde un amoniaco
- Mo (CO) 6 pierde monóxido de carbono
- FeCl 4 - pierde un anión cloruro
- Contestar a
-

- Respuesta b
-

- Respuesta c
-


