14.18: pH y Tampones
- Page ID
- 80585
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
El término pH se refiere a la cantidad de protones fácilmente disponibles presentes en el ambiente. Si el ambiente es agua, el pH es un índice de la concentración de ion hidronio (\(\ce{H3O+}\)) en el agua.
El pH está relacionado con pKa. Ambos índices funcionan en una escala logarítmica para evitar llevar grandes cantidades de decimales en números muy pequeños. Un pH de 6, típico en muchos ambientes biológicos, significa que la concentración de iones hidronio es de aproximadamente 10 -6 moles/L (en la que un mol es una unidad utilizada para el conteo conveniente de cosas nanoscópicas como moléculas o iones, al igual que una docena se usa para contar huevos o donas).
Un pH bajo en realidad significa que hay muchos protones o iones hidronio alrededor. A pH bajo, el ambiente es muy ácido. El pH bajo generalmente se asocia con la presencia de ácidos fuertes de Brønsted. El pH típico de aproximadamente 3 en el estómago es producido por ácido clorhídrico diluido, HCl.
Un segundo factor que afecta el pH es la concentración de especies en solución. Por ejemplo, si una solución de HCl está más concentrada, entonces claramente se pondrán a disposición más protones, por lo que el pH será menor. Una solución en la que la concentración de HCl sea 0.1 moles/litro (o 10 -1 mol/ L) tendrá un pH de aproximadamente 1, pero una solución en la que la concentración de HCl sea 0.001 moles/litro (o 10 -3 mol/L) tendrá un pH de aproximadamente 3. Tenga en cuenta que el pH está matemáticamente relacionado con el exponente en la concentración de un ácido cuando se escribe en notación científica.
El control del pH es muy importante en los sistemas biológicos. Muchos procesos biológicos operan a un pH óptimo, y muchas biomoléculas son estables solo en un cierto rango de pH. Las proteínas son particularmente sensibles a condiciones que incluyen el pH. Los cambios en las condiciones pueden llevar fácilmente a que las proteínas se desnaturalicen, lo que significa que la proteína sufre un cambio de forma que afecta severamente su capacidad de funcionar. Este cambio de forma es un cambio conformacional, y se produce cambiando las interacciones a lo largo de la cadena proteica, incluyendo el cambio de interacciones electrostáticas cuando diferentes sitios se protonan o desprotonan.

Diferentes organismos pueden tener diferentes rangos de pH en los que funcionan mejor. Incluso diferentes tejidos dentro del mismo organismo pueden funcionar mejor a diferentes valores de pH. Para mantener el equilibrio del pH en un nivel óptimo, los sistemas biológicos emplean tampones. Los tampones son compuestos que pueden absorber o proporcionar protones para evitar que el pH de su ambiente cambie. Debido a que necesitan absorber o proporcionar protones, los tampones son ácidos Brønsted débiles o bases débiles, junto con sus conjugados.
El bicarbonato es un ejemplo de un tampón. Cuando el pH es demasiado alto, el bicarbonato puede proporcionar un protón, convirtiéndose en carbonato.
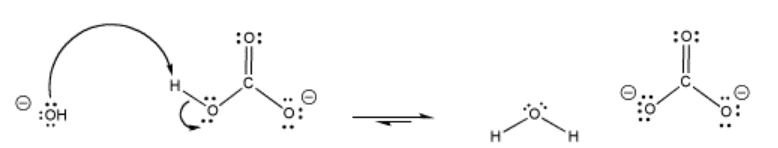
Cuando el pH baja demasiado, la base conjugada, el carbonato, puede absorber un protón y volverse bicarbonato nuevamente.

- Los tampones mantienen el equilibrio del pH interceptando ácidos y bases.
- Agregar una base fuerte como hidróxido agotaría los protones del sistema, elevando el pH; el tampón proporciona protones.
- Agregar un ácido fuerte como cloruro de hidronio bajaría el pH; el tampón recoge los protones.
Ejercicio\(\PageIndex{1}\)
Para los sistemas tampón descritos a continuación, use flechas para mostrar cómo el sistema tampón neutralizaría (i) un ion hidróxido y (ii) un ion hidronio.
- Amoníaco (\(\ce{NH3}\))/cloruro de amonio (\(\ce{NH4Cl}\))
- Dihidrogenofosfato de sodio (\(\ce{NaO2P(OH)2}\))/hidrogenofosfato de sodio (\(\ce{Na2O3POH}\))
- Hidrogeno fosfato de sodio (\(\ce{Na2O3POH}\))/fosfato de sodio (\(\ce{Na3PO4}\))
- Histidina (ver arriba)/clorhidrato de histidina (histidina.HCl)
- Contestar a
-

- Respuesta b
-

- Respuesta c
-

- Respuesta d
-

Debido a que los diferentes ácidos de Brønsted involucrados con estos tampones tienen diferentes pKa, y así contienen protones más o menos fuertemente, diferentes tampones son capaces de operar en diferentes rangos de pH. Este factor, junto con el control sobre las concentraciones de los componentes del sistema tampón, permite que el pH se mantenga bastante constante en casi cualquier valor necesario.

