1.5: Reversión y Le Chatelier
- Page ID
- 79575
A veces, no hay una gran diferencia de energía entre los reactivos y los productos de una reacción. ¿Qué pasa entonces? ¿La reacción va adelante, porque no va a costar mucha energía? ¿O no procede, porque no hay suficiente fuerza impulsora?
Por ejemplo, una reacción simple que ocurre todo el tiempo es la reacción del agua con el dióxido de carbono. Esta es una reacción que ocurre cuando el dióxido de carbono se disuelve en lagos, ríos y océanos. Incluso sucede en tu propio torrente sanguíneo.

El agua reacciona con el dióxido de carbono para formar ácido carbónico.
Sin embargo, el ácido carbónico también se descompone espontáneamente en el agua. Reacciona para formar dióxido de carbono y agua.
En otras palabras, esta es una reacción que puede ir en cualquier dirección. Puede ir hacia adelante o hacia atrás. Es un ejemplo de una reacción de equilibrio. Una reacción de equilibrio es aquella que está energéticamente equilibrada, de manera que realmente no se ve favorecida ir en ninguna dirección.
Las reacciones de equilibrio son de naturaleza extremadamente importante, en parte debido a las capacidades hacia adelante y hacia atrás que ofrecen. En esencia, son reacciones con un botón de “deshacer”. La reacción puede proceder en una dirección cuando sea necesario, y puede proceder en la otra dirección cuando sea necesario.
Sin embargo, hay algunas limitaciones inherentes involucradas. Frecuentemente, las reacciones de equilibrio solo proceden “a la mitad”. Es decir, un grupo de moléculas comenzará a producir productos. Sin embargo, en algún momento esos productos comenzarán nuevamente a volver a los materiales de partida. Eventualmente el sistema se asentará como una mezcla de reactivos y productos.
¿Y si es realmente importante que tengamos los productos de la reacción en un momento dado, sin ninguno de los reactivos? Y si más adelante necesitamos los reactivos, ¿pero no ninguno de los productos? Sería útil si hubiera una manera de controlar la dirección de una reacción de equilibrio, para que pudiéramos “empujarla” hacia un lado u otro.
El control de las reacciones de equilibrio puede ser notablemente simple. De ello se desprende una regla que fue observada por Henri le Chatelier (Ah-ree luh Shah-tell-yay), químico industrial francés, hacia 1900. Le Chaletelier notó que las reacciones de equilibrio a menudo cambian de dirección si se cambian las condiciones de la reacción.
En general, la adición de cualquier producto de la reacción desplaza el equilibrio de nuevo hacia los reactivos. Si se añade algún producto de la reacción, la reacción produce más materiales de partida. Así, agregar más ácido carbónico a una mezcla de dióxido de carbono - agua - ácido carbónico resultaría en reacción inversa, produciendo más agua y dióxido de carbono. Agregar más dióxido de carbono, por otro lado, conduciría a la producción de más ácido carbónico.
Aquí hay una ilustración de dibujos animados de “El principio de le Chatelier” en el trabajo. Supongamos que los cuadrados rojos y los óvalos azules pueden reaccionar juntos para hacer círculos negros y círculos verdes. A lo mejor hay un equilibrio natural en esta reacción, de manera que los dos montones de formas son aproximadamente iguales en tamaño.
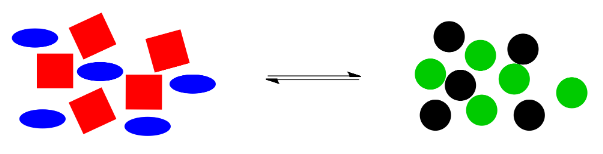
¿Qué pasaría si algo desbalanceara a este sistema? Por ejemplo, tal vez los círculos negros son altamente esquivos, y simplemente se alejan tan pronto como se forman. El sistema ya no estará en equilibrio, porque sin esos círculos negros, el equilibrio se alterará, sin suficientes cosas en el lado derecho para el número de cosas de la izquierda.
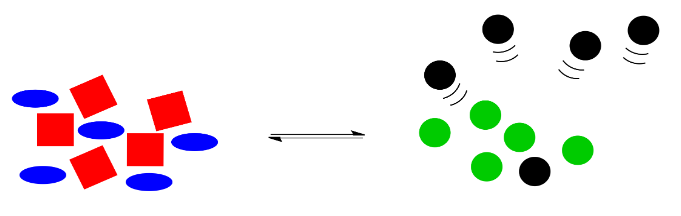
Le Chatelier notó que la naturaleza corrige automáticamente dichos cambios. Si algunos de los círculos negros desaparecen, la reacción volverá a entrar en acción, utilizando algunos cuadrados rojos y elipses azules para producir más círculos verdes y negros. Los números exactos de formas no volverán exactamente a los mismos que antes, debido a que algunos de los círculos negros aún han desaparecido, pero el sistema habrá cambiado para agotar más reactivos a la izquierda y producir más productos a la derecha, de manera que se restaure la relación general entre derecha e izquierda.
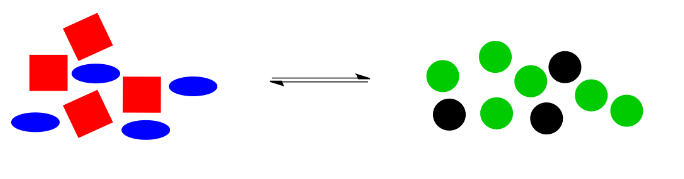
Alternativamente, tal vez encontramos una manera de hacer que los círculos negros se queden donde están. En cambio, hemos arrojado un montón de elipses extra azules. Una vez más, el sistema queda desbalanceado. Esta vez, hay demasiadas cosas a la izquierda, en comparación con la cantidad del lado derecho.
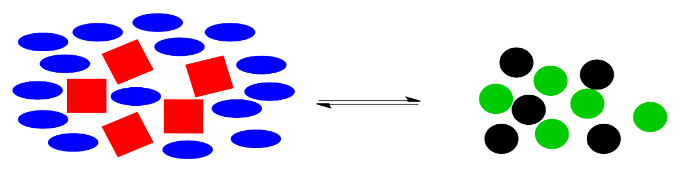
La reacción vuelve a entrar en acción. Utiliza algunas de esas elipses extra azules (y, al mismo tiempo, algunos de los cuadrados rojos) para producir más círculos negros y verdes, devolviendo el sistema a la proporción original de formas del lado derecho a formas del lado izquierdo.
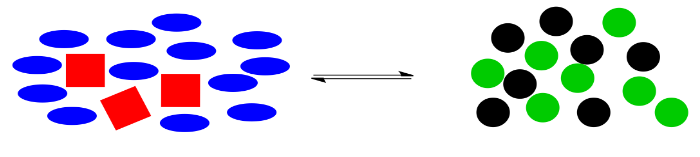
En general, si se agregan moléculas a un sistema, la reacción cambiará para que el sistema vuelva al equilibrio. Si las moléculas se eliminan del sistema, la reacción también cambiará para que el sistema vuelva al equilibrio.
Además, debido a que el calor puede ser consumido por (o producido por) reacciones, la temperatura a veces se puede usar para cambiar los equilibrios. Si una reacción es exotérmica, el calor es un producto de la reacción. Agregar más calor dará como resultado el cambio de reacción para producir más reactivos. Enfriar la reacción (eliminar calor) haría lo contrario: la reacción se desplazaría para producir más calor, y más productos.
En la caricatura, volvemos a tener una reacción de cambio de forma, pero esta vez la reacción libera energía (esas son llamas anaranjadas, simbólicas del calor producido).
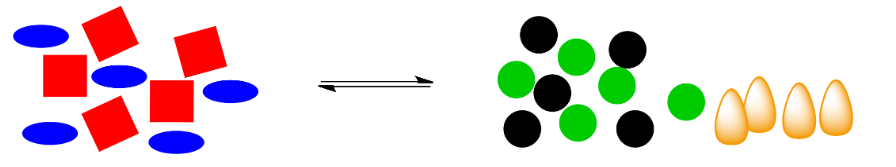
¿Qué pasa si se elimina esa energía? Por ejemplo, si el calor se elimina mediante la adición de un cubito de hielo azul pálido, ¿cuál será el efecto en el sistema?
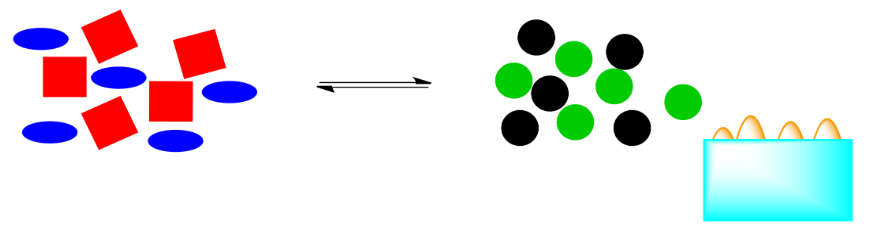
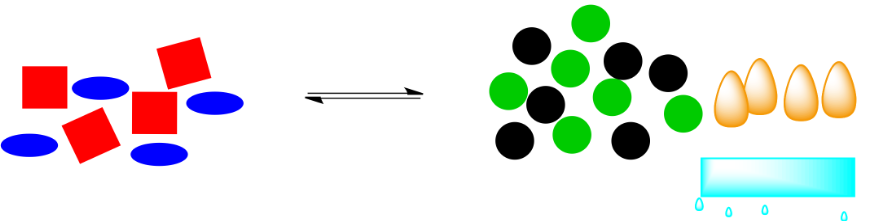
Esas formas de energía naranja (las “llamas”) formaban parte del sistema. Si se retiran, el sistema tendrá que cambiar para restaurarlos. Si la reacción vuelve a empujar hacia la derecha, se liberará más energía, volviendo al sistema al equilibrio.
La reacción de desplazamiento agua-gas implica la producción de gas hidrógeno a partir de vapor y monóxido de carbono. Es importante tanto para la producción comercial de gas hidrógeno como para su aplicación en celdas de combustible. A 300 K, la reacción (y una energía aproximada producida) se muestra a continuación:
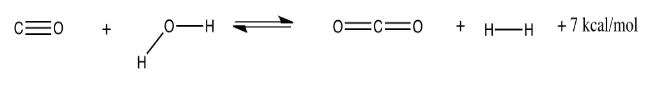
Explique qué pasaría si esta reacción en fase gaseosa ya se encuentra en equilibrio y se producen los siguientes cambios:
- Se duplica la presión del vapor inyectado en la reacción.
- La temperatura se eleva a 450 K.
- El CO 2 producido es “capturado” y eliminado como carbonato.
- Se baja la temperatura a 250 K.
- La presión de CO añadido se corta a la mitad.
- Contestar
- Contestar
-
La eliminación de cualquier artículo producido en el lado derecho de la reacción desplazará la reacción hacia la derecha para restablecer el equilibrio. Por otro lado, agregar más de cualquiera de los ítems de la derecha desplazará la reacción hacia la izquierda.
Los artículos del lado izquierdo funcionarán de la manera opuesta. Agregar más de cualquier cosa a la izquierda desplazará la reacción hacia la derecha, para agotar los materiales recién agregados. Quitar cualquier cosa de la izquierda desplazará la reacción más a la izquierda, para reemplazar los elementos que fueron retirados.
- Contestar a
-
La cantidad de agua aumenta, moviendo la reacción hacia la derecha. Se elaboran más productos.
- Respuesta b
-
La cantidad de energía aumenta, moviendo la reacción hacia la izquierda. Se elaboran menos productos.
- Respuesta c
-
La cantidad de dióxido de carbono disminuye, desplazando la reacción hacia la derecha. Se elaboran más productos.
- Respuesta d
-
La cantidad de energía disminuye, desplazando la reacción hacia la derecha. Se elaboran más productos.
- Respuesta e
-
La cantidad de monóxido de carbono disminuye, desplazando la reacción hacia la izquierda. Se elaboran menos productos.
La hidrocloración del acetileno (etino) es otra reacción en fase gaseosa. Se utiliza para producir cloruro de vinilo, el material de partida para el cloruro de polivinilo comúnmente utilizado para hacer las tuberías en plomería doméstica. A 300 K, la reacción (y una energía aproximada producida) se muestra a continuación:
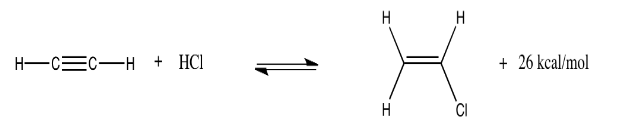
Explique qué pasaría si el sistema está en equilibrio y se producen los siguientes cambios:
- La temperatura se eleva a 350 K.
- La presión de HCl se duplica.
- La presión del acetileno se corta a la mitad.
- La temperatura se baja a 250 K.
- La presión general en el sistema se incrementa de una atmósfera a dos atmósferas.
- Contestar
- Contestar a
-
La cantidad de energía aumenta, moviendo la reacción hacia la izquierda. Se elaboran menos productos.
- Respuesta b
-
La cantidad de cloruro de hidrógeno aumenta, desplazando la reacción hacia la derecha. Se elaboran más productos.
- Respuesta c
-
La cantidad de acetileno disminuye, desplazando la reacción hacia la izquierda. Se elaboran menos productos.
- Respuesta d
-
La cantidad de energía disminuye, desplazando la reacción hacia la derecha. Se elaboran más productos.
- Respuesta e
-
Esta pregunta no sigue el patrón. No obstante, debido a que los productos y reactivos son todos gases, podemos pensar en el efecto que tendrían sobre la presión si la reacción se moviera de una u otra manera. Debido a que se producen menos moléculas de gas a la derecha que a la izquierda, la presión disminuiría al ir de izquierda a derecha (y aumentaría al ir de derecha a izquierda). Así, podemos lápiz en “presión” como un ítem en el lado izquierdo de la reacción. Eso significa que aumentar la presión desplazará la reacción hacia la derecha, haciendo más productos.
La producción de ATP en la célula procede de acuerdo con la reacción a continuación, con una energía aproximada indicada a 310 K.
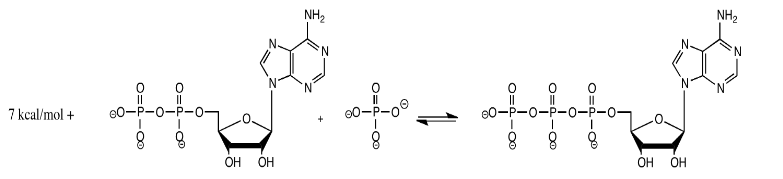
Si el sistema ya está en equilibrio, explique qué sucede cuando se producen los siguientes cambios:
- La temperatura se eleva a 320 K (Está bien. Este organismo es realmente resistente y puede manejar el cambio de temperatura).
- Se baja la temperatura a 300 K.
- El suministro de fosfato inorgánico se duplica.
- Contestar
- Contestar a
-
La cantidad de energía aumenta, desplazando la reacción hacia la derecha. Se elaboran más productos.
- Respuesta b
-
La cantidad de energía disminuye, moviendo la reacción hacia la izquierda. Se elaboran menos productos.
- Respuesta c
-
La cantidad de fosfato aumenta, desplazando la reacción hacia la derecha. Se elaboran más productos.
El ácido nítrico, HNO 3, es un químico industrial común. Por ejemplo, se utiliza para elaborar tintes azoicos que se emplean en pinturas. La producción de ácido nítrico implica la siguiente reacción, con un cambio de energía aproximado indicado a 300 K.
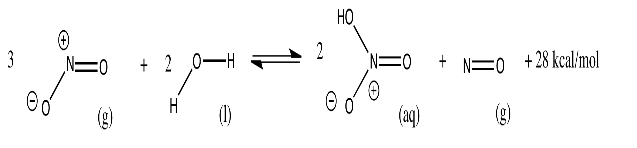
Obsérvese que se trata de una reacción multifásica: involucra gases (g), líquidos (l) y soluciones acuosas (aq, algo disuelto en agua). Explique qué pasaría si la producción se ejecutara bajo las siguientes condiciones:
- El gas NO 2 se introduce en una cámara que contiene un tanque de agua. Después de reaccionar por un tiempo, el gas se libera y el agua, que contiene la solución acuosa de ácido nítrico, se drena del tanque.
- El gas NO 2 se introduce en una cámara que contiene un tanque de agua. Periódicamente, el agua se drena del tanque, y se introduce agua nueva, sin liberar ningún gas.
- El gas NO 2 se introduce continuamente en una cámara, y hay un respiradero que libera lentamente los gases de la cámara en todo momento. También hay un flujo constante de agua dentro y fuera de la cámara.
- Contestar
- Contestar a
-
El ácido nítrico se acumularía en el agua, y el gas NO se acumularía, hasta alcanzar el equilibrio. El ácido nítrico en el agua estaría limitado por ese punto de equilibrio.
- Respuesta b
-
La eliminación periódica de la solución de ácido nítrico y la adición de agua dulce ayudaría a desplazar la reacción más hacia la derecha, aunque la eventual acumulación de gas NO podría evitar que la reacción se desplace demasiado.
- Respuesta c
-
Una fuente constante tanto de agua como de dióxido de nitrógeno (óxido nítrico) ayudaría a empujar la reacción hacia la derecha. Si bien permitir que los gases salgan limitaría la cantidad de dióxido de nitrógeno en el sistema, también evitaría una acumulación de monóxido de nitrógeno (óxido nitroso), que de otro modo empujaría la reacción hacia la izquierda, eventualmente.

