1.9: Soluciones a problemas seleccionados
- Page ID
- 79590
Ejercicio 1.1.1:
Las reacciones que bajan en energía procederán. Las reacciones que suben en energía no procederán. Si el perfil de reacción es mayor a la izquierda (lado reactivo) que a la derecha, la reacción avanzará y formará productos. Si lo contrario es cierto, la reacción presumiblemente no ocurrirá.
Ejercicio 1.2.1:
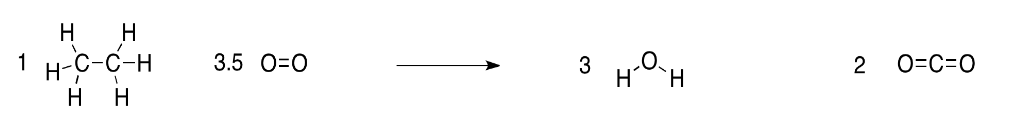
b) Debido a que hay dos carbonos en el etano, una molécula de etano dará lugar a dos moléculas de CO 2.
c) Debido a que hay seis hidrógenos en el etano, una molécula de etano dará lugar a tres moléculas de H 2 O.
d) Para hacer dos moléculas de dióxido de carbono (cuatro átomos de oxígeno) y tres moléculas de agua (tres átomos de oxígeno), necesitaríamos siete átomos de oxígeno en total. Dado que las moléculas de oxígeno contienen pares de átomos de oxígeno, solo necesitaríamos 3.5 moléculas de oxígeno.
En principio, tres moléculas y media es un problema. ¿De dónde vamos a sacar la mitad de una molécula? En la práctica, no es nada de qué preocuparse. Realmente no podemos hacer reacciones con moléculas individuales de todos modos. Siempre estamos trabajando con un gran número de moléculas, pero tenemos que asegurarnos de mantenerlas en la proporción correcta. En lugar de usar una molécula de etano, podríamos usar mil millones de moléculas de etano y 3.5 mil millones de moléculas de oxígeno.
a) La reacción se da con las siguientes estructuras:
e) Los requerimientos energéticos se exponen en la siguiente tabla. En general, la reacción libera 375.5 kcal por mol de etano quemado. El signo negativo en la tabla suele utilizarse para denotar que se trata de un exceso de energía liberada (mientras que un signo positivo indicaría que la energía se consume en general).
| Rompiendo Bond | Costos (kcal/mol) | Suma de Costo | Fabricación de bonos | Lanzamientos (kcal/mol) | Suma de liberación | En general (kcal/mol) | |
| 6 x C-H | 6 * 99 | 594 | 6 x O-H | 6 * 111 | 666 | ||
| 3.5 x O=O | 3.5 * 119 | 416.5 | 4 x C=O | 4 * 180 | 720 | ||
| 1 x C-C | 83 | 83 | |||||
| total | rompiendo: | 1093.5 | fabricación: | 1386 | -292.5 |
Eso es más energía de la que se produjo a partir de una molécula de metano (-170 kcal/mol).
Ejercicio 1.3.1:
La entropía es mayor si la energía se divide en más estados. Por ejemplo, en la pregunta b), la misma cantidad de energía se distribuye en tres estados del lado izquierdo y sólo dos estados a la derecha. La entropía es mayor en el ejemplo de la mano izquierda que en la derecha en ese caso.
Ejercicio 1.3.2:
Ejemplos de “estados” en los que la energía puede dividirse incluyen estados moleculares vibracionales, rotacionales y traslacionales (que, hablando libremente, corresponden a menear, girar y dar vueltas). La entropía es mayor si la energía se distribuye en más de estos estados. Eso podría incluir un mayor rango de estados vibracionales o rotacionales utilizados en (a) y (c), o estados similares empleados en un mayor número de moléculas en (b).
Ejercicio 1.3.3:
Una observación general sobre la entropía interna es que aumenta si el número de moléculas aumenta durante una reacción y disminuye si el número de moléculas disminuye durante una reacción. Es solo cuestión de contar cuántas cosas de la izquierda se convierten en cuántas cosas a la derecha. Por ejemplo, en la pregunta (a), una molécula produce dos nuevas moléculas en la reacción de descarboxilación, por lo que la reacción se ve favorecida entrópicamente.
Ejercicio 1.4.1:
La expresión ΔG = ΔH - TΔS incluye tanto una contribución de entalpía como una contribución de entalpía y las equilibra entre sí. Sin embargo, el efecto de la entropía se multiplica por la temperatura. Cuanto mayor sea la temperatura, mayor será la influencia de la entropía (y por tanto menor será la influencia de la entalpía). Cuanto menor sea la temperatura, menor será la influencia de la entropía (y por tanto mayor será la influencia de la entalpía).
Ejercicio 1.4.2:
Ver problema 1.1.1
Ejercicio 1.5.1:
La eliminación de cualquier artículo producido en el lado derecho de la reacción desplazará la reacción hacia la derecha para restablecer el equilibrio. Por otro lado, agregar más de cualquiera de los ítems de la derecha desplazará la reacción hacia la izquierda.
Los artículos del lado izquierdo funcionarán de la manera opuesta. Agregar más de cualquier cosa a la izquierda desplazará la reacción hacia la derecha, para agotar los materiales recién agregados. Quitar cualquier cosa de la izquierda desplazará la reacción más a la izquierda, para reemplazar los elementos que fueron retirados.
- La cantidad de agua aumenta, moviendo la reacción hacia la derecha. Se elaboran más productos.
- La cantidad de energía aumenta, moviendo la reacción hacia la izquierda. Se elaboran menos productos.
- La cantidad de dióxido de carbono disminuye, desplazando la reacción hacia la derecha. Se elaboran más productos.
- La cantidad de energía disminuye, desplazando la reacción hacia la derecha. Se elaboran más productos.
- La cantidad de monóxido de carbono disminuye, desplazando la reacción hacia la izquierda. Se elaboran menos productos.
Ejercicio 1.5.2:
- La cantidad de energía aumenta, moviendo la reacción hacia la izquierda. Se elaboran menos productos.
- La cantidad de cloruro de hidrógeno aumenta, desplazando la reacción hacia la derecha. Se elaboran más productos.
- La cantidad de acetileno disminuye, desplazando la reacción hacia la izquierda. Se elaboran menos productos.
- La cantidad de energía disminuye, desplazando la reacción hacia la derecha. Se elaboran más productos.
- Esta pregunta no sigue el patrón. No obstante, debido a que los productos y reactivos son todos gases, podemos pensar en el efecto que tendrían sobre la presión si la reacción se moviera de una u otra manera. Debido a que se producen menos moléculas de gas a la derecha que a la izquierda, la presión disminuiría al ir de izquierda a derecha (y aumentaría al ir de derecha a izquierda). Así, podemos lápiz en “presión” como un ítem en el lado izquierdo de la reacción. Eso significa que aumentar la presión desplazará la reacción hacia la derecha, haciendo más productos.
Ejercicio 1.5.3:
- La cantidad de energía aumenta, desplazando la reacción hacia la derecha. Se elaboran más productos.
- La cantidad de energía disminuye, moviendo la reacción hacia la izquierda. Se elaboran menos productos.
- La cantidad de fosfato aumenta, desplazando la reacción hacia la derecha. Se elaboran más productos.
Ejercicio 1.5.4:
- El ácido nítrico se acumularía en el agua, y el gas NO se acumularía, hasta alcanzar el equilibrio. El ácido nítrico en el agua estaría limitado por ese punto de equilibrio.
- La eliminación periódica de la solución de ácido nítrico y la adición de agua dulce ayudaría a desplazar la reacción más hacia la derecha, aunque la eventual acumulación de gas NO podría evitar que la reacción se desplace demasiado.
- Una fuente constante tanto de agua como de dióxido de nitrógeno (óxido nítrico) ayudaría a empujar la reacción hacia la derecha. Aunque permitir que los gases se ventilen limitaría la cantidad de dióxido de nitrógeno en el sistema, también evitaría una acumulación de monóxido de nitrógeno (óxido nitroso), que de otro modo empujaría la reacción hacia la izquierda, eventualmente.
Ejercicio 1.6.1:
El exponente es el número de veces que el número base se multiplica por sí mismo. Por ejemplo, 10 3 = 10 x 10 x 10. Cuanto mayor sea el exponente, mayor será el producto matemático resultante.
Lo mismo ocurre con la magnitud de un exponente negativo, pero el signo negativo significa que estamos tratando con la inversa del número base. Por ejemplo,\(10^{-2} = \frac{1}{10} \times \frac{1}{10} = \frac{1}{(10 \times 10)}\)
Ejercicio 1.6.2:
Cuanto mayor (y más positivo) sea el cambio de energía libre, menor será la constante de equilibrio.
Sin embargo, cuanto mayor (y más negativo) es el cambio de energía libre, mayor es la constante de equilibrio.
Las constantes de equilibrio, de mayor a menor, habrían asociado energías libres de la siguiente manera:
(grande K) grande, negativo Δ G > pequeño, negativo Δ G > pequeño, positivo Δ G > grande, positivo Δ G (pequeño K)
Ejercicio 1.6.3:
Esto es solo un problema de algoritmo, pero no olvides convertir kcal a cal.
Por ejemplo, en el apartado a\(K = e^{-\frac{3000 cal \: mol^{-1}}{1.986 cal \: K^{-1} \: mol^{-1} \times 300K}} = e^{-5.035} = 0.0065 \)
Ejercicio 1.6.4:
Recuerde, cuanto más se acerca K a 1, más cerca se acerca el sistema a una mezcla igual de reactivos y productos. Esa es una ligera aproximación, porque el valor de K cuando hay una cantidad igual de reactivos y productos puede ser más o menor que uno dependiendo de cuántas moléculas (o moles) de cada especie estén involucradas en la reacción.
Ejercicio 1.6.5:
Hay un par de razones, pero una implica el requerimiento de entalpía en comparación con la energía disponible. La temperatura es un índice de la cantidad de energía disponible en los alrededores. Cuanta más energía esté disponible del entorno, más probable es que se pueda suministrar energía para superar un déficit en la entalpía, ya sea para la reacción directa o inversa. Por lo tanto, a alta temperatura, es tan probable que el equilibrio se asiente en el lado de alta energía de la reacción como en el lado de baja energía.
Otra forma de ver las cosas es que el cambio de entropía externa es relativamente pequeño a altas temperaturas, debido a que la distribución adicional de energía resultante de la reacción es muy pequeña en comparación con la distribución preexistente de energía externa cuando ya hay mucha energía en el alrededores. Eso deja sólo el cambio de entropía interna para gobernar el equilibrio.
Ejercicio 1.7.1:
a) K = 10 20-9 = 10 11
Ejercicio 1.7.2:
a) K = 10 17-19 = 10 -2
Ejercicio 1.8.1:
a) Podríamos escribir las ecuaciones para las reacciones, incluyendo el cambio energético involucrado:
\[K + 0.5 Cl_{2} \rightarrow KCl + 104 \frac{kcal}{mol} \nonumber\]
Hay un 0.5 frente al Cl 2. Aunque el cloro es diatómico en su estado elemental, solo necesitamos la mitad del número de moléculas de Cl 2 ya que necesitamos átomos de potasio si queremos formar cloruro de potasio.
\[K + 0.5 Cl_{2} + O_{2} \rightarrow KClO_{2} + 95 \frac{kcal}{mol} \nonumber\]
En ambos casos, el calor de formación es negativo, por lo que estamos escribiendo esa energía como producto de la reacción.
Si escribimos la primera reacción a la inversa,
\[104 \frac{kcal}{mol} + KCl \rightarrow K + 0.5 Cl_{2} \nonumber\]
entonces estamos diciendo que la reacción inversa requeriría el aporte de energía.
Combinaremos esas dos ecuaciones sumando entre sí:
\[K + 0.5Cl_{2} + O_{2} \rightarrow KClO_{2} + 95 \frac{kcal}{mol} \nonumber\]
\[104 \frac{kcal}{mol} + KCl \rightarrow K + 0.5Cl_{2} \nonumber\]
Suma:
\[104 \frac{kcal}{mol} + KCl + K + 0.5Cl_{2} + O_{2} \rightarrow K + 0.5Cl_{2} + KClO_{2} _ 95 \frac{kcal}{mol} \nonumber\]
Simplificando (las 0.5 moléculas de cloro y los átomos de potasio aparecen en ambos lados, por lo que cancelan):
\[104 \frac{kcal}{mol} + KCl + O_{2} \rightarrow KClO_{2} + 95 \frac{kcal}{mol} \nonumber\]
Ahora usamos más álgebra y combinamos la parte numérica:
\[104 \frac{kcal}{mol} -95 \frac{kcal}{mol} + KCl + O_{2} \rightarrow KClO_{2} + 95 \frac{kcal}{mol} - 95 \frac{kcal}{mol} \nonumber\]
Que deja:
\[9 \frac{kcal}{mol} + KCl + O_{2} \rightarrow KClO_{2} \nonumber\]
La energía se agrega a la izquierda. Se necesita para la reacción. El calor de reacción, ΔH rxn = + 9 kcal/mol. Es una reacción endotérmica.

