2.1: Introducción
- Page ID
- 79540
Una introducción general a los compuestos de coordinación se da en el contexto de los ácidos y bases de Lewis en otra página.
Gran parte de la reactividad se puede entender en términos de acidez de Lewis. Quizás los ejemplos más simples de reacciones son la formación de complejos ácido-base de Lewis. En un complejo ácido-base de Lewis, una base de Lewis simplemente ha compartido un par de electrones con un ácido de Lewis, formando un nuevo enlace.
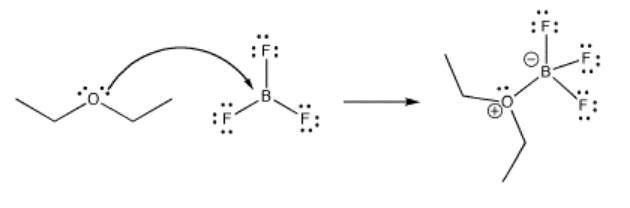
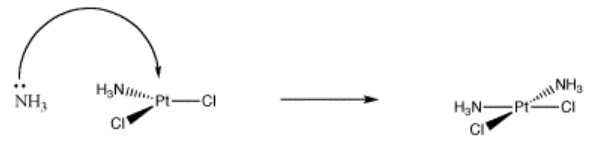
Frecuentemente, los átomos o iones metálicos actúan como ácidos de Lewis. A menudo pueden aceptar electrones de varias bases de Lewis diferentes a la vez, formando “complejos” o “iones complejos” (“complejo” significa que se forman a partir de partes individuales que se conectan entre sí). Se dice que estas bases de Lewis (también llamadas “ligandos”) están “coordinadas” al metal, lo que significa que están pegadas al metal a través del par de electrones que comparten con él.
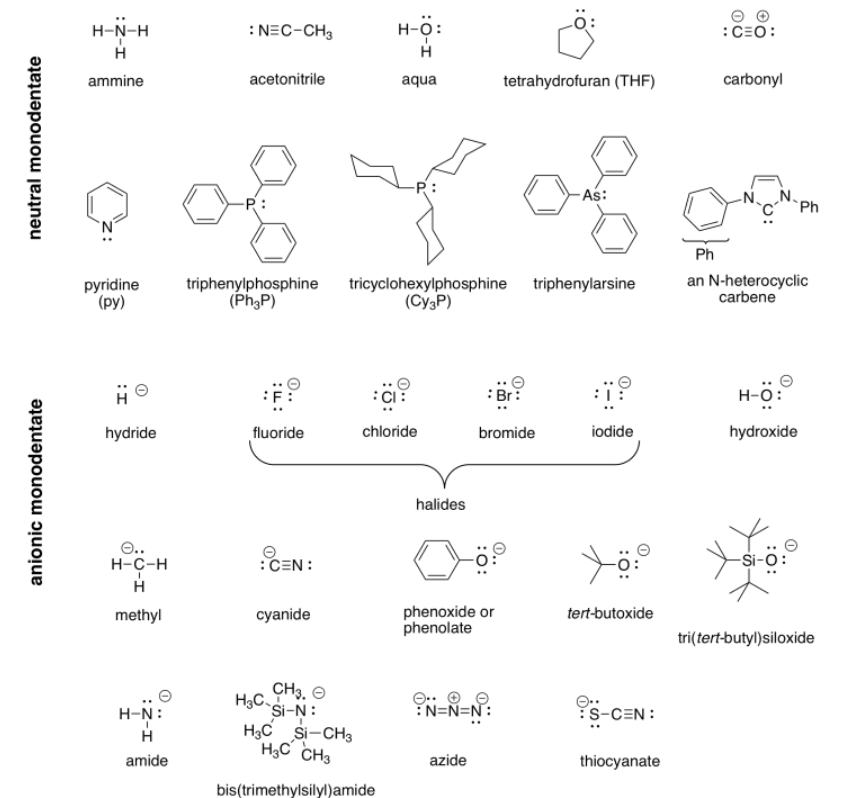
En la siguiente tabla se muestran varios ejemplos de ligandos (compuestos con pares solitarios que pueden unirse a metales).
Cuadro\(\PageIndex{1}\): Algunos Ligandos Comunes.
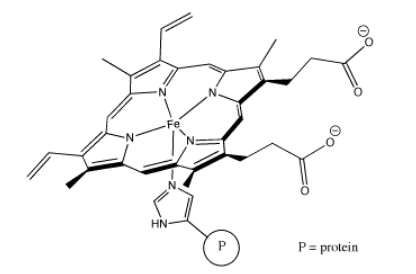
Los “complejos de coordinación” desempeñan un papel importante tanto en la biología como en los procesos económicamente importantes. Probablemente el complejo de coordinación más familiar en biología es la hemoglobina. Puede coordinarse con una molécula de dioxígeno adicional y transportar el oxígeno a través del torrente sanguíneo, entregando oxígeno a los tejidos de manera mucho más eficiente.
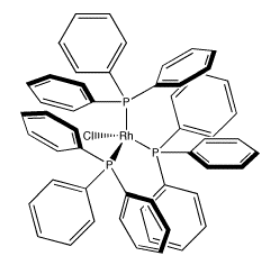
Un complejo de coordinación muy común en uso industrial es el catalizador de Wilkinson, (PPh 3) 3 rHCl. El catalizador de Wilkinson se utiliza para hacer una serie de transformaciones más eficientes; más notablemente, se usa en reacciones de hidrogenación. Las transformaciones químicas de este tipo se utilizan comúnmente en la fabricación de productos farmacéuticos y otros materiales de alta demanda.
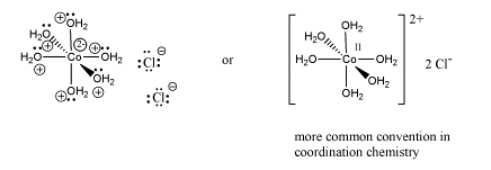
Debido a que los compuestos de coordinación a veces pueden ser aniones o cationes, existe una convención que se usa para decirle al lector qué parte de la fórmula está conectada entre sí, y qué parte es el (los) contraión (s). La parte listada entre corchetes consiste en ligandos que se unen a un metal central; la parte fuera de los corchetes es el (los) contraión (s). Por ejemplo, [(H 2 O) 6 Co] Cl 2 consiste en un ion Co2+ unido a seis aguas. Dos aniones cloruro separados se encuentran cerca.
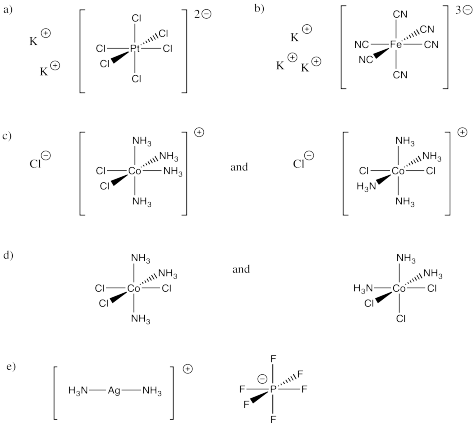
Dibujar estructuras para los siguientes compuestos de coordinación.
- K 2 [PtcL 6]
- K 3 [Fe (CN) 6]
- [(NH 3) 4 COCl 2] Cl (dos isómeros)
- [(NH 3) 3 CoCl 3] (dos isómeros)
- [(NH 3) 2 Ag] PF 6 (es Ag +; eso es un solo PF 6 - contraión)
- Na [HgCl 3]
- Cd (NH 3) 4 Cl 2 (dos isómeros)
- Li 2 [CoCl 4]
- K [Rh (CO) 2 I 2]
- [Fe (OH 2) 6]) NO 3) 2
- [Cu (NH 3) 4] (SO 4) 2
- Na 2 [Ni (CN) 4]
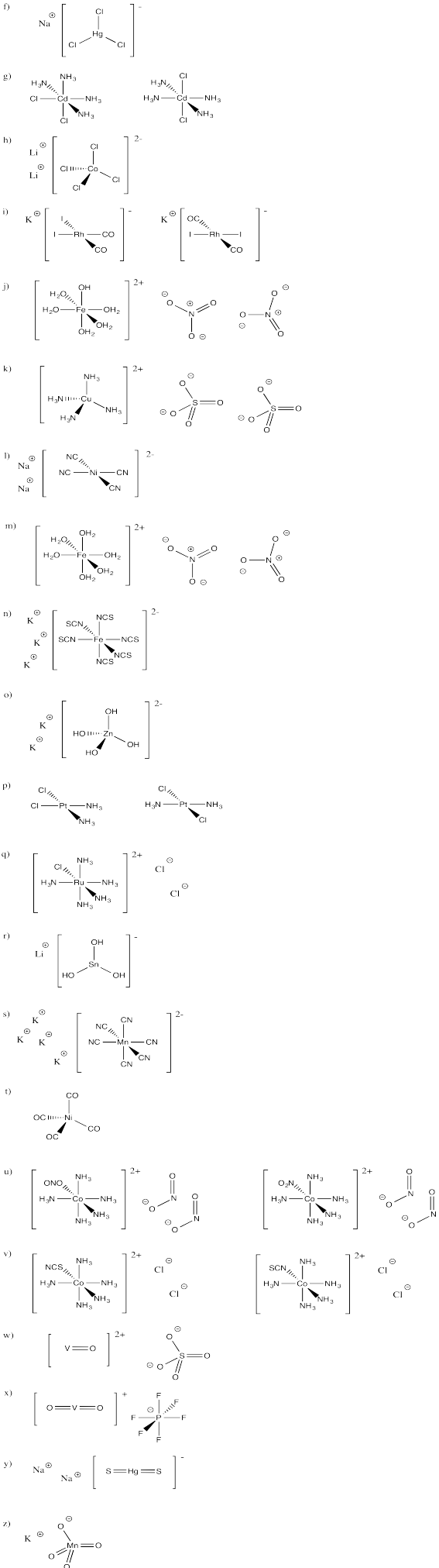
- [Fe (OH 2) 6]) NO 3) 2 (repetición de j.)
- K 3 [Fe (SCN) 6]
- K 2 [Zn (OH) 4]
- Pt (NH 3) 2 Cl 2 (dos isómeros)
- [Ru (NH 3) 5 Cl] Cl 2
- Li [Sn (OH) 3]
- K 4 [Mn (CN) 6]
- Ni (CO) 4
- [Co (NH 3) 5 NO 2] (NO 2) 2 (dos isómeros basados en cómo el ligando se conecta al metal)
- [Co (NH 3) 5 SCN] Cl 2 (dos isómeros posibles)
- [VO] SO 4 (desafío: ¿por qué podrías dibujar el enlace V-O de manera diferente a los otros enlaces metal-ligando hasta ahora?)
- [VO 2] PF 6
- Na 2 [HgS 2]
- K [MnO 4]
- Contestar
-
Identificar las geometrías de cada uno de los complejos en Ejercicio\(\PageIndex{1}\)

