2.2: ¿Qué tan apretada se unen los ligandos?
- Page ID
- 79584
Todos los complejos ácido-base de Lewis se forman reversiblemente. Eso significa que, así como la base Lewis puede donar sus electrones al ácido, puede recuperarlos de nuevo.
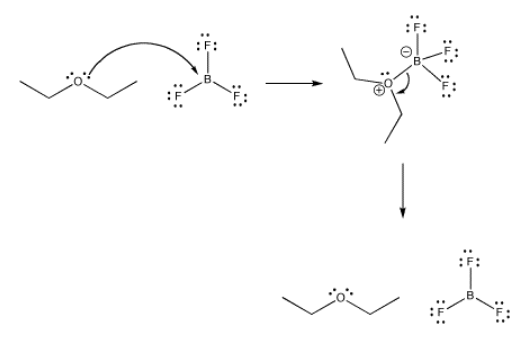
¿Exactamente cuán reversibles son estos enlaces? ¿Qué tan estrechamente se une un ligando en un complejo de coordinación? Hay muchos factores que afectan la respuesta a esta pregunta, entre ellos la naturaleza del metal, el ligando, el ambiente o disolvente, la temperatura, etc. Sin embargo, en general, la respuesta se pudo encontrar en cualquier caso concreto al observar una constante de equilibrio.
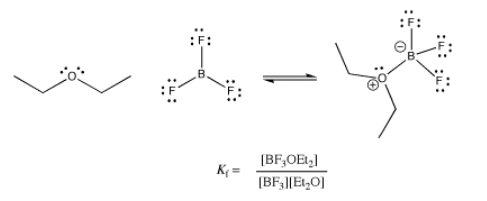
Esta constante de equilibrio, que compara la relación entre el complejo y el ácido de Lewis libre y la base de Lewis, a veces se denomina constante de formación o constante de unión. Es una medida de la fuerza con la que se une el ligando. Lo mismo expresado a la inversa,\(K= \frac{[BF_{3}][Et_{2}O]}{[BF_{3}OEt_{2}]}\), se llama la constante de disociación. Por supuesto, realmente mide lo mismo desde el punto de vista opuesto: ¿con qué facilidad se da por vencido el ligando? Numéricamente, es solo lo inverso, 1/Kf.
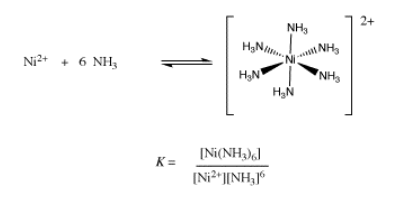
Si hay muchos ligandos unidos al ion, como en la formación del ion níquel hexaammina, entonces la constante de formación se vuelve más complicada. Realmente es una combinación de seis constantes de unión diferentes: la constante para el primer amoníaco con ión níquel, la constante para el segundo amoníaco con el ion níquel amina, y así sucesivamente. Cuando se combinan todas estas constantes individuales, se llega a una concentración de amoníaco elevada al sexto poder en la expresión para la constante de formación.
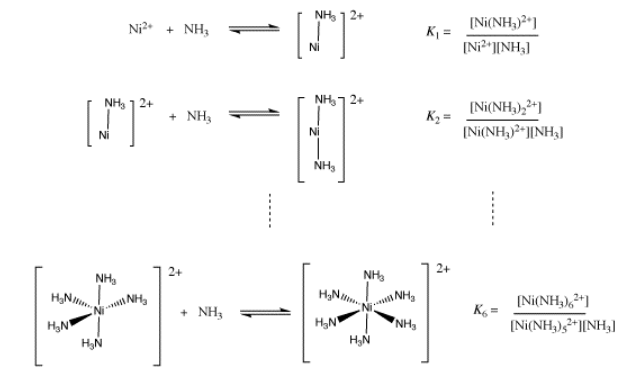
Demostrar que la constante de equilibrio global para la formación de Ni (NH 3) 6 2+ es un producto de las constantes de equilibrio para etapas individuales de unión de amoníaco, K 1 x K 2 x... x K 6.
- Responder
-
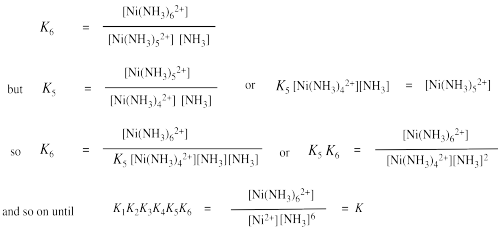
Determinar una constante de equilibrio requiere que se puedan medir las concentraciones de las especies individuales, como [Ni 2+], [NH 3] y [Ni (NH 3) 6 2+]. Esta medición podría realizarse usando técnicas espectroscópicas o electroquímicas. Esta medición se ha hecho para este ejemplo a 25 ° C en agua, y el valor de K = 1.0 x 10 8 M -6.
Los valores numéricos para las constantes de unión individuales para amoníaco con níquel a 25° C en agua son los siguientes:
K 1: 4.7 x 10 2 K 2: 1.3 x 10 2 K 3: 41 K 4: 12 K 5: 4.2 K 6: 0.81
a) Utilizar estos valores para confirmar el valor de la constante de formación del complejo para [Ni (NH 3) 6 2+].
b) ¿Qué explicaciones puedes ofrecer para la tendencia en los valores individuales de K?
- Responder
- Contestar a
-
K = K 1 x K 2 x K 3 x K 4 x K 5 x K 6
= 470 x 130 x 41 x 12 x 4.2 x 0.81
= 1.03 x 10 8
- Respuesta b
-
A medida que el níquel se une a ligandos de amoníaco, se vuelve más saturado electrónicamente. Eso significa que se vuelve menos ácido Lewis. No tiene una atracción tan fuerte por ligandos adicionales.
La realidad de la determinación experimental de la constante de unión es más compleja de lo que se ilustra en estas figuras. Por ejemplo, un ion Ni 2+ realmente no existe por sí solo. En primer lugar, debe haber contraiones involucrados. Si los contraiones no se seleccionan cuidadosamente, podrían afectar las mediciones. Por ejemplo, si los contraiones son cloruros, tal vez podrían formar NiCl 2 u otras especies de cloruro. El cloruro es una base de Lewis y podría competir con el amoníaco como nucleófilo o ligando alternativo. Otros contraiones se denominan “no coordinantes” porque generalmente no se unen con ácidos de Lewis; estos incluyen BF 4 -, PF 6 - y ClO 4 -.
Además, el hecho de que el experimento se hiciera en agua significa que el ion Ni 2+ no estuvo realmente involucrado. El agua también es un nucleófilo. Eso significa que la especie inicial real fue [Ni (OH 2) 6 2+]. En lugar de limitarse a unirse a un ion níquel desnudo, el amoníaco estaba reemplazando a las moléculas de agua, una a la vez.
Exactamente cómo un nucleófilo sustituye a otro en un complejo de coordinación es el tema de otro capítulo.
Explicar las diferencias entre las constantes de formación para los siguientes complejos a 25° C:
a) [Zn (NH 3) 4 2+]: 7.8 x 10 8 y [Zn (CN) 4 2-]: 4.7 x 10 19
b) [Fe (CN) 6 4-]: 1.0 x 10 24 y [Fe (CN) 6 3-]: 1.0 x 10 31
- Responder
- Contestar a
-
Este es un ion Zn 2+ que se une a ligandos NH 3 o CN -. El catión zinc es más fuertemente atraído por los ligandos de cianuro aniónicos que el ligando de amoníaco neutro, por lo que la constante de unión con cianuro es mayor que con amoníaco.
- Respuesta b
-
Ambos casos involucran iones cianuro. En un caso, el CN - se une a Fe 2+, mientras que el otro caso involucra Fe 3+. El ligando es más atraído por el ion más cargado, por lo que la constante de unión es mayor.

