2.3: Recuento de electrones en complejos de metales de transición
- Page ID
- 79562
El conteo de electrones siempre es importante en la química, especialmente cuando ocurren reacciones. Debido a que las reacciones implican la transferencia de electrones de un átomo a otro durante la fabricación y ruptura de enlaces químicos, necesitamos hacer un seguimiento de hacia dónde van los electrones.
Contar electrones en un metal de transición en un compuesto de coordinación puede ser un poco complicado. En lugar de una regla de ocho electrones u octeto, los metales de transición obedecen a una regla de dieciocho electrones. La forma más fácil de contar electrones es separar el complejo y contar los electrones en pedazos. Primero, devolvemos los electrones donados a los ligandos individuales.
- Deconstruir el complejo: devuelva los pares solitarios a los ligandos
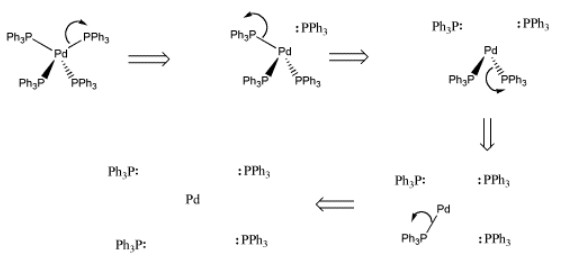
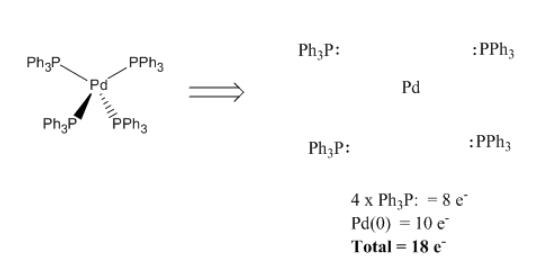
Una vez que el complejo ha sido deconstruido, contamos un par de electrones por cada ligando, ya que cada uno de ellos está donando un par al metal en el complejo. También, debemos contar los electrones de valencia que el metal trae consigo mismo. El total es el recuento de electrones en el metal en el complejo. A menudo equivale a dieciocho.
- Contar un par de electrones por ligando
- Cuenta los electrones de valencia en el metal
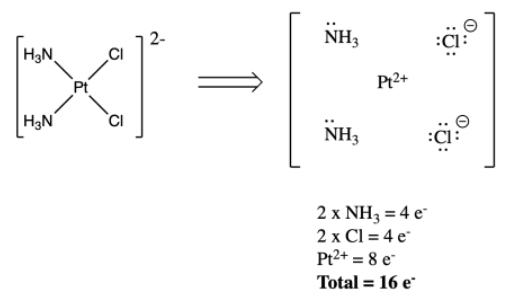
Hay una arruga en este proceso si hay cargos involucrados. Por ejemplo, si los ligandos libres no son neutros, sino cargados, es necesario ajustar el recuento de electrones en el metal. El metal puede ser un ion, no un átomo, por lo que el recuento de electrones será menor. Si los átomos donantes tienen cargas formales, ajuste la carga en el átomo o ion metálico para equilibrar la carga general en el complejo. En muchos casos, la carga general es cero, por lo que la carga de metal es solo la suma de cargas sobre ligandos.
Si no recuerdas nada sobre cargos formales, revisa aquí.
- Verificar cargos formales en átomos donantes de ligandos libres
- Ajuste la carga en el metal para que la carga total de (ligandos + metal) sea igual a la carga en el complejo
Por ejemplo, en cis-platino, dos de los ligandos son cloruros, los cuales tienen cargas negativas. Dado que el cis -platino es neutro en general, el platino debe tener una carga de dos más. En consecuencia, no tiene diez electrones. Sólo tiene ocho. El recuento total de electrones del metal en el complejo es de dieciséis.
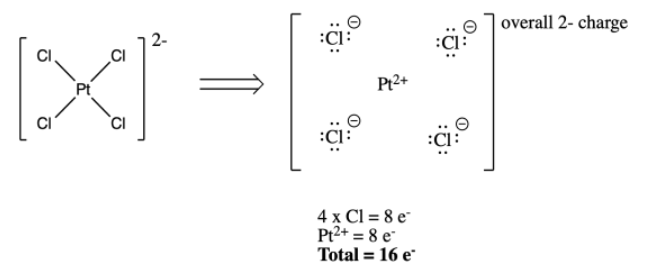
Una arruga adicional ocurre si hay una carga general en el complejo. En el grupo principal, los compuestos covalentes, siempre ajustamos el recuento de electrones para reflejar una carga general sobre la estructura. No tenemos que hacer eso aquí, porque ya hacemos el ajuste cuando decidimos el “estado de oxidación” o cargamos sobre el metal.
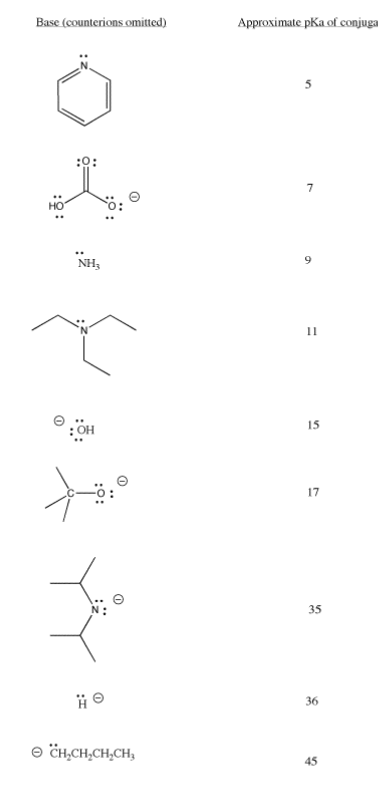
Los ligandos aniónicos a menudo se preparan desprotonando una molécula neutra. A continuación se muestran algunas bases comunes utilizadas en la química sintética. Se necesita una gama de resistencias base para asegurar la eliminación completa de protones de una variedad de reactivos. Por otro lado, las diferencias de pKa muy grandes entre el reactivo ácido y el ácido conjugado producido en la reacción, pueden provocar reacciones altamente exotérmicas y provocar incendios.
Cuadro CC\(\PageIndex{1}\): Algunas bases de uso común en química sintética.
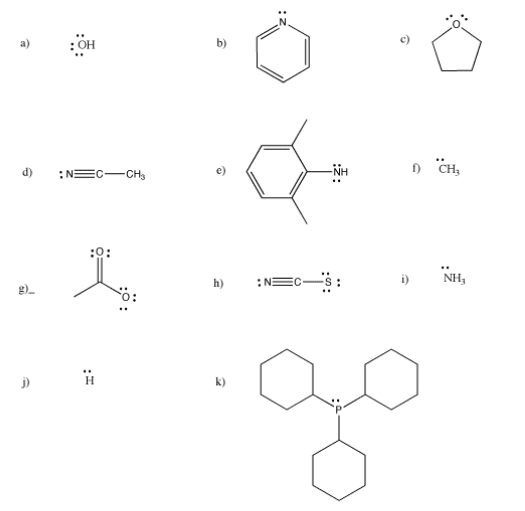
¿Cuáles de los siguientes ligandos son aniónicos y cuáles son neutros?
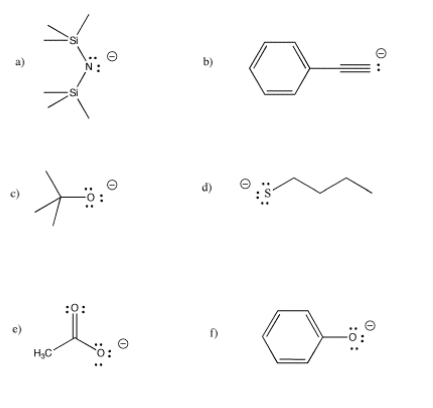
Para los siguientes ligandos, mostrar el neutro correspondiente (el ácido conjugado). Seleccione una base adecuada para desprotonarla, y justifique su elección.
Dibuje estructuras para los siguientes complejos (o iones complejos), luego deconstruirlos en ligandos y átomos metálicos (o iones).
a) [Co (NH 3) 4 Cl 2] + b) [Fe (CN) 6] 3- c) [Co (NH 3) 6] 2+
d) [MnO 4] - e) Fe (CO) 5 f) [PtCl 6] 2-
g) Mo (CO) 6 h) [WO 4] 2- i) (PPh 3) 3 RHCl
j) [RuO 3] 2- k) PCy 3 Ir (H) (CO) Cl (Cy = ciclohexilo)
Para cada complejo en el problema anterior, ¿cuál es el recuento de electrones de valencia en el metal en el complejo?
- Contestar a
-
Recuento de valencia metálica: 9
Metal con carga: 6
Donado por ligandos: 6 x 2 = 12
Total: 18
- Respuesta b
-
Recuento de valencia metálica: 8
Metal con carga: 5
Donado por ligandos: 6 x 2 = 12
Total: 17
- Respuesta c
-
Recuento de valencia metálica: 9
Metal con carga: 7
Donado por ligandos: 6 x 2 = 12
Total: 19
- Respuesta d
-
Recuento de valencia metálica: 7
Metal con carga: 0
Donado por ligandos: 4 x 4 = 16
Totales: 16
- Respuesta e
-
Recuento de valencia metálica: 8
Metal con carga: 8
Donado por ligandos: 5 x 2 = 10
Total: 18
- Respuesta f
-
Recuento de valencia de metal: 10
Metal con carga: 6
Donado por ligandos: 6 x 2 = 12
Total: 18
- Respuesta g
-
Recuento de valencia metálica: 6
Metal con carga: 6
Donado por ligandos: 6 x 2 = 12
Total: 18
- Respuesta h
-
Recuento de valencia metálica: 6
Metal con carga: 0
Donado por ligandos: 4 x 4 = 16
Totales: 16
- Respuesta i
-
Recuento de valencia metálica: 9
Metal con carga: 8
Donado por ligandos: 4 x 2 = 8
Totales: 16
- Responder j
-
Recuento de valencia metálica: 8
Metal con carga: 4
Donado por ligandos: 3 x 4 = 12
Totales: 16
- Responder k
-
Recuento de valencia de metal: 9
Metal con carga: 7
Donado por ligandos: 4 x 2 = 8
Total: 15
La carga sobre el metal a menudo se representa como un número romano entre paréntesis. Este número se llama formalmente el estado de oxidación. El estado de oxidación se refiere a cuántos electrones ha perdido (o ganado) un átomo. En casos como éste, el estado de oxidación es lo mismo que la carga sobre un ion. Por ejemplo, Ta (V) significa un ion Ta 5+.
¿Cuántos electrones de valencia se encuentran en los siguientes iones metálicos?
a) Fe (II) b) Ni (II) c) Mn (II) d) Fe (III)
e) Zn (II) f) Mn (IV) g) Cu (I) h) Au (0)
i) Cr (IV) j) Cu (II) k) Fe (IV)
- Responder
- Contestar a
-
6
- Respuesta b
-
8
- Respuesta c
-
5
- Respuesta d
-
5
- Respuesta e
-
10
- Respuesta f
-
1
- Respuesta g
-
10
- Respuesta h
-
12
- Contestar i
-
2
- Responder j
-
9
- Responder k
-
4
Los complejos de coordinación suelen tener 18 electrones en el átomo metálico. Eso es porque, para los metales de transición, dieciocho es el número de electrones en la configuración de gas noble más cercana, que incluye s + p + d electrones. (La segunda y tercera fila de metales de transición también tienen electrones f, pero generalmente simplificamos y no nos preocupamos por esos electrones para propósitos de conteo de electrones; los tratamos como electrones centrales, no como electrones de valencia). Las excepciones frecuentes incluyen 16 complejos de electrones, los cuales son especialmente comunes en metales tardíos como el cobre, el níquel y el paladio. Existen consideraciones orbitales moleculares que contribuyen a estas excepciones.
Ocasionalmente, los recuentos de electrones pueden ser tan bajos como ocho electrones. Estos casos suelen ocurrir en metales de transición temprana, como el titanio o el tántalo. Estos metales tienen un largo camino por recorrer para llegar a dieciocho electrones, y a veces no pueden encajar tantos ligandos en su “esfera de coordinación”. De ahí que los factores estéricos puedan impedir que los metales alcancen dieciocho electrones.
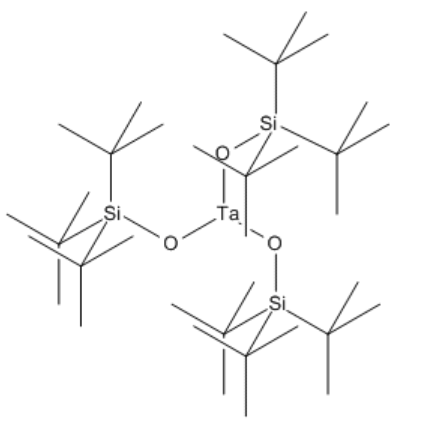
Los complejos que no tienen dieciocho electrones a veces se denominan “electrónicamente insaturados”. Al igual que los complejos de seis electrones en la química del grupo principal, a menudo reaccionan con los donantes para aumentar el recuento de electrones en el átomo metálico.
Deconstruir (silox) 3 Ta en ligandos y átomo metálico (o ion) y confirmar el recuento de electrones en tántalo
Dibuje los siguientes compuestos de baja valencia y determine el número de electrones de valencia en el metal en cada uno.
a) Me 3 TaCl 2 b) [(Me 3 Si) 2 N] 3 Fe c) W (CH 3) 6
Debido a que el hacinamiento estérico es una de las razones por las que los metales en los complejos de coordinación pueden permanecer “electrónicamente insaturados” (es decir, no suficientes electrones) o “coordinativamente insaturados” (porque no hay suficientes donantes), es importante prestar atención a cuánto espacio ocupará un ligando. El parámetro utilizado para describir este factor se denomina “ángulo de cono”. Este es solo el ángulo en la nariz del cono imaginario donde el ligando se une al metal. La anchura del cono, y por lo tanto el ángulo del cono, se descarta por lo grande que es el ligando. Un ángulo de cono grande indica un ligando grande; un ángulo de cono pequeño se asocia con un ligando más pequeño.
Por ejemplo, la trimetilfosfina, P (CH 3) 3, tiene un ángulo de cono de 118 0. La trietilfosfina, P (CH 2 CH 3) 3, es ligeramente mayor, con un ángulo de cono de 132 0.
Predecir cuál de los siguientes pares tendrá el ángulo de cono más grande.
a) PF 3 o PH 3
b) PH 3 o P (CH 3) 3 (también abreviado PMe 3)
c) PMe 3 o P (C (CH 3) 3) 3 (también abreviado P t Bu 3)
d) P t Bu 3 o P (cíclico -c 6 H 6) 3 (también abreviado PPh 3)
- Responder
- Contestar a
-
PF 3 (104 o vs 87 o)
- Respuesta b
-
PMe 3 (118 o vs 87 o)
- Respuesta c
-
P t Bu 3 (182 o vs 118 o)
- Respuesta d
-
P t Bu 3 (182 o vs 145 o)

