2.15: Más soluciones a problemas seleccionados
- Page ID
- 79528
Ejercicio 2.7.1:
a) Zn (II), porque es más pequeño y menos polarizable.
b) K +, porque es menos electronegativo.
c) Fe (III), por la mayor carga.
Ejercicio 2.7.2:
a) Me 3 P, porque el fósforo es mayor y más polarizable que el nitrógeno.
b) El yoduro, que es más grande y polarizable que el cloruro.
c) Azida, que tiene un sistema de unión pi más polarizable y deslocalizado.
Ejercicio 2.7.3:
a) ZrO 2
b) CDs
c) WO 3
d) ZnS
e) Cu 2 S
Ejercicio 2.7.4:
a) Hg (I) y Hg (II) son ambos iones grandes, polarizables. Son cationes blandos y deben unirse bien a los donantes blandos.
b) El donante blando más común es un átomo de azufre o ion sulfuro; en aminoácidos, que sugiere cisteína o metionina.
Ejercicio 2.7.5:
El Fe (III) es un catión duro y debe unirse bien a los donantes de oxígeno. La enterobactina tiene varios donantes de oxígeno que podría proporcionar al hierro. De hecho, hay un par de grupos OH en cada uno de los anillos de benceno en la enterobactina. Estos anillos de benceno con dos grupos OH uno al lado del otro se llaman “catecoles”. Debido a que hay tres de estos grupos en la enterobactina, y hay suficiente espacio en el medio para que los grupos se plieguen alrededor de un átomo central, la enterobactina es un donante quelante (hexadentado) con una alta constante de unión.
Ejercicio 2.8.1:
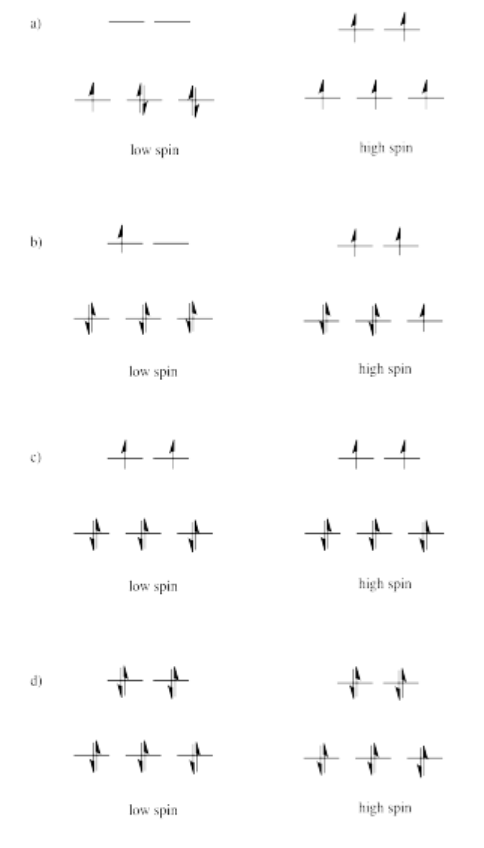
Ejercicio 2.8.2:
Los tres orbitales mostrados arriba interactúan un poco más fuertemente con los ligandos. Los tres orbitales que se muestran a continuación interactúan un poco más débilmente.
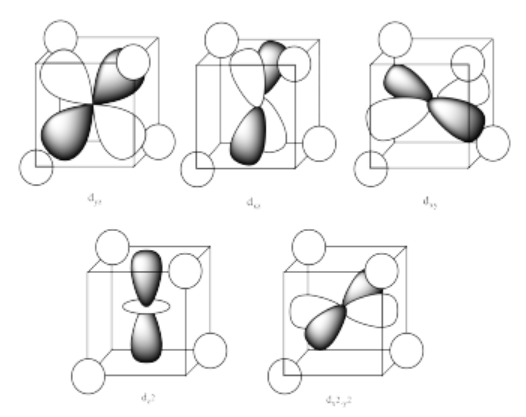
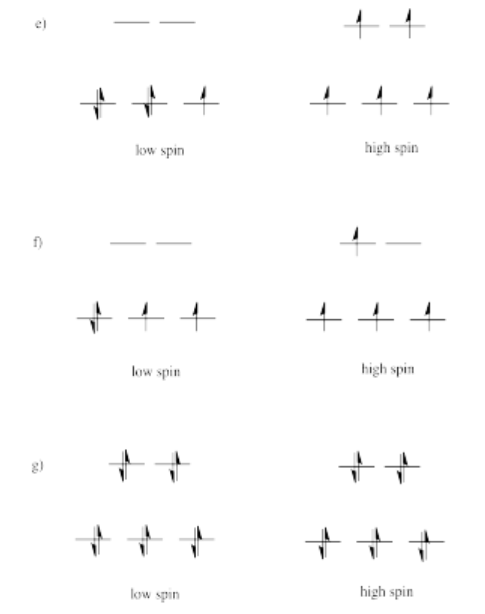
La razón de la diferencia en la interacción tiene que ver con lo cerca que el lóbulo más cercano de un orbital d llega a un ligando. Realmente hay dos posiciones posibles: la cara de un cubo o el borde de un cubo. Si los ligandos están en esquinas alternas del cubo, entonces los orbitales que apuntan a los bordes están un poco más cerca que los que apuntan a las caras del cubo.
Ejercicio 2.8.3:
Los ligandos no se solapan con los orbitales d así como en los complejos tetraédricos como en los complejos octaédricos. Así, existe una interacción de unión más débil en el caso tetraédrico. Eso significa que el orbital antienlace que involucra a los electrones d no se eleva tan alto en energía, por lo que la división entre los dos niveles d es menor.
Ejercicio 2.8.4:
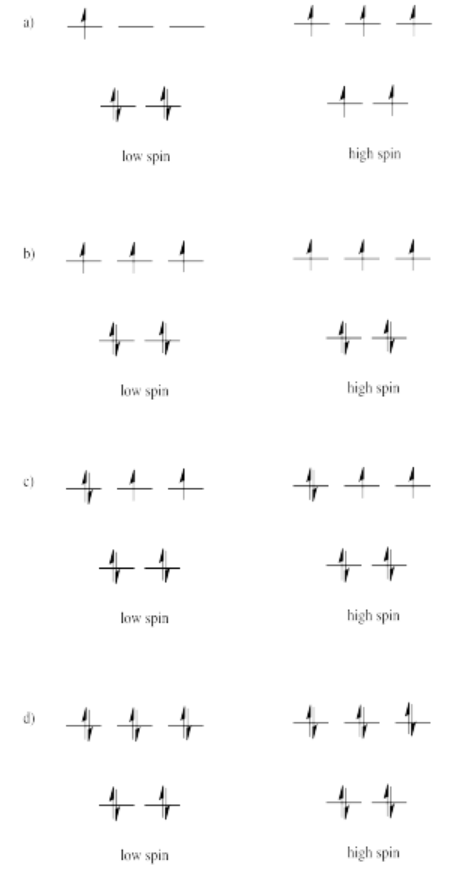
Ejercicio 2.8.5:
Debido a que la división orbital d es mucho menor en el caso tetraédrico, es probable que la energía requerida para emparejar dos electrones en el mismo orbital sea mayor que la energía requerida para promover un electrón al siguiente nivel de energía. En la mayoría de los casos, el complejo será de alto giro.
Ejercicio 2.8.6:
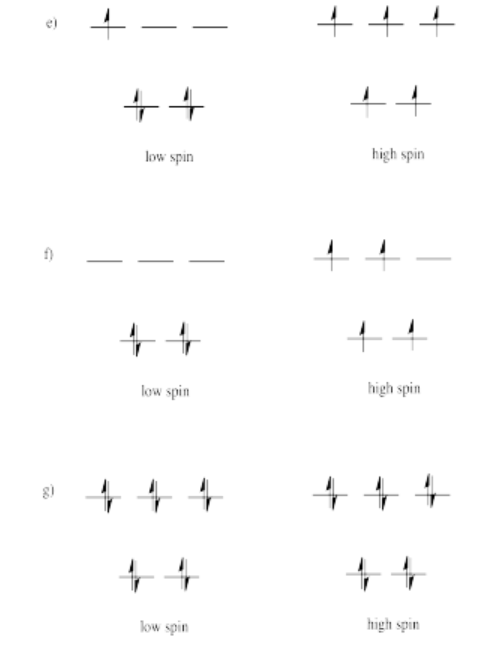
Los orbitales se muestran en orden de energía.
Ejercicio 2.8.7:
a. [Fe (py) 6] 2+ metal 3d, M +2, ligando aceptor pi → espín bajo
b. [Fe (H 2 O) 6] 2+ metal 3d, M +2, ligando donante pi → espín alto
c. [FeBr 6] 3- 3d metal, M +3, ligando donante pi → alto espín
d. [Co (NH 3) 6] 3+ 3d metal, M +3, ligando donante sigma → bajo espín
e. [Cu (NH 3) 6] 2+ metal 3d, M +2, ligando donante sigma → espín bajo
f. [Rh (CO) 6] 3+ 4d metal, M +3 → giro bajo
g. [Cr (CO) 6] 3+ 3d metal, M +3, ligando aceptor pi → bajo espín
f. [PtcL 6] 2- 5d metal, M +4 → bajo giro
Ejercicio 2.8.8:
a. [Zn (NH 3) 4] 2+ metal 3d, d 10, ligando donante sigma → tetraédrico
b. [NiCl 4] 2+ metal 3d, d 8, ligando donante pi → tetraédrico
c. [Ni (CN) 4] 2-3d metal, d 8, ligando aceptor pi → plano cuadrado
d. [Ir (CO) (OH) (PCy 3) 2] 2+ 5d metal, d 8 → plano cuadrado
e. [Ag (dppb) 2] 1+ 4d metal, d 10, ligando donante sigma → tetraédrico
f. [PtcL 2 (NH 3) 2] 5d metal, d 8 → plano cuadrado
g. [PdCl 2 (NH 3) 2] 4d metal, d 8, M +2, ligando donante sigma → plano cuadrado
i. [CoCl 4] 2— 3d metal, d 7, ligando donante sigma → tetraédrico
f. [Rh (PPh 3) 3 Cl] 5d metal, d 8 → plano cuadrado
Ejercicio 2.9.1:
a. Fe +2
d 6 giro bajo
\[SE = [-0.4 (6) + 0.6(0)] \Delta_{o} + 3PE \nonumber\]
\( =[-2.4] \Delta_{o} + 3PE\)
d 6 alto giro
\(SE = [-0.4(4) + 0.6(2)] \Delta_{o} + 1PE\)
\([-.4] \Delta_{o} + 1PE\)
b. Co +2
d 7 bajo giro
\[SE = [-0.4(6) + 0.6(1)] \Delta_{o} + 3PE \nonumber\]
\(= [-1.8] \Delta_{o} + 3PE\)
d 7 alto giro
\[SE = [-0.4(5) + (0.6)2] \Delta_{o} + 2PE \nonumber\]
\(=[-.8] \Delta_{o} + 1PE\)
c. Co +3
d6 así que esto se ve igual que Fe+2
d. Mn +2
d 5 bajo spin
\[SE= [-0.4(5) + 0.6(0)] \Delta_{o} + 2PE \nonumber\]
\([-2.0] \Delta_o} + 2PE\)
d 5 alto giro
\(SE = [-0.4(3) + 0.6(2)] \Delta_{o} + 0PE\)
\(= [0] \Delta_{o}\)
e. Ti +3
d 1 así que no hay posibilidad de giro bajo o alto
Ejercicio 2.9.2:
a) Δ o < PE, por lo que de alto giro.
b) Δ o > PE, por lo que de alto giro.
c) Δ o > PE, por lo que de alto giro.
Ejercicio 2.9.3:
alto giro D 6
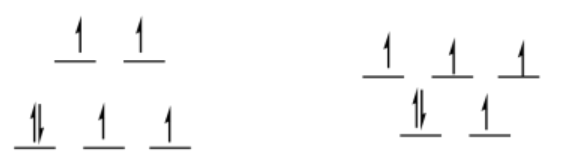
octaédrico
\[SE = [2(0.6) -4(0.4)] \Delta_{o} + PE \nonumber\]
\[SE = -0.4 \Delta_{o} + PE \nonumber\]
tetraédrico
\[SE = [3(0.4) - 3(0.6)] \frac{4}{9} \Delta_{o} + PE \nonumber\]
\[SE = -0.6 \Delta_{o} + PE \nonumber\]
\[\Delta SE = SE_{oh} - SE_{td} = -0.4 \Delta_{o} + PE -(-0.6 \Delta_{o} + PE\) = +0.2 \Delta_{o} \nonumber\]
Esta es una ligera preferencia por el tetraédrico.
bajo giro D 6
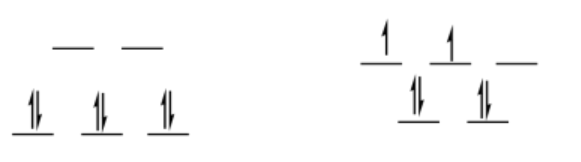
octaédrico
\[SE = [0(0.6) -6(0.4)] \Delta_{o} + 3PE \nonumber\]
\[SE = -2.4\Delta_{o} + 3PE \nonumber\]
tetraédrico
\[SE = [2(0.4) -4(0.6)] \frac{4}{9} \Delta_{o} + 2PE \nonumber\]
\[SE = -1.6 \Delta_{o} + PE \nonumber\]
\[\Delta SE = SE_{oh} -SE_{td} = -2.4 \Delta_{o} + 3PE -(-1.6 \Delta_{o} + 2PE) = -0.8 \Delta_{o} + PE \nonumber\]
Esta es una preferencia por octaédrica, aunque sería compensada por la energía de emparejamiento
Ejercicio 2.9.4:
alto giro D 8
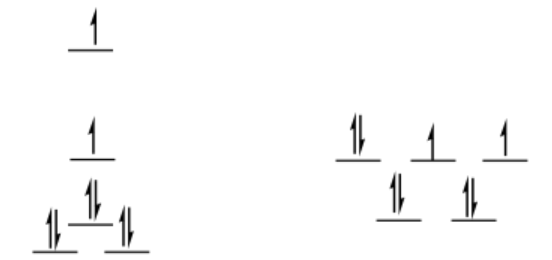
plano cuadrado
\[SE = [1.23 + 0.23 -2(0.43) -4(0.51)]\Delta_{o} + 3PE \nonumber\]
\[SE = -1.44 \Delta_{o} + 3PE \nonumber\]
tetraédrico
\[SE = [4(0.4) -4(0.6)] \frac{4}{9} \Delta_{o} + 3PE \nonumber\]
\[SE = -0.36 \Delta_{o} + 3PE \nonumber\]
\[\Delta SE = SE_{sq} - SE_{td} = -1.44 \Delta_{o} + 3PE -(-0.36 \Delta_{o} + 3PE) = -1.08 \Delta_{o} \nonumber\]
Esta es una preferencia apreciable por el plano cuadrado.
bajo giro D 8
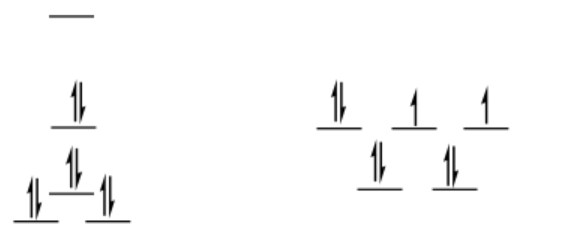
plano cuadrado
\[SE = [0 + 2(0.23) -2 (0.43) -4 (0.51)]\Delta_{o} + 4PE \nonumber\]
\[SE = -2.44 \Delta _{O} + 4PE \nonumber\]
tetraédrico = igual que antes (ls = hs para d 8 tetraédrico)
\[\Delta SE = SE_{sq} - SE_{td} = -2.44 \Delta_{O} + 3PE -(-0.36 \Delta _{O} + 3PE) = -2.08 \Delta_{O} + PE \nonumber\]
Esta es una preferencia aún más apreciable por el plano cuadrado, aunque se compensa con la energía de emparejamiento. La energía de emparejamiento tendría que ser el doble de grande que Δ o para poder compensar completamente el LFSE.
Ejercicio 2.10.1:
Los donantes más débiles incluyen haluros y donantes de oxígeno. Los donantes de átomos de nitrógeno son en su mayoría un poco más fuertes que eso. Los donantes más fuertes incluyen los donantes de carbono, especialmente con enlaces pi.
Ejercicio 2.10.2:
Ejercicio 2.10.3:
La donación de Pi eleva los electrones t 2 g (los electrones d de simetría apropiada para pi se superponen con los ligandos en una geometría octaédrica).
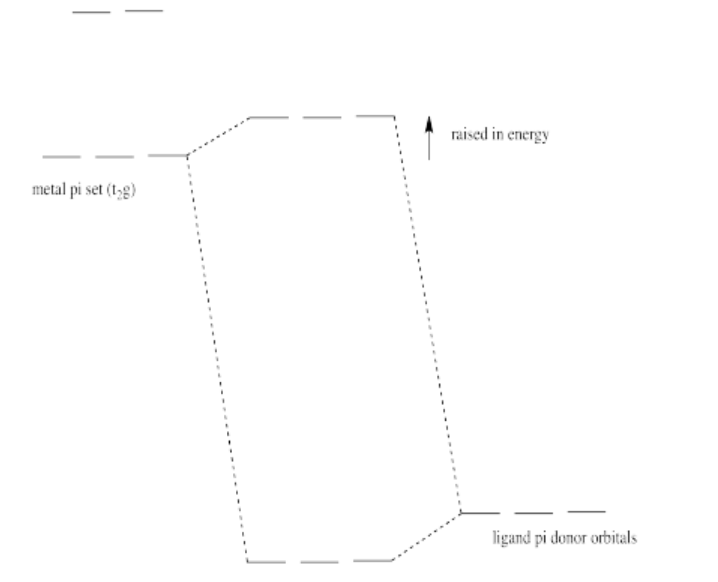
Ejercicio 2.10.6:
Debido a que el cloruro es un ligando más débil que el hidróxido, la división orbital d se hace más pequeña. Una transición d-d implicaría menos energía, por lo que se movería a una longitud de onda más larga (desplazamiento al rojo).
Ejercicio 2.10.7:
a) El ion [Cu (OH 2) 6] 2+ aparece azul-verde, por lo que absorbe un naranja rojizo, alrededor de 650 nm; mientras que el ion [Cu (NH 3) 2 (OH 2) 4] 2+ aparece índigo-violeta, por lo que absorbe amarillo, alrededor de 600 nm.
b) La longitud de onda más corta es mayor energía, según la relación Planck-Einstein: E = h c/λ (en la que h = constante de Planck, c = velocidad de la luz, λ = longitud de onda del fotón). El ion [Cu (NH 3) 2 (OH 2) 4] 2+ absorbe el fotón de mayor energía y longitud de onda más corta.
c) El ion [Cu (NH 3) 2 (OH 2) 4] 2+ tiene la mayor brecha d-d.
d) El amoníaco debe ser un ligando de campo más fuerte que el agua. En términos generales podríamos pensar en eso como resultado de que el amoníaco es solo un donante sigma, mientras que el agua también es un donador pi.
Ejercicio 2.10.8:
a) El ion [Cu (NH 3) 6] 3+ aparece amarillo, por lo que absorbe violeta, alrededor de 400 nm; mientras que el ion [Cu (NH 3) 5 Cl] 2+ aparece rosado, por lo que absorbe verde, alrededor de 550 nm.
b) La longitud de onda más corta es mayor energía, según la relación Planck-Einstein: E = h c/λ (en la que h = constante de Planck, c = velocidad de la luz, λ = longitud de onda del fotón). El ion [Cu (NH 3) 6] 3+ absorbe el fotón de mayor energía y longitud de onda más corta.
c) El ion [Cu (NH 3) 6] 3+ tiene la mayor brecha d-d.
d) El amoníaco debe ser un ligando de campo más fuerte que el cloruro. En términos generales podríamos pensar en eso como resultado de que el amoníaco es solo un donante sigma, mientras que el cloruro también es un donador pi.
Ejercicio 2.10.9:
El compuesto verde absorbe rojo; el compuesto violeta absorbe amarillo; el compuesto amarillo absorbe violeta.
En términos de energía estas absorbancias se pueden clasificar:
(alta energía) fotón violeta > fotón amarillo > fotón rojo (baja energía)
o en términos de brecha d-d:
gran brecha > brecha media > pequeña brecha
En la serie espectroquímica, esperaríamos que el orden de los ligandos correspondientes fuera:
- CN > H 2 O > F -
El compuesto ciano absorbe violeta y aparece amarillo; el compuesto aquo absorbe amarillo y aparece violeta; el compuesto fluoro absorbe rojo y aparece verde.
Ejercicio 2.10.10:
a) El ion [V (OH 2) 6] 3+ aparece amarillo, por lo que absorbe violeta, alrededor de 400 nm; mientras que el ion [V (OH 2) 6] 2+ aparece rosado, por lo que absorbe el verde, alrededor de 550 nm.
b) La longitud de onda más corta es mayor energía, según la relación Planck-Einstein: E = h c/λ (en la que h = constante de Planck, c = velocidad de la luz, λ = longitud de onda del fotón). El ion [V (OH 2) 6] 3+ absorbe la longitud de onda más corta, fotón de mayor energía.
c) El ion [V (OH 2) 6] 3+ tiene la mayor brecha d-d.
d) Un ion contiene V 3+, mientras que el otro ion contiene V 2+. A medida que aumenta la carga en un ion, los electrones se contraen hacia el núcleo. Sin embargo, los electrones de baja altitud, que están más cerca del núcleo para empezar, son atraídos incluso más que los electrones de altura. Así, a medida que aumenta la carga en el ion, aumenta la división d-d.
Ejercicio 2.10.11:
a) [Co (NH 3) 6] +3
El metal es +3 lo que sugiere una gran Δ 0
Los ligandos son donantes sigma, por lo que los ligandos de campo medio
La energía de división es grande, por lo tanto, bajo giro.
b) [Fe (CN) 6] -4
El metal es la primera fila, +2 sugiriendo intermedio Δ 0
Los ligandos son aceptores pi, así que ligandos de campo fuertes
La energía de división es grande, por lo tanto, bajo giro.
c) [CoF 6] -4
El metal es la primera fila, +2 lo que sugiere una gran Δ 0
Los ligandos son donantes pi, por lo que ligandos de campo débiles
La energía de división es pequeña, por lo tanto, alto giro.
d) [Rh (CN) 6] -3
El metal es 2da fila (4d) y +3 lo que sugiere una gran Δ 0
Los ligandos son aceptores pi, así que ligandos de campo fuertes
La energía de división es grande, por lo tanto, bajo giro.
e) [V (OH 2) 6] +3
El complejo es d 2, por lo que solo hay un posible estado de giro.
f) [Fe (py) 6] +2
El metal es la primera fila, +2 sugiriendo intermedio Δ 0
Los ligandos son aceptores pi, así que ligandos de campo fuertes
La energía de división es grande, por lo tanto, bajo giro.
g) [MnCl 6] -4
El metal es la primera fila, +2 sugiriendo intermedio Δ 0
Los ligandos son donantes pi, por lo que ligandos de campo débiles
La energía de división es grande, por lo tanto, alto giro.
h) [Ru (NH 3) 6] +2
El metal es 2da fila (4d) y +2 lo que sugiere una gran Δ 0
Los ligandos son donantes sigma, por lo que los ligandos de campo medio
La energía de división es grande, por lo tanto, bajo giro.
Ejercicio 2.11.1:
a) Los iones en LiF son ambos más pequeños que en KBr, por lo que la fuerza de atracción entre los iones en LiF es mayor debido a la menor separación entre las cargas.
b) El calcio tiene una carga 2+ en CaCl 2, mientras que el potasio solo tiene una carga +, por lo que los iones cloruro son más fuertemente atraídos por el calcio que por el potasio.
Problema CC11.3.
a) lábil (electrones en mayor energía d conjunto orbital)
b) no lábil (todos los electrones en orbitales d de menor energía)
c) no lábil (todos los electrones en orbitales d de menor energía)
d) lábil (electrones en mayor energía d conjunto orbital)
e) lábil (electrones en mayor energía d conjunto orbital)
Ejercicio 2.12.1:
a) sí; ls d 7 es por ejemplo 1, por lo que un nivel tiene un electrón y el otro no tiene ninguno - disminución neta de energía tras la distorsión
b) no; d 8 es por ejemplo 2, por lo que ambos niveles tienen un electrón, sin cambio neto en la energía tras la distorsión
Ejercicio 2.12.2:
a) Co 2+ sí; d 7 entonces e g 1
b) Ag 2+ sí; d 9 entonces e g 3
c) Ni 2+ no; d 8 entonces e g 2
d) Mn 2+ no si hs; d 5 entonces e g 2. Sin embargo, si se tratara de espín bajo (poco probable con un metal de primera fila en un estado de oxidación moderadamente bajo y donadores π), entonces habría degeneración y distorsión.
e) Ag + no; d 10 así que e g 4
Ejercicio 2.12.3:
a) [V (CN) 6] 3- sí d 2 t 2g 2 b) [Cr (CN) 6] 3- no d 3 t 2g 3
c) [Mn (CN) 6] 3- sí d 4 t 2g 4 d) [Fe (CN) 6] 3- sí d 5 t 2g 5
e) [Cr (CN) 6] 4- sí d 4 t 2g 4 f) [Mn (CN) 6] 4- sí d 5 t 2g 5
g) [Fe (CN) 6] 4- no d 6 t 2g 6

