2.14: Soluciones a problemas seleccionados
- Page ID
- 79549
Ejercicio 2.1.1:
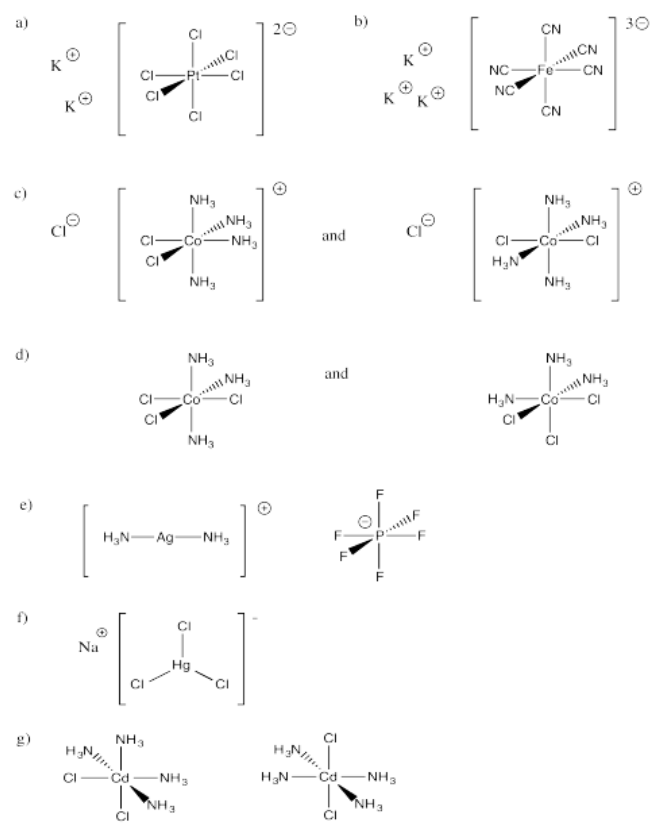
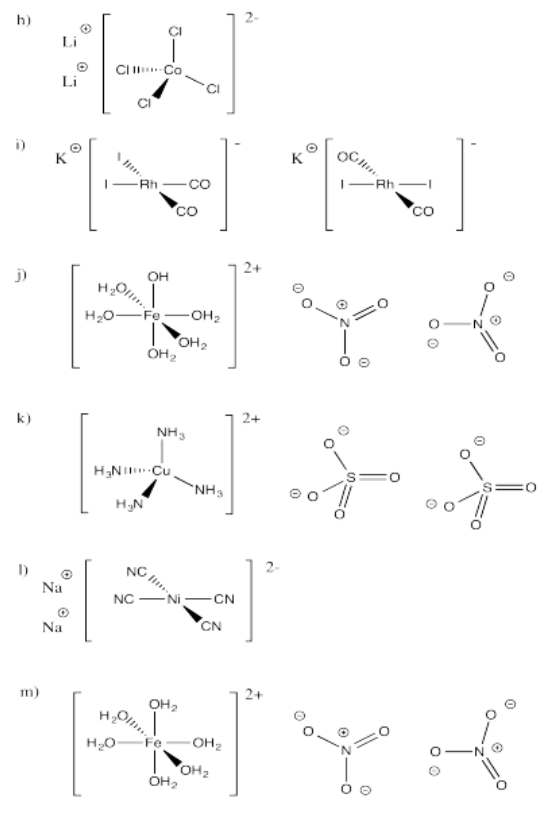
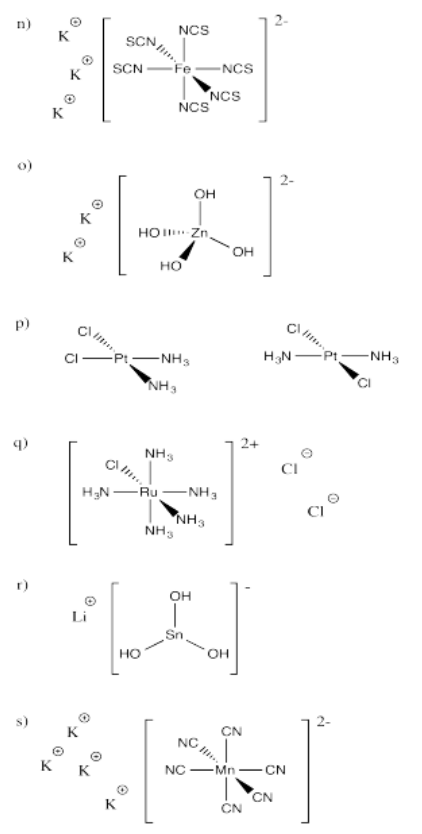
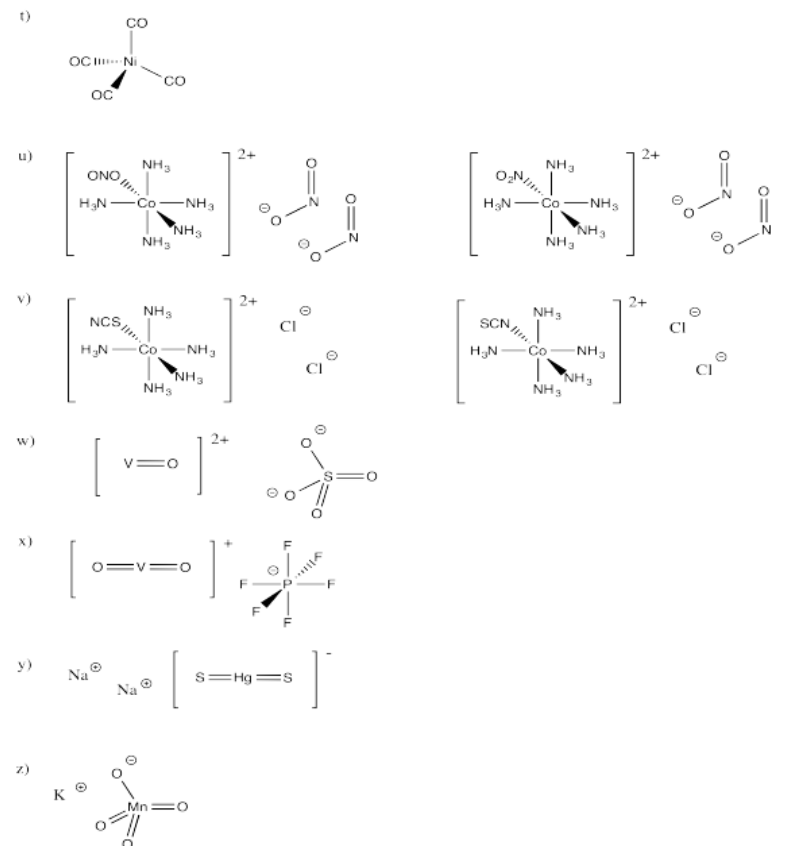
Ejercicio 2.2.1:
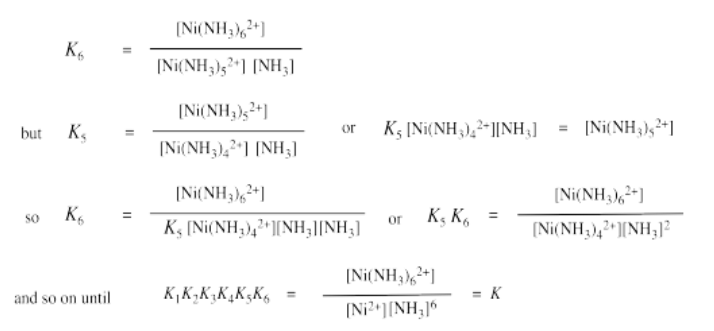
Ejercicio 2.2.2:
a)\(K = K_{1} \times K_{2} \times K_{3} \times K_{4} \times K_{5} \times K_{6}\)
=\(470 \times 130 \times 41 \times 12 \times 4.2 \times 0.81\)
=\(1.03 \times 10^{8}\)
b) A medida que el níquel se une a los ligandos de amoníaco, se vuelve más saturado electrónicamente. Eso significa que se vuelve menos ácido Lewis. No tiene una atracción tan fuerte por ligandos adicionales.
Ejercicio 2.2.3:
- Este es un ion Zn 2+ que se une a ligandos NH 3 o CN -. El catión zinc está más fuertemente estabilizado a los ligandos de cianuro aniónicos que al ligando de amoníaco neutro, por lo que la constante de unión con cianuro es mayor que con amoníaco.
- Ambos casos involucran iones cianuro. En un caso, el CN - se une a Fe 2+, mientras que el otro caso involucra Fe 3+. El ligando es más atraído por el ion más cargado, por lo que la constante de unión es mayor.
Ejercicio 2.3.4:
a) Recuento de valencia metálica: 9
Metal con carga: 6
Donado por ligandos: 6 x 2 = 12
Total: 18
b) Recuento de valencia metálica: 8
Metal con carga: 5
Donado por ligandos: 6 x 2 = 12
Totales: 17
c) Recuento de valencia metálica: 9
Metal con carga: 7
Donado por ligandos: 6 x 2 = 12
Totales: 19
d) Recuento de valencia metálica: 7
Metal con carga: 0
Donado por ligandos: 4 x 4 = 16
Totales: 16
e) Recuento de valencia metálica: 8
Metal con carga: 8
Donado por ligandos: 5 x 2 = 10
Total: 18
f) Recuento de valencia metálica: 10
Metal con carga: 6
Donado por ligandos: 6 x 2 = 12
Total: 18
g) Recuento de valencia metálica: 6
Metal con carga: 6
Donado por ligandos: 6 x 2 = 12
Total: 18
h) Recuento de valencia metálica: 6
Metal con carga: 0
Donado por ligandos: 4 x 4 = 16
Totales: 16
i) Recuento de valencia metálica: 9
Metal con carga: 8
Donado por ligandos: 4 x 2 = 8
Totales: 16
j) Recuento de valencia metálica: 8
Metal con carga: 4
Donado por ligandos: 3 x 4 = 12
Totales: 16
k) Recuento de valencia metálica: 9
Metal con carga: 7
Donado por ligandos: 4 x 2 = 8
Total: 15
Ejercicio 2.3.5:
a) 6 b) 8 c) 5 d) 5 e) 10 f) 1 g) 10 h) 12 i) 2 j) 9 k) 4
a) Recuento de valencia metálica: 5
Metal con carga: 0
Donado por ligandos: 5 x 2 = 10
Totales: 10
b) Recuento de valencia metálica: 8
Metal con carga: 5
Donado por ligandos: 3 x 2 = 6
Totales: 11
c) Recuento de valencia metálica: 6
Metal con carga: 0
Donado por ligandos: 6 x 2 = 12
Totales: 12
Ejercicio 2.3.8:
- PF 3 (104 contra 87 0)
- PMe 3 (118 contra 87 0)
- P t Bu 3 (182 contra 118 0)
- P t Bu 3 (182 contra 145 0)
Ejercicio 2.4.1:
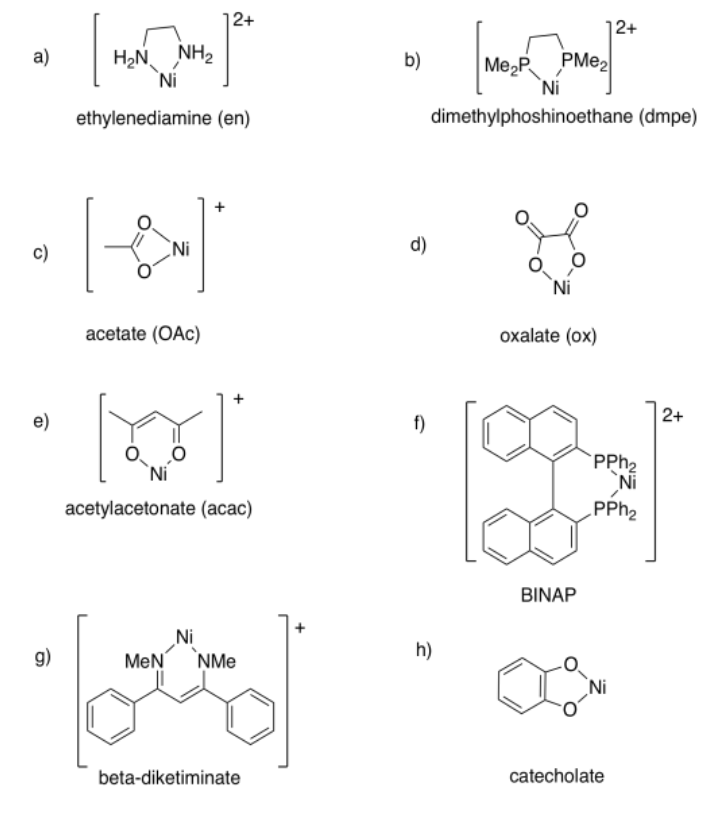
Ejercicio 2.4.2:
- tridentado o κ 3; ligando = 0; metal = 1+
- bidentado o κ 2; ligando = 1-; metal = 0
- bidentado o κ 2; ligando = 0; metal = 2+
- tetradentado o κ 4; ligando = 2-; metal = 2+
- tridentado o κ 3; ligando = 0; metal = 1+
- bidentado o κ 2; ligando = 0; metal = 1+
Ejercicio 2.4.3:
- monodentado o κ 1; máximo bidentado o κ 2; ligando = 0; metal = 2+
- bidentado o κ 2; máximo tridentado o κ 3; ligando = 1-; metal = 1+
- bidentado o κ 2; tridentado máximo o κ 3; ligando = 0; metal = 1+
- bidentado o κ 2; tetradentado máximo o κ 4; ligando = 0; metal = 2+
- tridentado o κ 3; tetradentado máximo o κ 4; ligando = 1-; metal = 2+
- tridentado o κ 3; tetradentado máximo o κ 4; ligando = 2-; metal = 2+
Ejercicio 2.4.4:
Ejercicio 2.4.5:
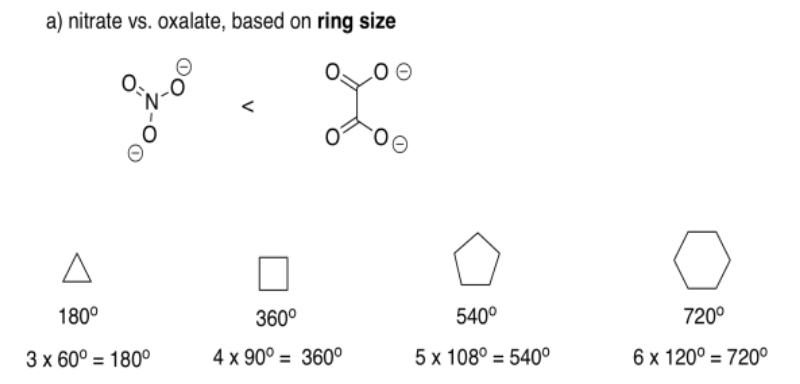
El total de los ángulos interiores de un poliedro regular viene dado por (n -2) 180 o, en el que n es el número de lados en el poliedro. Suponiendo que el anillo formado por el ligando bidentado y el metal es un poliedro regular (no lo será, pero estamos simplificando), entonces el nitrato da un triángulo con ángulos de 60°, incluyendo un ángulo de mordida de 60° O-M-O. El oxalato da un cuadrado con un ángulo de mordida mayor de 90°.
En realidad, el ángulo de mordida para el nitrato varía con el complejo que se forma, pero suele estar en algún lugar alrededor de los sesenta grados, mientras que el oxalato suele dar en algún lugar alrededor de ochenta y cinco grados (ver, por ejemplo, Alvarez, Chem. Rev. 2015, 115, 13447-13483). El tamaño de anillo más pequeño da un ángulo de mordida más pequeño.
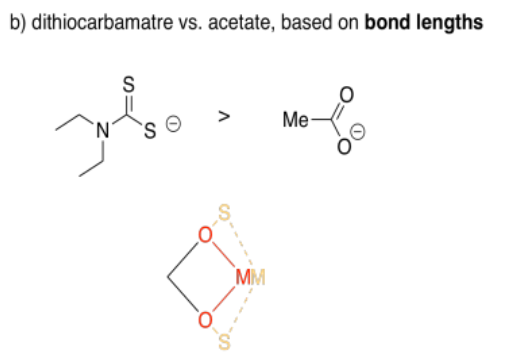
El azufre es más grande que el oxígeno, por lo que sus enlaces serán un poco más largos. Como resultado, puedes imaginar esos dos lados de la plaza siendo un poco más largos con azufre que con oxígeno. Desde la perspectiva del metal, la brecha entre los dos átomos donantes se ensancha un poco.
El acetato forma ángulos de mordida de alrededor de sesenta grados, pero el ditiocarbamato forma ángulos de mordida más grandes de setenta o setenta y cinco grados.
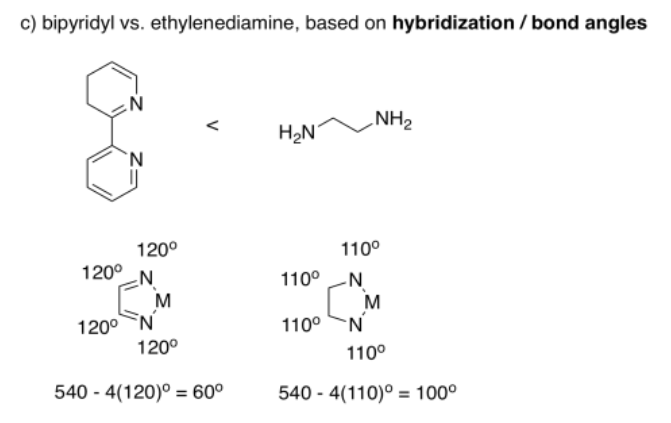
Hay muchas diferencias entre estos dos ligandos, pero si simplificamos y solo consideramos el ángulo de enlace, podemos hacer una predicción. Si los átomos en bipridilo pueden considerarse sp 2 hibridados, entonces forman ángulos de enlace de 120°. Los átomos en etilendiamina podrían considerarse sp 3 hibridados, formando ángulos de aproximadamente 110°. El ángulo N-M-N todavía tiene que completar la forma del pentágono regular, por lo que si todos los demás ángulos son más grandes en el complejo bipiridilo, esperaríamos que el ángulo de mordida sea más pequeño.
Realmente, los ángulos de mordida son mucho más cercanos de lo que sugiere esta estimación aproximada. El bipiridilo forma ángulos de mordida promedio de alrededor de ochenta grados, mientras que la etilendiamina forma ángulos de mordida promedio de alrededor de ochenta y cinco grados. Sin embargo, ten en cuenta que esos son solo promedios. Estos dos valores son lo suficientemente cercanos como para que sus rangos se superpongan; muchos complejos de bipiridilo tendrían ángulos de mordida más pequeños que los complejos de etilendiamina.
Ejercicio 2.4.6:
Ejercicio 2.5.1:
Ejercicio 2.5.2:
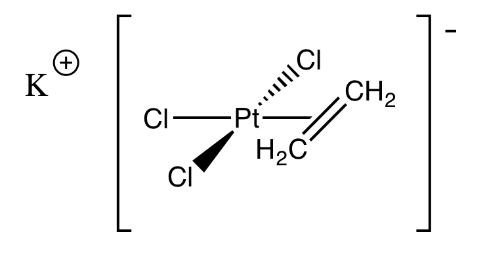
Ejercicio 2.5.3:
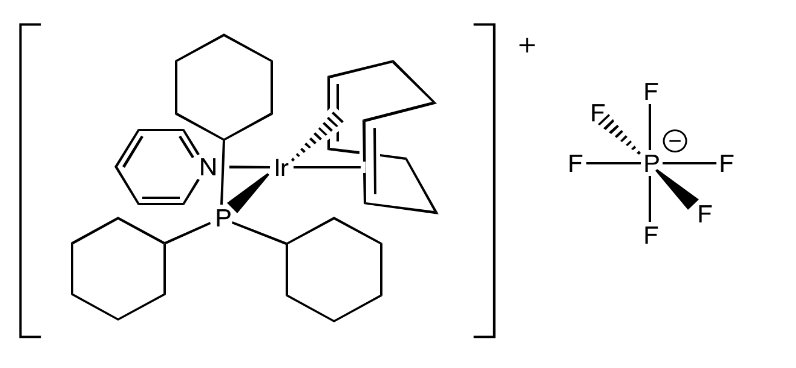
Ejercicio 2.5.4:
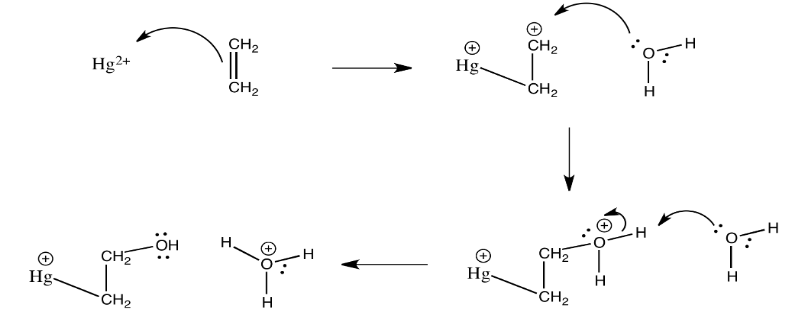
Ejercicio 2.5.5:
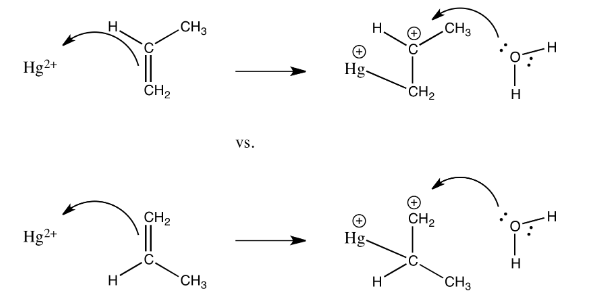
Ejercicio 2.5.6:
Zr (IV) o Zr 4+ no tiene valencia d electrones. Eso significa que, aunque un alqueno ciertamente podría donar su enlace pi al átomo de circonio, el circonio no tiene electrones con los que pueda estabilizar el complejo alqueno a través de la “donación inversa” al orbital antienlace pi en el alqueno.
Sin embargo, los metales d 0 como Zr (IV) y Ti (IV) pueden ser utilizados como catalizadores de polimerización de alquenos para hacer plásticos comunes como HDPE, LDPE y polipropileno. Eso significa que, aunque un complejo alqueno no se observa directamente con estos iones metálicos, estos metales evidentemente pueden unir alquenos brevemente y hacer que reaccionen con otros alquenos para formar cadenas largas. Aun así, la mayoría de los catalizadores industriales de polimerización de olefinas utilizan Ti (III).
Ejercicio 2.5.8:
Utilizaremos (a), la constante de unión entre Ag (I) y etileno o eteno (CH 2 =CH 2), como nuestro valor basal. Otras constantes se compararán con esta para buscar una tendencia.
En (b), la constante de unión es mucho menor, por lo que el ion plata se une a cis -2-hexeno mucho menos fuertemente que al eteno. Este es solo otro alqueno, como el eteno, pero en lugar de tener solo átomos de hidrógeno unidos a la unidad C=C, el cis-2-hexeno tiene algunas otras cosas. Tal vez esta otra cosa cause algún problema para la unión de alquenos. La diferencia obvia entre los átomos de hidrógeno y esta otra cosa es que esta otra cosa es más grande. Tal vez el complejo se llena demasiado cuando el cis-2-hexeno se une al ion plata.
Muy a menudo cuando vemos iones metálicos en el papel, no estamos tratando con iones metálicos desnudos en la realidad. El ion a menudo tiene otros ligandos ya unidos a él al principio, como las moléculas de agua, y lo que a veces estamos viendo es el reemplazo de un viejo ligando por un nuevo ligando. Otros ligandos unidos a la plata podrían empeorar aún más los problemas de hacinamiento.
También hay una explicación alternativa. Si compara dos alquenos que difieren sólo en el número de hidrógenos adheridos al doble enlace, como 1-buteno, CH 2 =CHCH 2 CH 3, y 2-buteno, CH 3 CH=CHCH 3, invariablemente encuentras que el alqueno con menos hidrógenos unidos al doble enlace (y más otras cosas) es más estable. Los “alquenos terminales”, con dobles enlaces en los extremos de la cadena, son siempre menos estables que los “alquenos internos”, con dobles enlaces en algún lugar a lo largo de la mitad de la cadena. Esta diferencia se puede explicar mirando algunos cálculos mecánicos cuánticos, pero no vamos a hacer eso ahora mismo.
El punto es que la diferencia en esta reacción podría ser causada, no por los complejos alquenos, sino por los propios alquenos, del otro lado del perfil de reacción. Es importante recordar que las constantes de equilibrio siempre comparan dos lados de una reacción. El eteno, que tiene menos sustituyentes en el doble enlace que el cis-2-hexeno (“sustituyentes” es una palabra de cuatro sílabas para “otras cosas”), puede ser simplemente menos estable y más reactivo.
¿Alguna de estas ideas se sostiene en los otros ejemplos?
En (c), el trans -2-hexeno se une incluso con menos fuerza que el cis-2-hexeno. Podríamos argumentar que en un complejo cis-2-hexeno, los sustituyentes, que están en el mismo lado del doble enlace, podrían mantenerse alejados de otros ligandos en el metal que pueden exacerbar los problemas de hacinamiento. Eso sería más difícil de hacer con el trans-2-hexeno, ya que un sustituyente está a cada lado del doble enlace. Puede ser posible alejar un sustituyente del hacinamiento, pero probablemente no ambos.
Una vez más, aquí también se sostiene la explicación alternativa. cis -2-hexeno es menos estable que el trans -2-hexeno, debido a que los sustituyentes en el doble enlace se agrupan entre sí en cis -2-hexeno, pero se mantienen alejados entre sí en trans -2-hexeno. Entonces tal vez el cis -2-hexeno se une más fácilmente al ion plata porque es más reactivo.
Ejercicio 2.6.1:
- Aquí hay dos dobles enlaces, y están conjugados: CH 2 =CH-CH=CH 2. El doble enlace conjugado permitiría que el ligando se uniera a η 4.
- Aquí hay dos dobles enlaces, pero no están conjugados: CH 2 =CH-CH 2 -CH=CH 2. Cada doble enlace se uniría a η 2, y el ligando sería capaz de unirse de manera bidentada, pero como los dobles enlaces no están conjugados y se unen todos en una fila, no se describiría la unión como η 4. Lo más comúnmente sería descrito como η 2, η 2; eso simplemente significa que cada doble enlace es un η 2 -donante, y hay dos de ellos. También podría considerarse donante de κ 2 por su denticidad.
- Este es otro caso no conjugado: CH 2 =CH-CH 2 -CH 2 -CH=CH 2. En términos de hapticidad, podría describirse como η 2, η 2.
- Aquí hay tres dobles enlaces, y están conjugados: CH 2 =CH-CH=CH-CH=CH 2. El doble enlace conjugado permitiría que el ligando se uniera a η 6.
Ejercicio 2.6.2:
- El ligando está unido η 5; dona 6 electrones, de dos dobles enlaces y un par solitario; el ligando tiene una carga de -1.
- El ligando está unido η 4; dona 4 electrones, a partir de dos dobles enlaces; el ligando no tiene carga.
- El ligando está unido η 7; dona 8 electrones, de tres dobles enlaces y un par solitario; el ligando tiene una carga de -1.
- El ligando está unido η 6; dona 6 electrones, a partir de tres dobles enlaces; el ligando no tiene carga.
Ejercicio 2.6.3
- El ligando está unido η 1; dona un par solitario; sin embargo, podría donar un enlace pi adicional y luego uniría η 3.
- El ligando está unido η 2; dona un enlace pi; sin embargo, podría donar dos enlaces pi más y luego uniría η 6.
- El ligando está unido η 4; dona dos enlaces pi; sin embargo, podría donar un enlace pi más y luego uniría η 6.
- El ligando está unido η 3; dona un par solitario y un enlace pi; sin embargo, podría donar un enlace pi adicional y luego uniría η 5.
- El ligando está unido η 4; dona dos enlaces pi; sin embargo, podría donar un enlace pi más y luego uniría η 6.
- El ligando está unido η 2; dona un enlace pi; sin embargo, podría donar un enlace pi más y luego uniría η 4.
Ejercicio 2.6.4:
- El anión resultante tiene estabilidad aromática. Es cíclico, totalmente conjugado, plano y tiene un número impar de pares de electrones.
- El anión Cp podría unirse a un metal a través de solo un par o a través de dos pares, pero en la mayoría de los casos se unirá a través de tres pares de electrones.
d) Recuento de valencia en metal: 8
Cuenta con metal, corrigiendo para +2 carga: 6
Donado de ligandos: 2 x 6 = 12
Total: 18
Ejercicio 2.6.5:
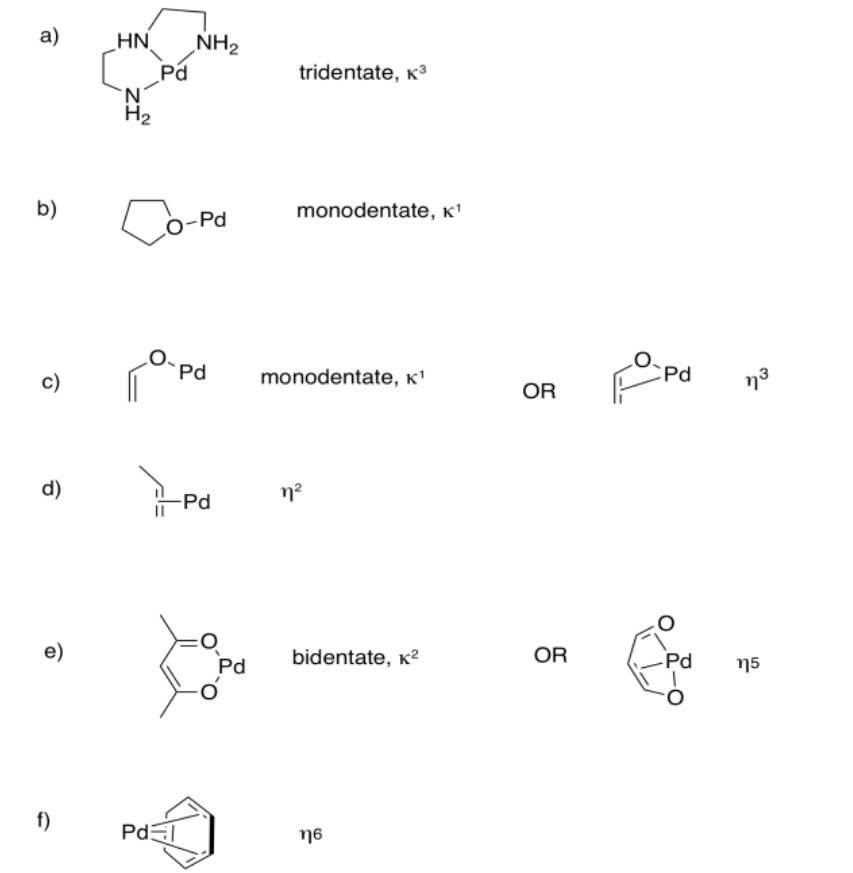
Ejercicio 2.6.6:
Este problema se ocupa del “ángulo de mordida” del ligando. Recuerde, una cadena de átomos se vuelve más flexible cuanto más se alarga, debido a la posibilidad de rotación alrededor de cada enlace a lo largo de la cadena. A medida que los dos dobles enlaces se separan entre sí (uno se separa en (a), dos enlaces separados en (b) y tres enlaces separados en (c)), la cadena puede “abrirse” y unirse con una superposición más óptima con el metal.

