3.2: Nucleófilos Semi-Aniónicos
- Page ID
- 79391
Algunos nucleófilos se agregan a los carbonilos en forma de sales, como el cianuro de sodio. En una sal, hay un anión y un catión. El anión puede actuar como nucleófilo, donando un par solitario al carbonilo. El catión es solo un contraión; está ahí para equilibrar la carga pero no suele desempeñar un papel activo.
Algunos aniones son demasiado inestables y reactivos para ser utilizados como sales. Esto es especialmente cierto con una serie de nucleófilos de carbono. Los enlaces C-H no suelen ser lo suficientemente ácidos como para desprotonar con una base fuerte. Eso hace que sea difícil hacer una sal simple que contenga tales nucleófilos. Hay excepciones, como acetiluro o protones alquinilo como CH 3 CC H. En ese caso, el anión resultante es relativamente estable debido a que el par solitario se encuentra en un orbital de menor energía con más carácter s, por lo que se sujeta más fuertemente al núcleo.
Los aniones de carbono menos estables pueden estabilizarse a través de un enlace covalente. Si el carbono está unido covalentemente a un átomo menos electronegativo, el carbono tiene una carga parcialmente negativa. Todavía puede actuar como si fuera un anión. Sin embargo, el enlace covalente estabiliza al aspirante a “par solitario”. Compuestos como este pueden considerarse “semianiónicos”. Frecuentemente, se les describe como compuestos covalentes polares, aunque ese es realmente un término mucho más general.
Estos enlaces covalentes polares se pueden encontrar cada vez que un átomo de carbono se une a un metal. Recuerde, los metales son los aroms en las cajas de colores en la tabla periódica a continuación.
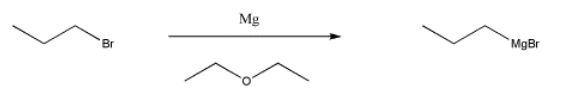
Una de las clases más comunes de este tipo de compuestos es la familia de haluros de organomagnesio o reactivos de Grignard (reactivos Green-yard). Victor Grignard fue galardonado con el Premio Nobel de Química por su desarrollo de estos reactivos. Estos compuestos se elaboran haciendo reaccionar un haluro de alquilo (como cloropropano, CH 3 CH 2 CH 2 Cl, o bromopropano, CH 3 CH 2 CH 2 Br) con magnesio metálico. Con bromopropano, el metal se somete a una inserción en el enlace C-Br, formando CH 3 CH 2 CH 2 MgBr. (No necesitas preocuparte por cómo sucede esto). Debido a que el magnesio es menos electronegativo que el carbono, el enlace C-Mg actúa como si fuera un par solitario sobre el carbono y el magnesio actúa como si fuera un catión.
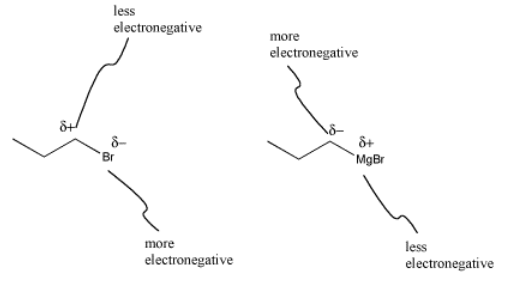
Lo que llama la atención de la formación de Grignard es que la polaridad se invierte en esta reacción. En el haluro de alquilo, el carbono unido al halógeno tiene una carga parcialmente positiva, debido a que el carbono está más a la izquierda que los halógenos en la tabla periódica. Después de la inserción de magnesio, este mismo carbono tiene una carga negativa parcial, porque el carbono está más a la derecha en la tabla periódica que el magnesio. Este tipo de inversión en la reactividad a veces se llama “química umpolung”.
En el extremo, podríamos pensar en el bromuro de propilmagnesio como un anión propilo con un contraión de magnesio. Esa imagen realmente no es muy precisa; realmente hay un enlace covalente entre el carbono y el magnesio, que es lo que hace que el compuesto sea más estable que si fuera puramente iónico. Sin embargo, pensarlo como un anión propilo podría ayudarte a entender su papel como nucleófilo.
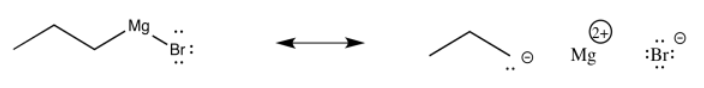
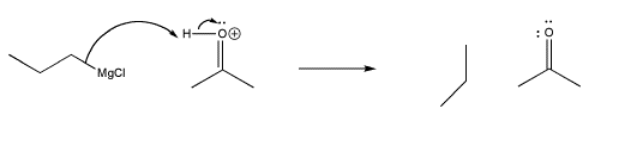
El cloruro de propilmagnesio y otros reactivos de Grignard pueden entregar nucleófilos de alquilo a los carbonilos. Al igual que con los nucleófilos aniónicos simples, resulta un ion alcóxido.
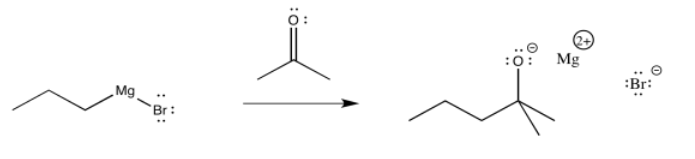
A continuación se muestra el mecanismo relativamente simple. El enlace nucleofílico dona al carbono del carbonilo, rompiendo el enlace π, liberando un par de electrones al átomo de oxígeno electronegativo. Alternativamente, aún podrías dibujar el bromo unido a un Mg+ en este punto.
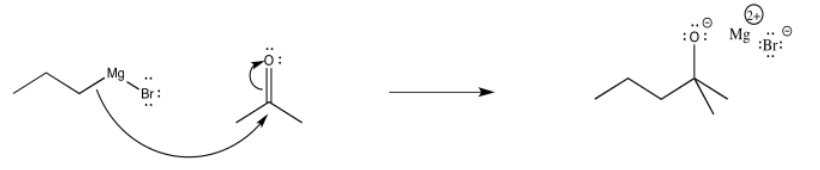
Por supuesto, el tratamiento posterior del alcóxido con ácido proporciona un protón, dando como resultado un alcohol. Podemos ver las dos reacciones consecutivas en el siguiente mecanismo.
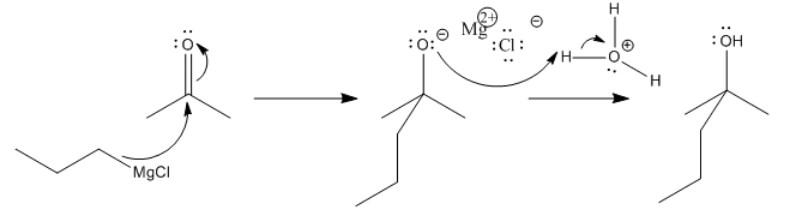
En ese primer paso, no hay aparente pareja solitaria involucrada. En cambio, el enlace de carbono de magnesio polar se comporta igual que si se tratara de un par solitario sobre carbono.
Recuerden, el orden de estos dos pasos es muy importante. Agregar el ácido antes que el reactivo de Grignard no funcionaría, porque el reactivo de Grignard se protonaría en el carbono. Aunque el enlace Mg-C es covalente, sigue siendo lo suficientemente polar para que el carbono pueda actuar como nucleófilo o como base. Una vez que el propilmagnesio se ha protonado, forma propano, que no es probable que actúe como nucleófilo.
Los Grignards pueden tener una variedad de estructuras, pero casi siempre son hidrocarburos, sin otros grupos funcionales en la estructura. Otros grupos funcionales son frecuentemente incompatibles con el enlace reactivo metal-carbono. Lo mismo ocurre con los compuestos de alquillitio estrechamente relacionados, como el metillitio, CH 3 Li. Aparte de eso, los Grignards y los alquillitios pueden estar saturados (conteniendo solo sp 3 carbonos) o pueden contener dobles enlaces.
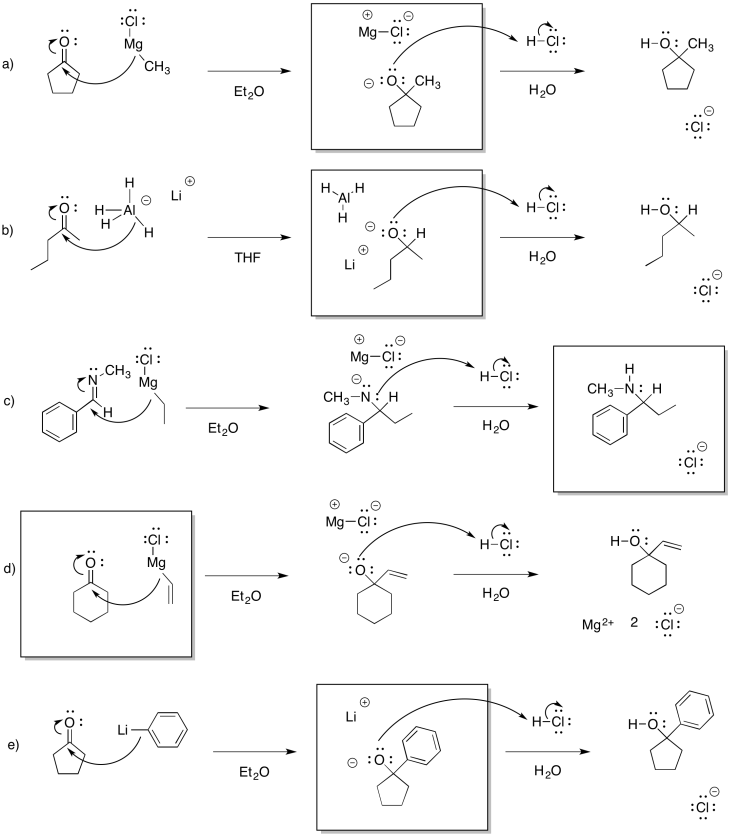
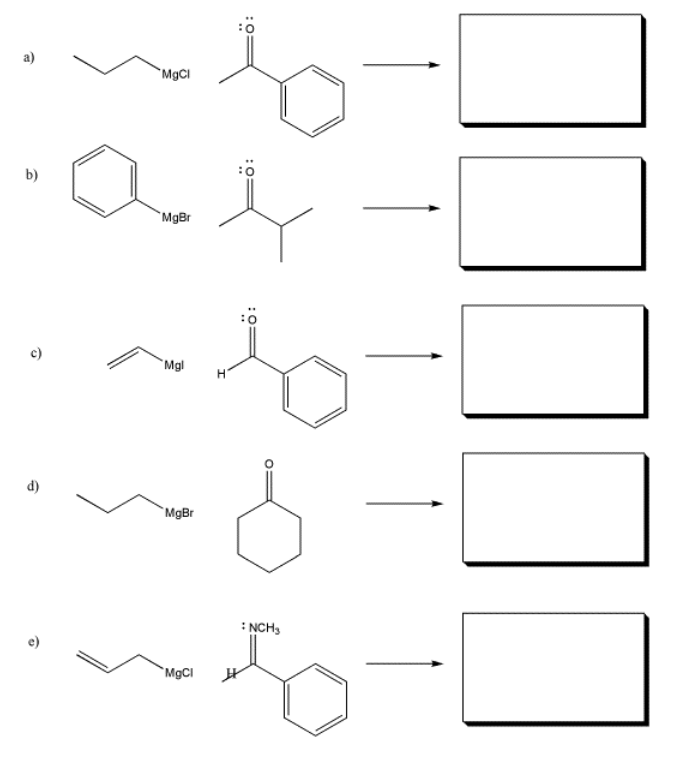
Ejercicio\(\PageIndex{1}\)
Mostrar los productos de las siguientes reacciones. Asumir el tratamiento con ácido acuoso después de cada reacción.
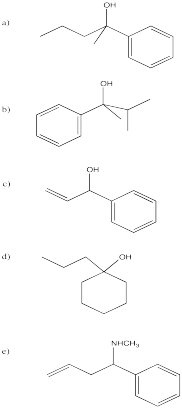
- Contestar
-
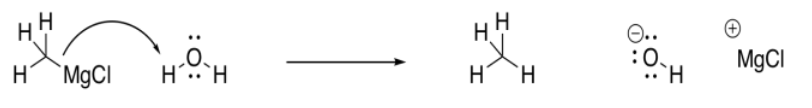
Los reactivos Grignard son muy delicados. Los disolventes deben elegirse con mucho cuidado para las reacciones de Grignard. Los reactivos Grignard son lo suficientemente básicos como para no tolerar solventes próticos. Los solventes próticos son solventes que son capaces de formar enlaces de hidrógeno. A pesar de que no parecen muy ácidos, todavía pueden ceder un protón a una base lo suficientemente fuerte. Un reactivo de Grignard es una base lo suficientemente fuerte como para tomar ese protón de un enlace O-H.
Ejercicio\(\PageIndex{2}\)
Mostrar por qué los reactivos de Grignard no se pueden usar con etanol como disolvente.
- Contestar
-
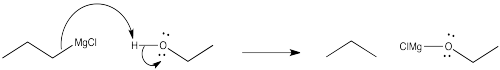
De hecho, los reactivos de Grignard son aún más quisquillosos que eso. No solo no se llevan bien con protones ácidos o incluso semiácidos, sino que tienden a necesitar disolventes coordinantes para ayudar a soportar el átomo de magnesio y mantener estable el complejo. Los solventes más comunes para este uso son (dietil) éter y tetrahidrofurano (THF). Cuando dos éteres se unen al magnesio, el magnesio tiene un octeto completo. Debido a que la coordinación del magnesio por estos solventes débilmente donadores es crucial, los reactivos de Grignard generalmente no se pueden aislar. En cambio, se venden y utilizan como soluciones en disolventes etéreos.
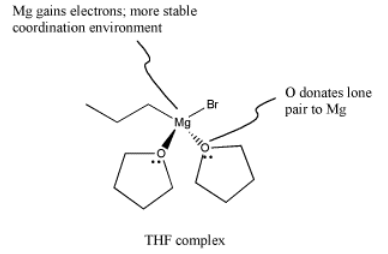
El complejo THF, al igual que otros complejos de coordinación, se puede dibujar de varias maneras adicionales. El dibujo anterior es probablemente el tipo más común, pero a continuación se muestran un par de dibujos más. En el dibujo de la izquierda, estamos distinguiendo entre dos tipos de enlaces ligeramente diferentes sobre el magnesio. Un enlace, que ya hemos discutido, es un enlace covalente polar. Se muestra con una línea recta. No obstante, sabemos que el carbono se comporta como si fuera un anión con un par solitario. El otro es un vínculo dativo de un donante neutro. El oxígeno es simplemente compartir uno de sus pares solitarios con el magnesio. Si el oxígeno recuperara su par solitario, sería un átomo neutro. Si el bromo se dejara, sería un anión. Una convención ampliamente adoptada en química de coordinación muestra enlaces de donantes aniónicos a metales como líneas, mientras que los enlaces de donantes neutros a metales se muestran como flechas cortas y rectas. Por otro lado, si sabemos algo de cargo formal, miraríamos la imagen de arriba y la corregiríamos, dando la versión de abajo, derecha.
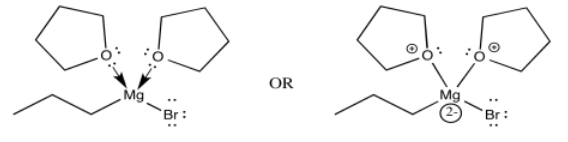
Cada dibujo tiene sus méritos. El primero es probablemente el más simple; en este caso, incluso podríamos permitirnos el lujo de dibujar en una cuña y un guión para mostrar estereoquímica sin complicarnos demasiado. El segundo transmite rápidamente la idea de las cargas sobre los ligandos y el metal en el complejo de coordinación; hay dos ligandos neutros y dos aniónicos, y por lo tanto el metal tiene una carga +2. El tercero nos dice algo sobre cómo se ha transferido el cargo en vinculación. Debido a que el oxígeno ha compartido sus electrones con el magnesio, el magnesio obtiene un poco más de densidad de electrones y el oxígeno baja un poco. A pesar de ser notablemente electronegativo, el oxígeno frecuentemente dona a otros átomos si es necesario. (Un acto generoso puede no siempre ser bueno para el donante, pero con frecuencia es bueno para el universo).
Finalmente, será útil saber que los complejos de coordinación (o aductos ácido-base de Lewis) frecuentemente se forman reversiblemente. En realidad hay un equilibrio en el que los donantes entran y salen del metal, sobre todo si los donantes son bastante estables por sí mismos.
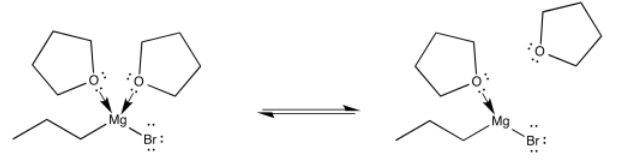
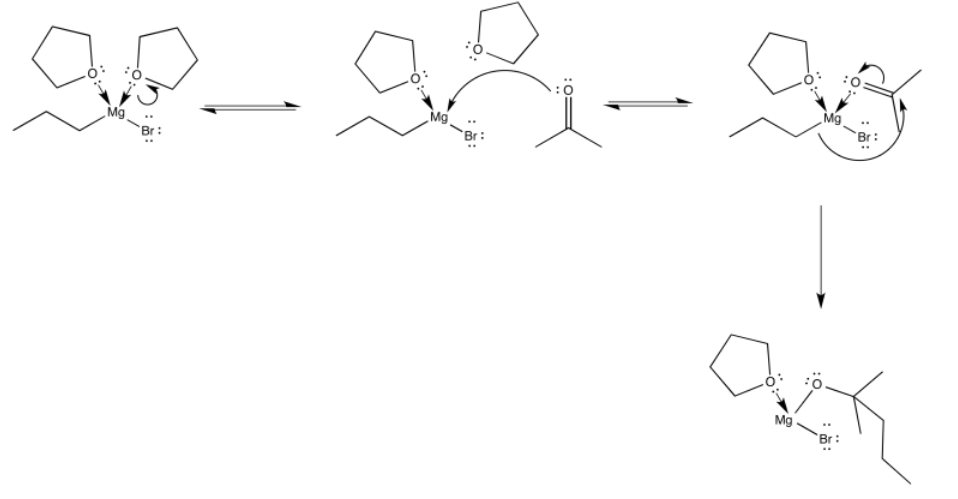
Podemos imaginar el bromuro de propilmagnesio nadando a través del THF, balanceándose de una molécula de THF a otra. Por supuesto, siempre es posible que choque con otro donante de oxígeno: un aldehído o cetona. Ciertamente se coordinaría con ese oxígeno también, pero la situación no duraría mucho ya que la adición nucleofílica se produciría de inmediato.
El enlace carbono-magnesio es polar, y permite que el carbono actúe como nucleófilo, donando su par de unión a un electrófilo. Otros enlaces polares se comportan de manera similar. Los ejemplos comunes incluyen enlaces carbono-litio (que verá en una pregunta a continuación), así como enlaces aluminio-hidrógeno y boro-hidrógeno (en complejos como Na + BH 4 - y Li + AlH 4 -, también en una pregunta a continuación). Quizás sorprendentemente, debido a que tanto el aluminio como el boro son menos electronegativos que el hidrógeno, estos enlaces están polarizados hacia el hidrógeno (el carbono, justo a la derecha del boro, es ligeramente más electronegativo que el hidrógeno, aunque no lo suficiente para hacernos pensar en un enlace C-H como polar). Eso significa que estos compuestos actúan como fuentes de ion hidruro nucleofílico, H -.
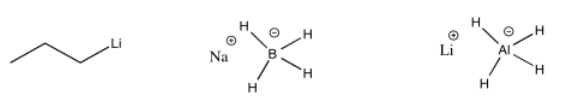
Al igual que los reactivos de Grignard, los reactivos de alquillitio y los aniones de hidruro complejo son buenos nucleófilos para aldehídos y cetonas. La parte nucleofílica se dona al carboonilo para hacer un anión alcóxido.
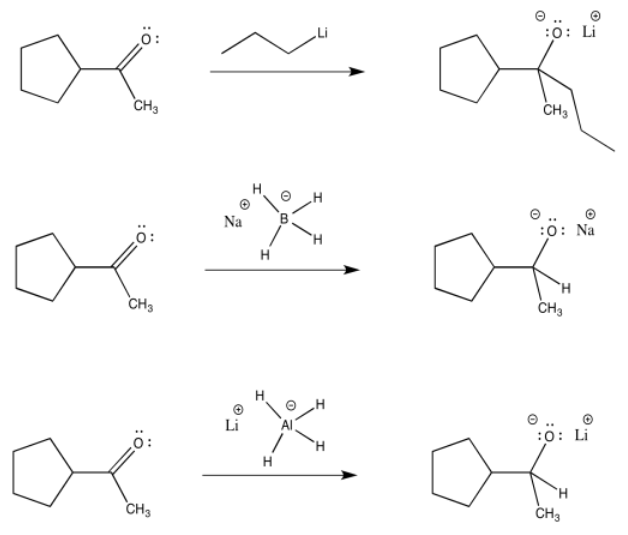
Al igual que las reacciones de Grignard, estas reacciones suelen ir seguidas de tratamiento con ácido acuoso (como HCl o H2SO4 en agua). El ion alcóxido recoge un protón para hacer un alcohol. Las sales (incluyendo iones de sodio o litio) se lavan en el agua.
Ejercicio\(\PageIndex{3}\)
Hay muchos otros nucleófilos semianiónicos. Por ejemplo, los reactivos de alquil-litio también son muy comunes, y se preparan por tratamiento de haluros de alquilo con metal de litio finamente dividido. La reacción produce cloruro de litio como producto secundario.
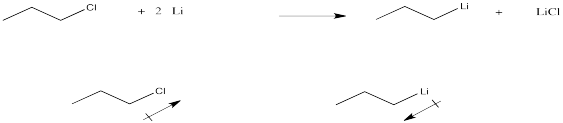
a) Mostrar una ecuación, con estructuras, para la preparación de butillitio a partir de 1-bromobutano.
b) Explicar qué sucede con la polaridad en el carbono número uno antes y después de esta reacción.
c) ¿Por qué la cantidad de carga sobre el carbono número uno sería algo similar en butillitio y bromuro de butilmagnesio?
- Contestar
-
Ejercicio\(\PageIndex{4}\)
Otra clase de nucleófilos semianiónicos es la familia de hidruros metálicos complejos. Los ejemplos incluyen borohidruro de sodio, NaBH 4 e hidruro de litio y aluminio (LAH), LiAlH 4. Hay muchas otras variaciones.
- Dibuje una estructura Lewis para hidruro de litio y aluminio.
- Explicar por qué LAH funciona como fuente del nucleófilo hidruro, H -.
- LAH es mucho más reactivo que el borohidruro de sodio; puede reducir compuestos que el borohidruro de sodio no hará. Por ejemplo, puede reducir un nitrilo como CH 3 CN a una amina como CH 3 CH 2 NH 2 (después de un tratamiento acuoso). Explique por qué LAH es mucho más reactivo que el NaBH 4.
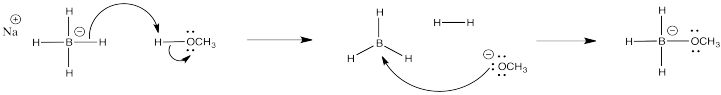
- El borohidruro de sodio a veces se usa en metanol, pero se debe tener cuidado al disolver el NaBH 4. No solo se disuelve; reacciona rápidamente con el metanol para producir un gas inflamable y NaBH 3 OCH 3. Proporcionar un mecanismo para esta reacción con flechas.
- Aunque el NaBH 3 OCH 3 también reacciona con el metanol, lo hace mucho más lentamente que el NaBH 4, por lo que aún es capaz de reducir aldehídos y cetonas en metanol. Explicar la diferencia entre borohidruro de sodio y metoxiborohidruro de sodio en términos de reactividad con metanol.
- La LAH no se puede usar en solventes próticos como el metanol. Explique por qué.
- Contestar a
-
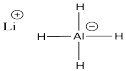
- Respuesta b & c
-

- Respuesta d
-
Ejercicio\(\PageIndex{5}\)
Las reacciones de Barbier son una clase general de reacciones que involucran alquilos metálicos y carbonilos. El tratamiento de un haluro como bromuro de propargilo (HCCCH 2 Br) con zinc metálico en presencia de un aldehído como el benzaldehído (C 6 H 5 CHO) da como resultado la adición nucleofílica del grupo propargilo al aldehído.
- El zinc puede insertarse en un enlace carbono-halógeno, al igual que el magnesio. Mostrar el producto de la inserción descrita anteriormente.
- Esta reacción generalmente se realiza en agua con algo de cloruro amónico, NH 4 Cl, en solución. Mostrar un mecanismo, con flechas curvas, para la reacción de las especies de alquilzinc con el aldehído para producir un alcohol.
- Explique por qué esta reacción de alquilzinc se puede llevar a cabo en presencia de agua, pero una reacción de Grignard no puede.
- “Química verde” se refiere al uso intencional de procesos que son mejores para el medio ambiente, al minimizar el uso de reactivos y solventes tóxicos. Comparar la reacción de Barbier mediada por zinc con la reacción de Grignard en términos de “verdor”.
- Contestar
- Contestar a
-

Ejercicio\(\PageIndex{6}\)
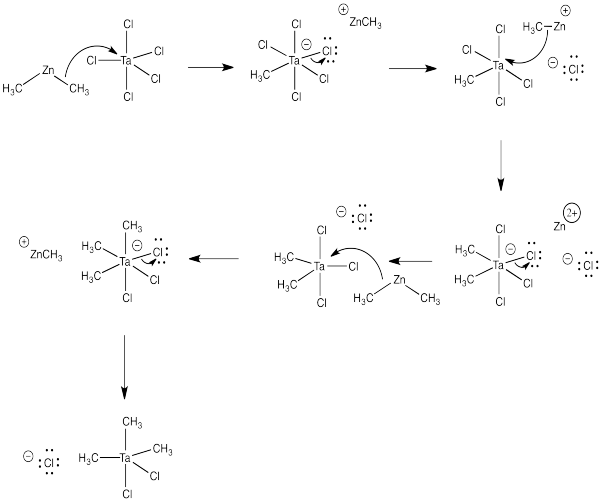
Los nucleófilos semianiónicos no solo reaccionan con los carbonilos. También se utilizan frecuentemente para preparar compuestos organometálicos a través de la “transmetalación”. Por ejemplo, el tratamiento del pentacloruro de tántalo, TaCl 5, con dimetilzinc, (CH 3) 2 Zn, proporciona dicloruro de trimetiltantalio, (CH 3) 3 TaCl 2.
- Supongamos por el momento que el pentacloruro de tantalio y el dimetilzinc son moléculas unidas covalentemente. ¿Qué dirías sobre la polaridad de enlace en cada caso?
- ¿Cuál es el producto secundario de la reacción (es decir, qué más se debe producir dada la producción de dicloruro de trimetiltántalo a partir de estos reactivos?)
- ¿En qué proporción mezclarías los dos reactivos para obtener estos productos?
- Mostrar un mecanismo, con flechas curvas, para la formación de dicloruro de trimetiltantalio.
- Al igual que algunos de los otros compuestos de esta página, el dicloruro de trimetiltantalio es notablemente pirofórico: se incendia al entrar en contacto con el aire. Este comportamiento suele depender del clima y la humedad. Mostrar un mecanismo, con flechas curvas, para lo que sucede cuando este compuesto se expone al aire.
- Contestar
- Contestar
-
Ejercicio\(\PageIndex{7}\)
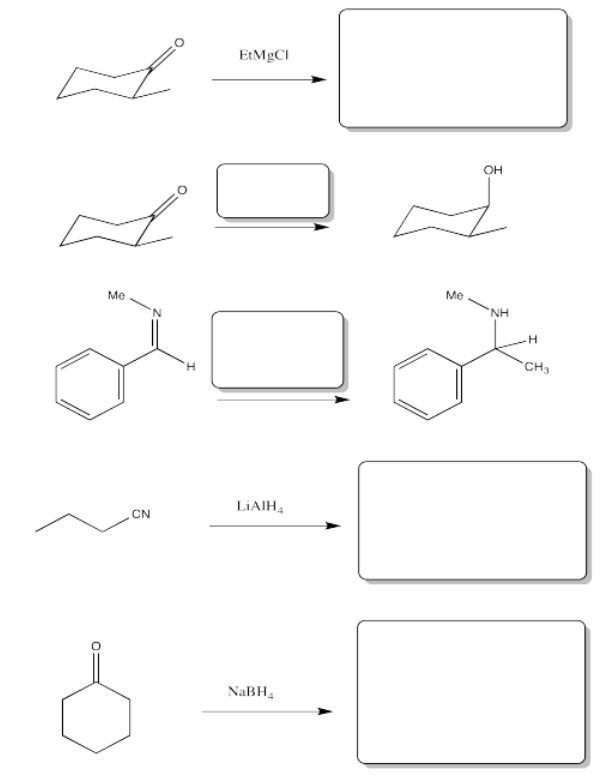
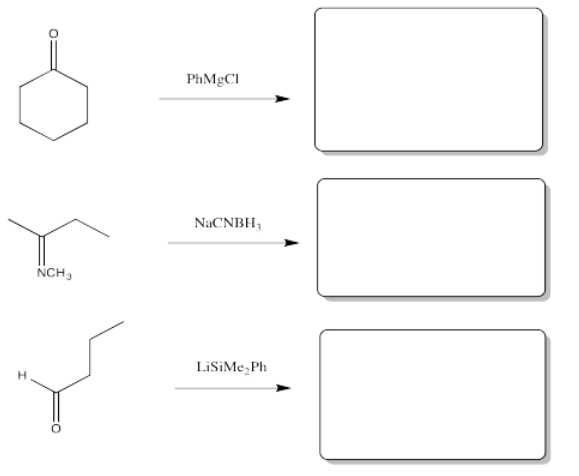
- Contestar
-
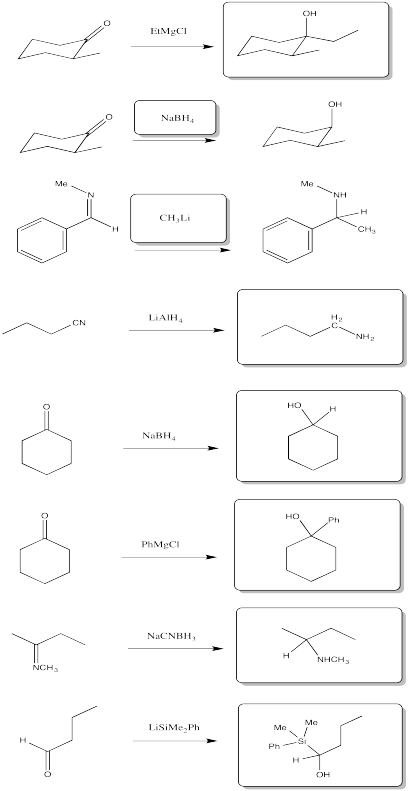
Ejercicio\(\PageIndex{8}\)
Proporcione los nombres de la IUPAC para los siguientes alcoholes. Para obtener ayuda, consulte la sección de grupos funcionales, heteroatómicos simples.
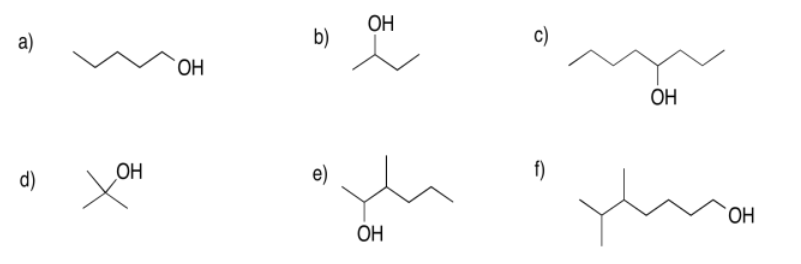
Ejercicio\(\PageIndex{9}\)
Rellene los intermedios faltantes y agregue flechas curvas para mostrar el movimiento de los electrones.
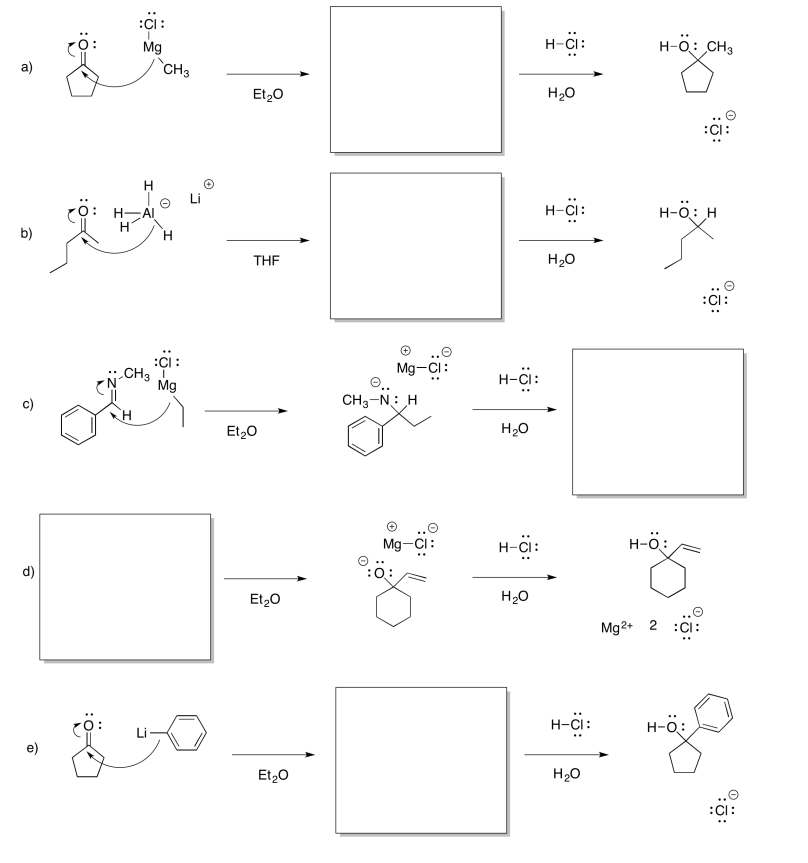
- Contestar
-