3.12: Oxidación orgánica
- Page ID
- 79325
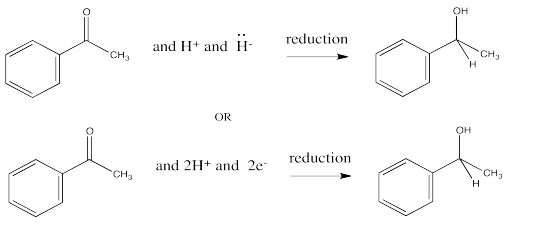
Puede recordar que la conversión de un aldehído o cetona en un alcohol se conoce como una reducción. El hidruro de una molécula NADH o un anión BH 4 actúa como nucleófilo, añadiendo H - al carbono carbonilo. Una fuente de protones puede protonar entonces el oxígeno del ion alcóxido resultante, formando un alcohol.
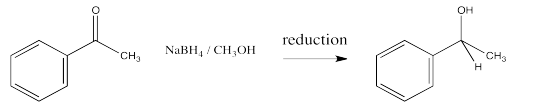
En esta reducción, se donan dos electrones y dos protones al compuesto carbonilo para producir un alcohol.
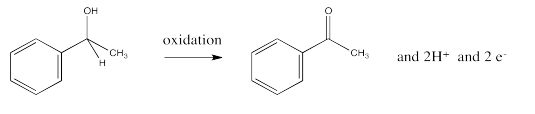
El proceso opuesto, la pérdida de dos protones y dos electrones de un alcohol para formar una cetona o aldehído, es una oxidación.
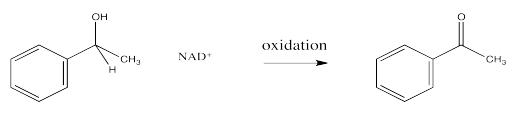
En las vías biológicas, la oxidación suele ser el reverso microscópico de la reducción. Eso significa que los productos de una reducción, NAD + y un alcohol, podrían reaccionar juntos en las circunstancias adecuadas para formar NADH y un carbonilo. La reducción de NAD+ por un donante de hidruro es posible porque, aunque el NAD + pierde la aromaticidad de su anillo de nicotinamida al convertirse en NADH, también pierde su carga positiva. La estabilización de carga es frecuentemente un problema energético para las moléculas.
Este tipo general de reacción, la reducción por transferencia de hidruro, ha sido adaptada por Ryoji Noyori, de la Universidad de Nagoya en Japón, para producir un solo enantiómero de un producto de alcohol quiral. El trabajo de Noyori sobre esta reacción, y otras, llevaron a que se le otorgara el Premio Nobel de Química en 2001.
Ejercicio\(\PageIndex{1}\)
Mostrar los dos enantiómeros que podrían producirse a partir de la reducción de acetofenona, CH 3 (CO) C 6 H 5
Ejercicio\(\PageIndex{2}\)
Proporcionar un mecanismo con flechas para la oxidación Oppenauer de alcohol bencílico, C 6 H 5 CH 2 OH.
Ejercicio\(\PageIndex{3}\)
Explique por qué la acetona se usa como disolvente en una oxidación de Oppenauer.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Ejercicio\(\PageIndex{4}\)
La reducción de Meerwein-Ponndorf-Verley de una cetona se lleva a cabo con tris (isopropóxido) de aluminio en isopropanol como disolvente. Proporcionar un mecanismo para la reducción de acetofenona, CH 3 (CO) C 6 H 5, a través de esta reacción.
Ejercicio\(\PageIndex{5}\)
Explicar por qué se usa isopropanol como disolvente en una reducción de Meerwein-Pondorf-Verley
Un segundo método general para la oxidación del alcohol emplea un metal de transición “redox activo” para aceptar un par de electrones de un alcohol durante la oxidación. Debido a que la oxidación de un alcohol implica formalmente la pérdida de dos electrones y dos protones, un aceptor de protones también está involucrado en esta oxidación. Hay muchos metales redox activos, pero uno de los más utilizados es el Cr (VI). Cuando Cr (VI) acepta un par de electrones, se convierte en Cr (IV).
Para ver cómo funciona la oxidación del cromo, usaremos óxido de cromo, CrO 3, como oxidante y agua como disolvente. Tenga en cuenta que el agua también podría actuar como aceptor de protones o lanzadera de protones, moviendo protones de un lugar a otro según sea necesario. Para llevar a cabo una oxidación, es necesario que ocurran una serie de eventos.
- El alcohol necesita unirse al cromo.
- Un protón necesita ser removido. Este evento es ayudado por la carga positiva formal sobre el alcohol luego de que dona un par solitario al cromo.
- Se debe quitar un segundo protón y dar un par de electrones al cromo para siempre.
En realidad, CrO 3 no se usa tan a menudo como oxidante. Tiende a incendiarse cuando se mezcla con compuestos orgánicos. En cambio, se utiliza una variedad de otros compuestos de cromo.
Ejercicio\(\PageIndex{6}\)
Al determinar un estado de oxidación, imaginamos dar ambos electrones en un enlace al átomo más electronegativo y observar las cargas resultantes en los iones que resultan. Suponiendo que todos los oxígenos en el óxido de cromo pueden ser pensados como dianiones, confirmar que el cromo puede ser pensado como un catión Cr 6+ (es decir, en estado de oxidación Cr (VI)).
- Responder
-

Ejercicio\(\PageIndex{7}\)
Por el razonamiento utilizado en la pregunta anterior, determinar el estado de oxidación del metal de transición en los siguientes compuestos. Tenga en cuenta que en algunos casos, hay un anión y catión en el compuesto.
a) KMnO 4 b) NaIO 4 c) Ag 2 O d) OSO 4 e) (CH 3 CH 2 CH 2) 4 N RuO 4
- Responder
-
Agrega textos aquí. No elimine primero este texto.

