3.13: Adición de Ilides
- Page ID
- 79401
En ocasiones, los nucleófilos que se agregan a un carbonilo no siguen los patrones de reactividad normales que han sido comunes hasta ahora. Este suele ser el caso con la adición de iluros.
Los iluros son compuestos que a menudo se representan con una carga positiva un átomo y una carga negativa en el siguiente átomo. Son ejemplos de zwitteriones, compuestos que contienen cargas tanto positivas como negativas dentro de una misma molécula. Lo que los distingue de otros zwitteriones es la proximidad de las cargas opuestas.
El ejemplo clásico de una adición de iluro a un carbonilo es la reacción de Wittig. La reacción de Wittig implica la adición de un iluro de fósforo a un aldehído o cetona. En lugar de producir un alcohol, la reacción produce y alqueno. La reacción es impulsada por la formación de un “producto secundario” de óxido de fósforo.
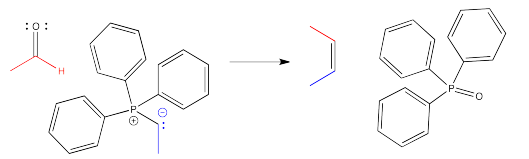
Este es un caso especial. El enlace fósforo-oxígeno es lo suficientemente fuerte como para cambiar el curso de esta reacción lejos del patrón normal, y no es algo que hubiera sido capaz de predecir en base a reacciones relacionadas.
Un iluro es un ejemplo de un compuesto molecular que contiene tanto una carga formal positiva como una negativa en dos átomos adyacentes. Las cargas están una al lado de la otra: en este caso, hay una carga positiva en el fósforo y una carga negativa en el carbono.
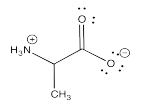
Los iluros son ejemplos específicos de zwitteriones, que son moléculas que contienen cargas positivas y negativas. El ejemplo más común de un zwitterión es probablemente un aminoácido, que contiene un ion amonio positivo y un ion carboxilato negativo, dentro de la misma molécula.
Los iluros de fósforo se hacen una carga a la vez. Primero se debe ensamblar un ion fosfonio, conteniendo la carga positiva sobre el fósforo. Este evento ocurre a través de una reacción de sustitución nucleofílica, en la que un nucleófilo de fósforo desplaza un halógeno de un haluro de alquilo.
Ejercicio\(\PageIndex{1}\)
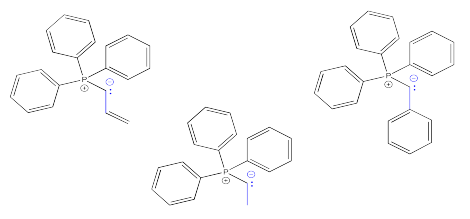
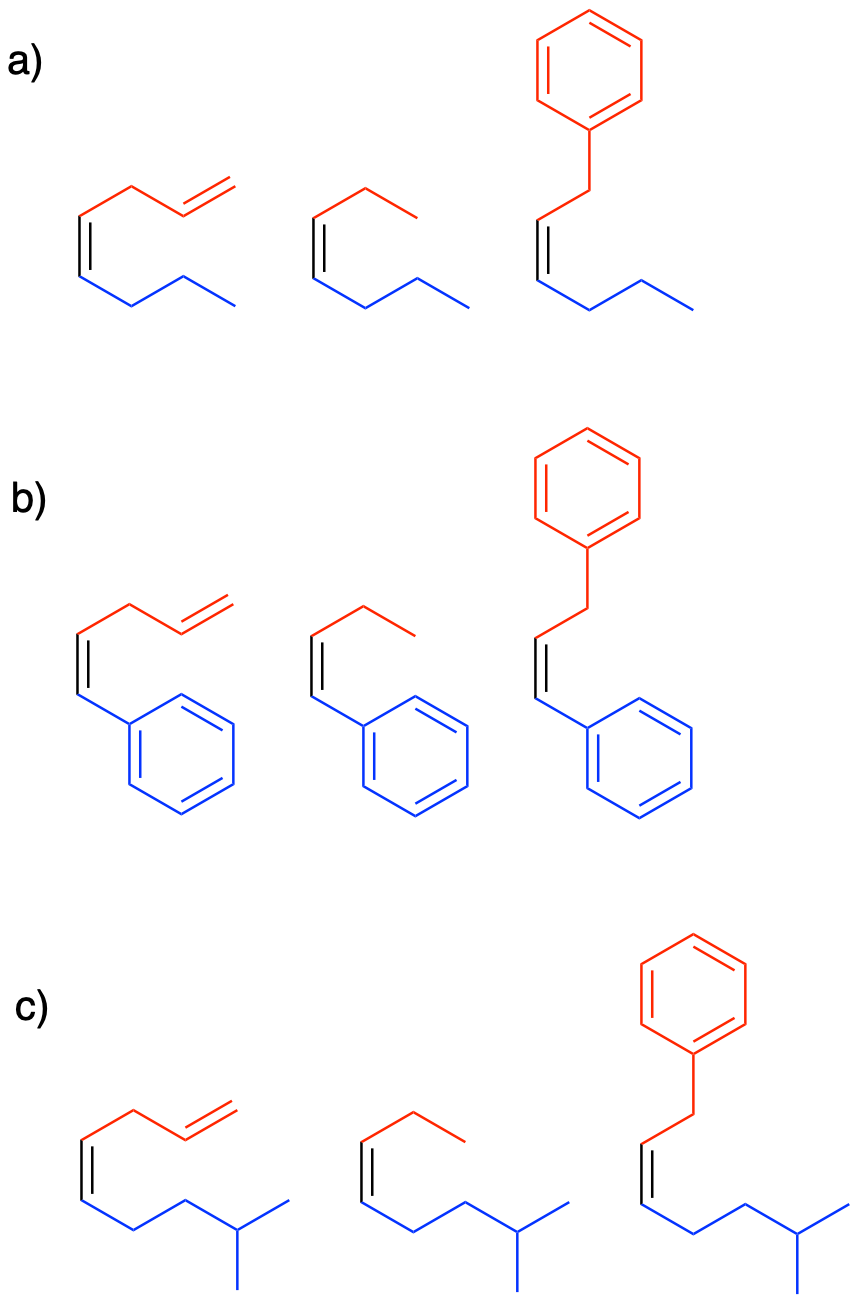
Mostrar, con flechas de reacción, la formación de las tres sales de bromuro de alquiltrifenilfosfonio que se muestran a continuación.
- Contestar
-
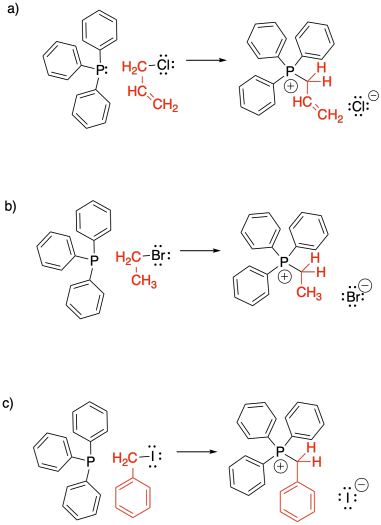
En la mayoría de los casos, la fuente del fósforo es la trifenilfosfina. La trifenilfosfina se utiliza por varias razones prácticas. En primer lugar, es un sólido, por lo que es fácil pesar la cantidad correcta de él y agregarlo a una reacción. En segundo lugar, los compuestos organofosforados suelen ser muy tóxicos y malolientes, pero la trifenilfosfina es menos ofensiva. En tercer lugar, en la reacción de Wittig, el compuesto de fósforo original finalmente se descarta como desecho, y se mantiene el alqueno más útil. Dado que la parte de fósforo no importa tanto, generalmente se usa la fosfina más conveniente posible. Sin embargo, existen otras variaciones de esta reacción que utilizan otros compuestos de fósforo.
Una vez que se ha hecho la sal de fosfonio, el iluro de fósforo se puede obtener a través de la desprotonación de un ion fosfonio. Los hidrógenos en un carbono junto a un catión de fósforo son un poco ácidos debido a la carga positiva en el fósforo. Uno de estos hidrógenos se elimina fácilmente mediante la adición de una base muy fuerte como el hidruro de sodio.
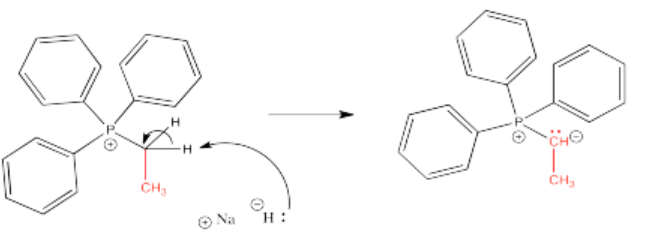
Ejercicio\(\PageIndex{2}\)
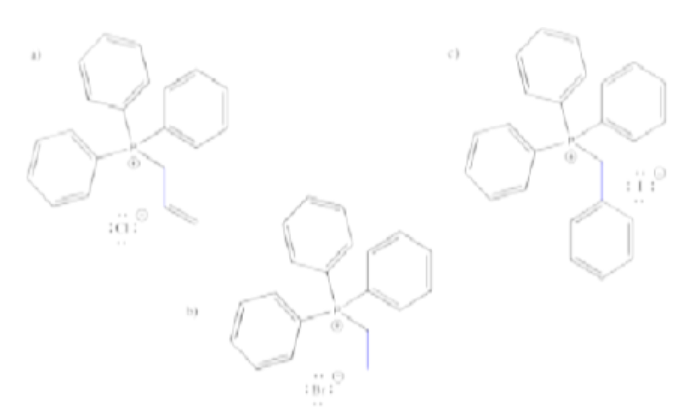
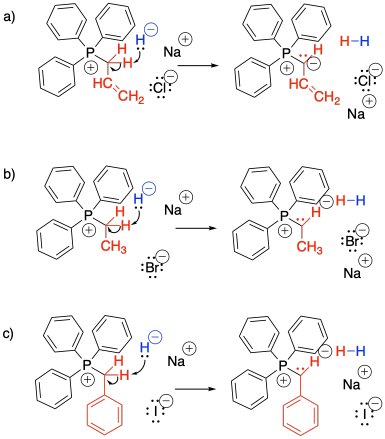
Mostrar, con flechas de reacción, la formación de iluros a partir de las tres sales de bromuro de alquiltrifenilfosfonio mostradas anteriormente en el Ejercicio\(\PageIndex{1}\)
- Contestar
-
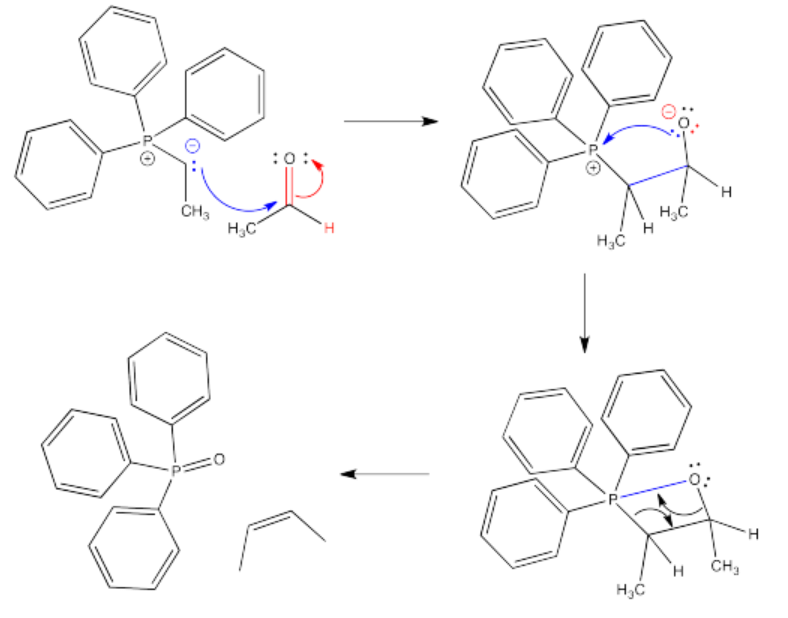
La reacción de un iluro de fósforo con un compuesto carbonilo comienza como otras adiciones nucleofílicas. El iluro dona su par solitario nucleofílico al carbonilo y el enlace carbonilo pi se rompe. Sin embargo, el fuerte enlace P-O se hace cargo de la reacción. Para comenzar, se dona un par solitario sobre el ion alcóxido resultante al ion fosfonio cargado positivamente.
¡Espera! Eso viola una de nuestras reglas mecanicistas. Por lo general, no tenemos un átomo donado a un átomo cargado positivamente que ya tiene un octeto; si lo hacemos, el átomo tendrá demasiados electrones. Sin embargo, la regla del octeto no se aplica estrictamente al azufre y al fósforo. Estos átomos son más grandes que los átomos de la segunda fila como el nitrógeno y el oxígeno, y a menudo se observa que “exceden la regla del octeto”. El azufre y el fósforo se observan frecuentemente con geometrías moleculares trigonales bipiramidales u octaédricas, lo que significa que pueden tener hasta 12 electrones en sus conchas de valencia.
¡Así que adelante! Dona un par de electrones al fósforo. No puede evitarlo, por la fuerza del enlace P-O que se forma.
Ejercicio\(\PageIndex{3}\)
Muestra los productos de las reacciones de cada uno de los iluros que hiciste en Ejercicio\(\PageIndex{2}\) (Problema CO18.2.) con los siguientes electrófilos:
a) butanal b) benzaldehído c) 4-metilpentanal
- Contestar
-
Aquí es cuando las cosas realmente se ponen interesantes. Resulta que un bono P-O simplemente no es suficiente. El fósforo es tan oxofílico que lleva el átomo de oxígeno todo a sí mismo, sacándolo directamente de la molécula. Probablemente no haga daño que el anillo de cuatro miembros esté bastante tenso, por lo que está motivado a descomponerse (pero tenga cuidado: hay muchos anillos estables de cuatro y hasta tres miembros en la naturaleza).
Las flechas que se muestran en la descomposición del anillo de cuatro miembros (llamado betaína) solo están destinadas a realizar un seguimiento de los electrones; no hay un verdadero nucleófilo y electrófilo en este paso. En cambio, este paso puede parecerse a una reacción pericíclica, la cual está cubierta en otra sección.
Exactamente cómo dibujar el vínculo P=O es discutible. No hay mucha duda de que es un doble enlace; es más fuerte y más corto que un enlace sencillo P-O. Sin embargo, los cálculos mecánicos cuánticos indican que el fósforo no puede formar un enlace pi. Este doble enlace es diferente a otros dobles enlaces que hayas visto. Por esa razón, algunas personas prefieren dibujar este compuesto como un iluro, también, con una carga positiva en el fósforo, un enlace sencillo, y una carga negativa sobre el oxígeno.
El compuesto de óxido de fósforo se forma, dejando atrás un alqueno. Los alquenos son muy comunes en la naturaleza, y esta reacción se ha utilizado frecuentemente para hacer interesantes compuestos que contienen alquenos para su posterior uso o estudio.
Ejercicio\(\PageIndex{4}\)
La hormona juvenil de la oruga de la polilla de la cecropía (JH-1, abajo) es una hormona reguladora utilizada para controlar el desarrollo del organismo evitando que se pule hasta que las condiciones sean las adecuadas.
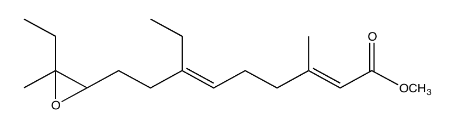
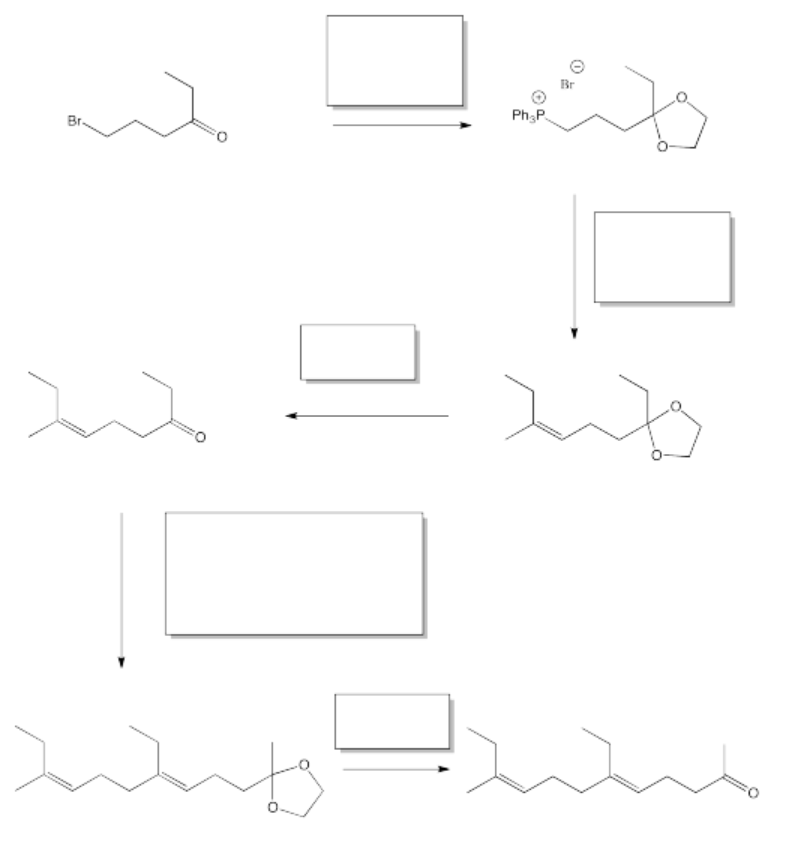
La síntesis de hormonas de insectos a menudo se realiza con el fin de controlar las poblaciones de insectos. La siguiente síntesis de JH-1 fue desarrollada por Barry Trost (Stanford) en la década de 1960. Rellene los reactivos y productos de reacción faltantes.
- Contestar
-
Una de las claves en este problema es reconocer que en algunos pasos, se involucran dos reacciones diferentes. Por ejemplo, en la primera caja, hay una adición de un diol a un carbonilo seguido de una adición de iluro.
Los iluros de azufre también son buenos nucleófilos para aldehídos y cetonas. Sin embargo, la estabilidad inusual del enlace fósforo-oxígeno no tiene un análogo similar en la química del azufre.
Los iluros de azufre se forman de una manera muy similar a los iluros de fósforo.
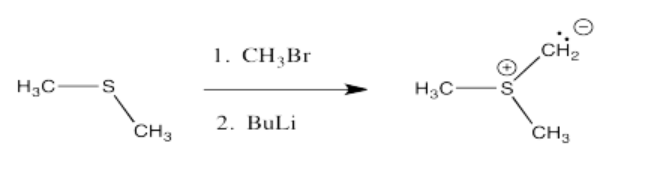
Ejercicio\(\PageIndex{5}\)
Mostrar, con flechas, el mecanismo de formación del iluro de azufre anterior.
- Contestar
-
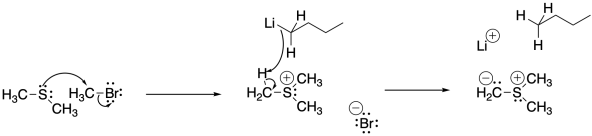
Una vez formados, los iluros de azufre reaccionan con aldehídos o cetonas. Al igual que los iluros de fósforo, la reacción comienza igual que cualquier otro nucleófilo, pero un segundo paso toma una dirección muy diferente. En estas reacciones se forman epóxidos y se regenera el compuesto de azufre original (un tioéter).
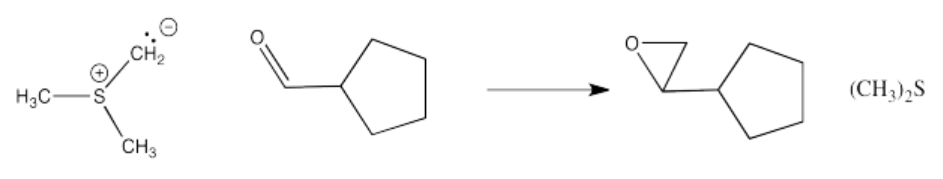
Ejercicio\(\PageIndex{6}\)
Mostrar, con flechas, el mecanismo para la reacción formadora de epóxidos anterior.
- Contestar
-
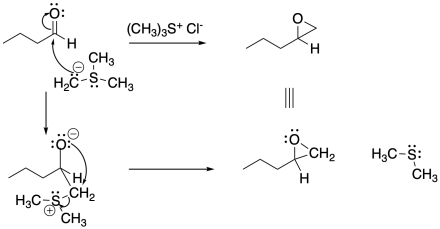
Ejercicio\(\PageIndex{7}\)
Rellenar el producto o reactivo para cada una de las siguientes transformaciones. Recuerde que siempre se supone un tratamiento ácido.
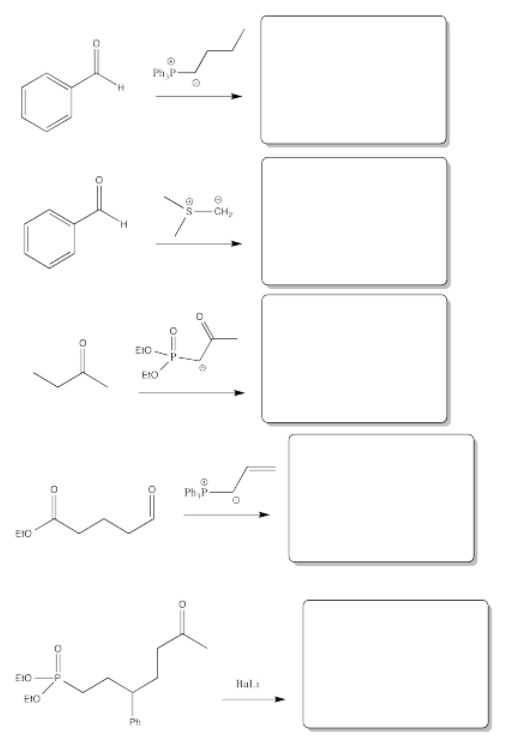
- Contestar
-
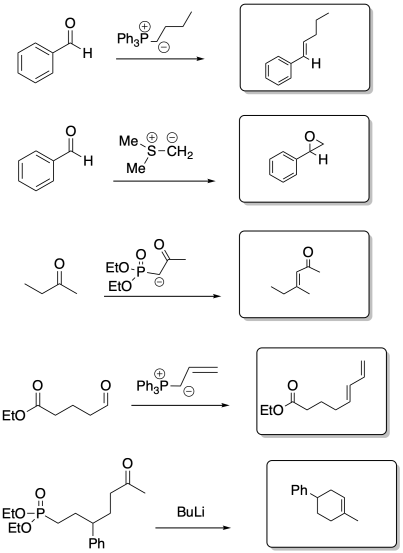
Ejercicio\(\PageIndex{8}\)
Identificar el material de partida como nucleófilo o electrófilo en las siguientes reacciones (a partir de la síntesis de un análogo de epotilona por K.H. Altmann en ETH). En el producto, recuadro la parte de la estructura que vino del compuesto a la izquierda; rodee la parte nueva.
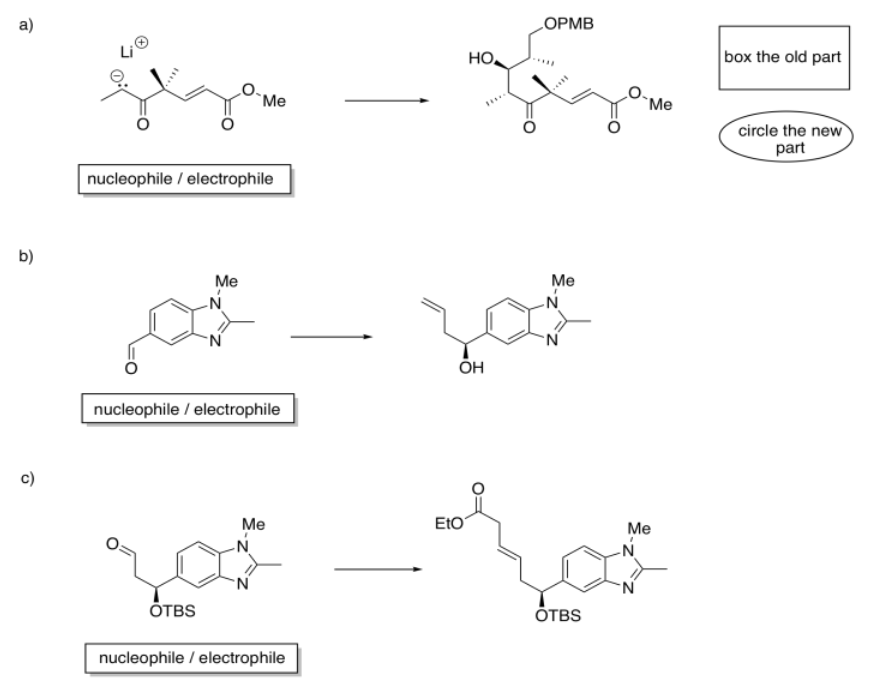
- Contestar
-
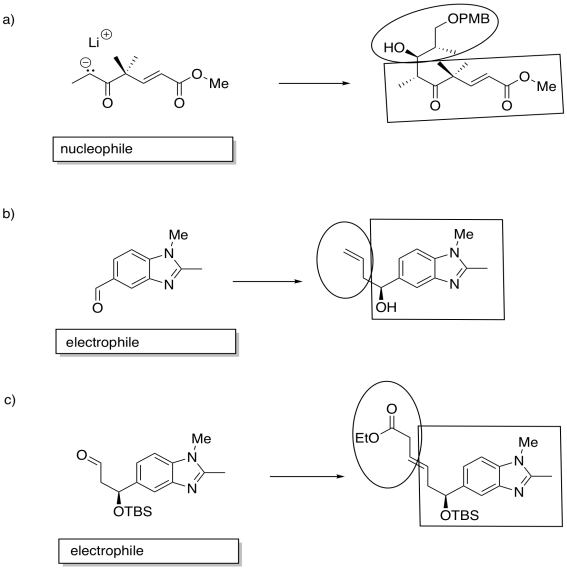
Ejercicio\(\PageIndex{9}\)
Rellene los espacios en blanco en la siguiente síntesis. Requiere conocimiento de la adición de aldol, adiciones de Grignard y reacciones de Wittig/Horner-Wadsworth-Emmons.
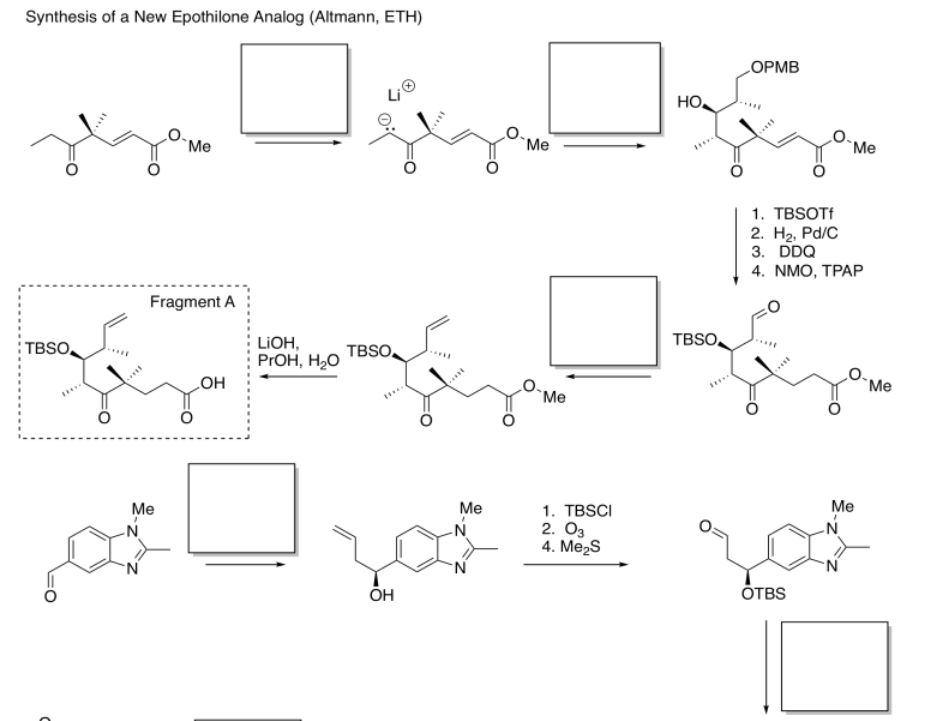
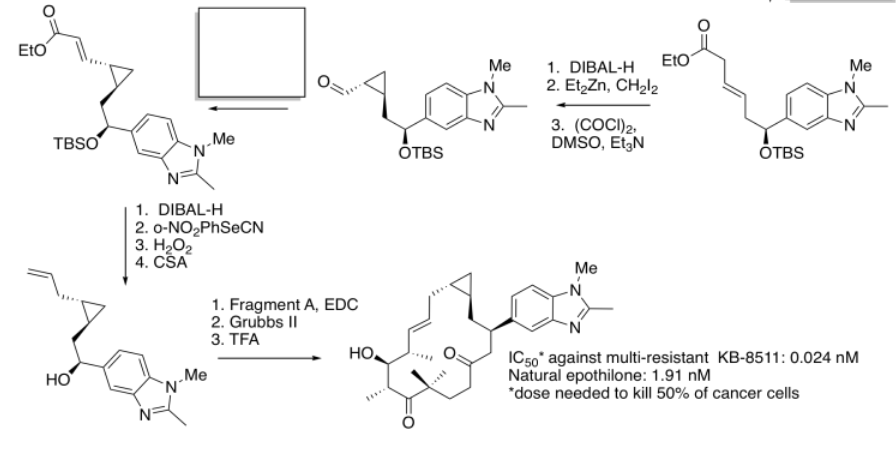
- Contestar
-
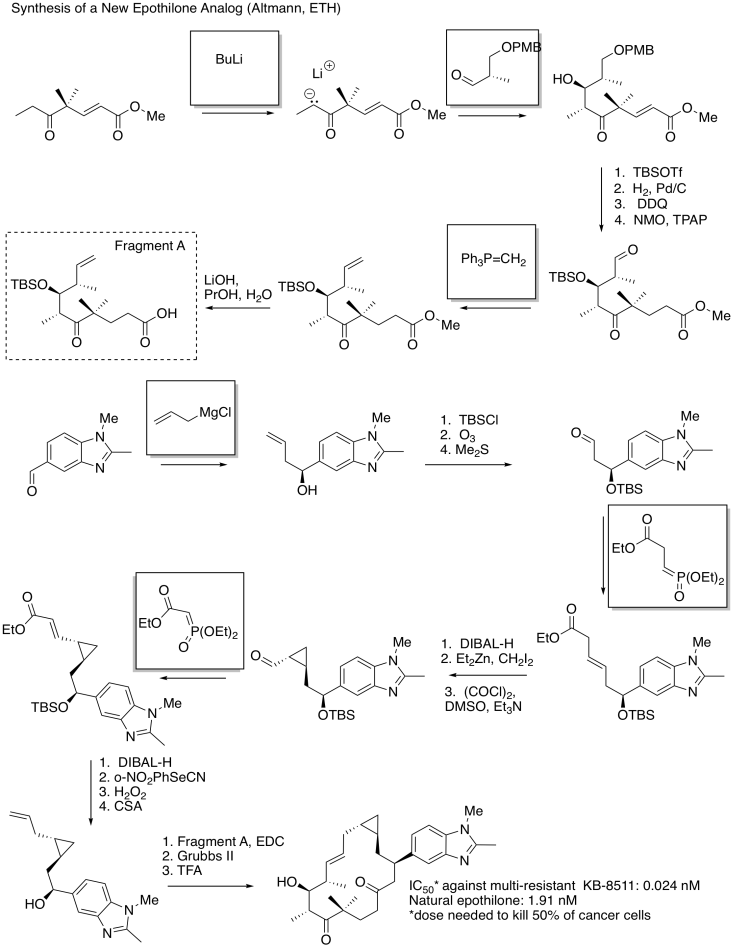
Ejercicio\(\PageIndex{10}\)
El análogo de epotilona de Altmann sintetizado arriba (mostrado a la derecha, abajo) claramente tiene cierto parecido con la epotilona natural A (abajo, izquierda). Sin embargo, el análogo es efectivo a concentraciones mucho más bajas que el producto natural. Esa información en realidad puede revelar algo sobre cómo interactúa el producto natural con su objetivo.
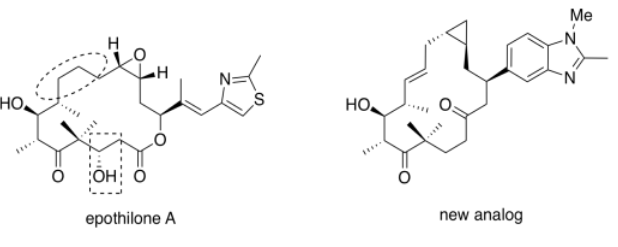
- Se resaltan partes de la epotilona A. Encierra en círculo y recuadro las partes correspondientes del análogo.
- Describir las diferencias entre las porciones resaltadas de las versiones natural y sintética.
- Uno podría imaginar que el grupo alcohólico en caja forma parte de un farmacoforo, la parte del compuesto que se une con su diana. ¿Qué atractivos intermoleculares parecen probables con este grupo?
- Comentar la aparente importancia de este grupo en la vinculación con el objetivo, con base en la evidencia.
- Uno podría imaginar la parte circular del compuesto natural adoptando diferentes conformaciones a través de cambios en el ángulo diedro. ¿Qué ángulo diedro parece mostrarse en la epotilona natural?
- ¿Qué ángulo diedro parece mostrarse en el análogo?
- Con base en la evidencia, ¿qué ángulo diedro se prefiere para unirse al objetivo?
- Contestar
- Contestar a
-

- Respuesta b
-
La parte en círculo cambió de un enlace sencillo a un doble enlace. La parte en caja cambió de una cadena de alcohol a hidrocarburo sin adornos.
- Respuesta c
-
Los enlaces de hidrógeno son los más obvios.
- Respuesta d
-
Sin embargo, el análogo funciona mejor sin este grupo; este grupo alcohólico en particular probablemente no sea una parte importante del farmacoforo. Probablemente no sea necesario para unirse al objetivo.
- Respuesta e
-
En la epotilona A, tal como se dibuja, el ángulo diedro parece ser de 0 grados.
- Respuesta f
-
En el nuevo análogo, el ángulo diedro es de 180 grados.
- Respuesta g
-
Con base en la actividad superior del análogo, la conformación activa del anillo es probablemente más parecida a la de la derecha que a la de la izquierda. El enlace circular probablemente adopta un ángulo diedro más cercano a los 180 grados, con el resto del anillo retorciéndose en una forma más parecida a la que se muestra a la derecha, con el fin de unirse al objetivo.

