3.19: Soluciones a problemas seleccionados, Parte A
- Page ID
- 79413
Problema CO1.1.
El grupo HO-C=O o CO 2 H presente en todos los aminoácidos se denomina ácido carboxílico.
Un ácido carboxílico adicional está presente en el ácido aspártico y el ácido glutámico.
El grupo H 2 N-C=O o CONH 2 presente en asparagina y glutamina se denomina amida.
Problema CO1.2.
a) aldehído b) cetona c) cetona d) aldehído
Problema CO1.3.
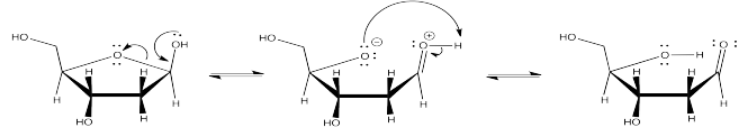
a) El doble enlace significa que dos pares de electrones son compartidos entre el carbono y el oxígeno, en lugar de solo uno. Como resultado, el oxígeno es capaz de alejar más densidad de electrones del carbono. El carbono se vuelve mucho más positivo en este caso que en el caso de un doble enlace.
No sólo eso, sino que el segundo enlace entre el carbono y el oxígeno es un enlace pi. Esos electrones están más lejos del núcleo que un enlace sigma, en el que los electrones están fuertemente retenidos entre los átomos. Eso significa que los electrones pi son atraídos más fácilmente hacia el oxígeno, por lo que el enlace se polariza aún más.
b) Un enlace C=N sería muy similar a un enlace C=O, porque el nitrógeno es el tercer elemento más electronegativo después del oxígeno y el flúor (ignorando los gases nobles).
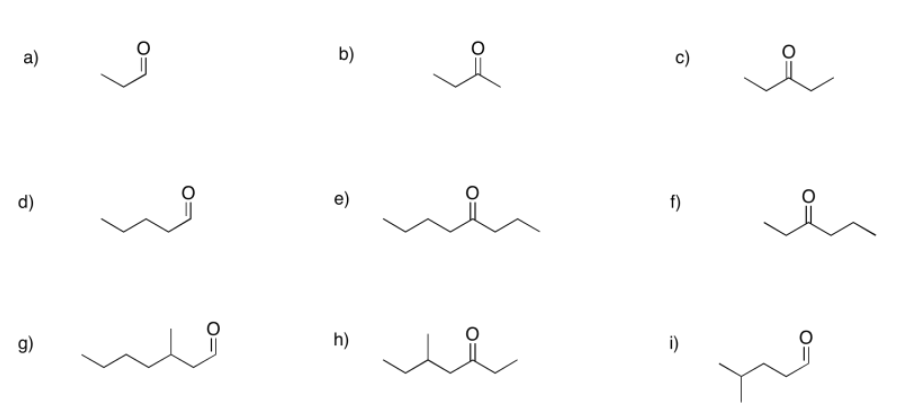
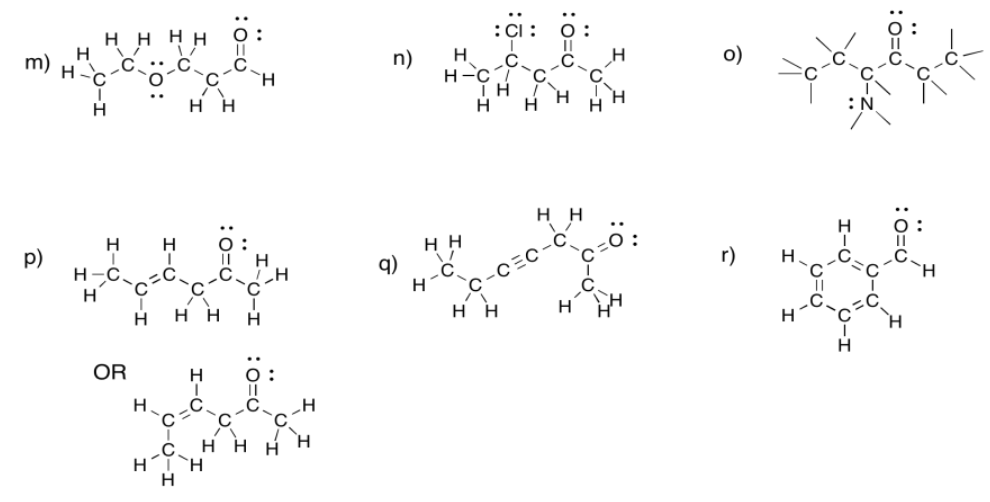
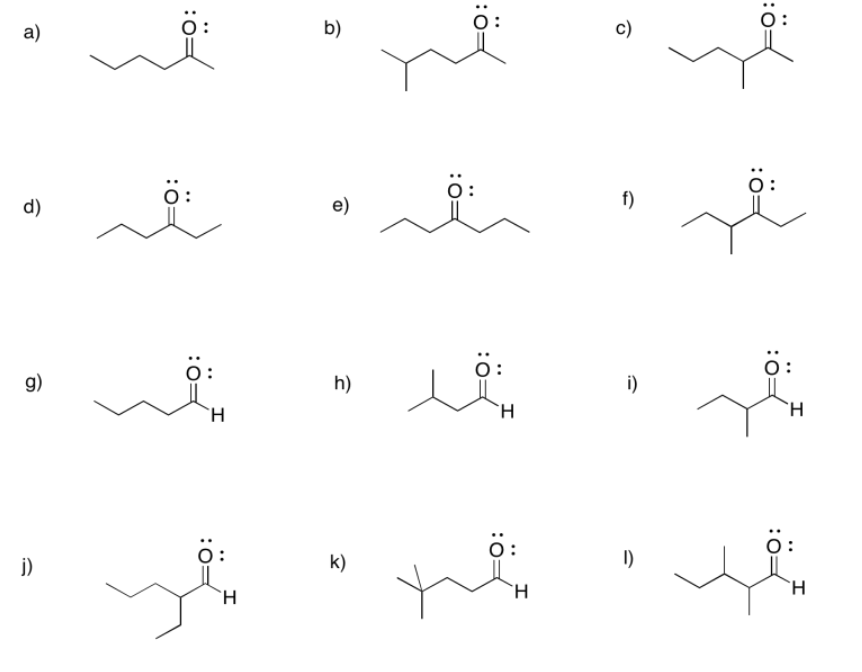
a) 2-hexanona o hexan-2-ona b) 5-metilhexan-2-ona c) 3-metilhexan-2-ona
d) hexan-3-ona e) heptan-4-ona f) 4-metilhexan-3-ona
g) hexanal h) 3-metilbutanal i) 2-metilbutanal
j) 2-etilpentanal k) 4,4-dimetilpentanal l) 2,3-dimetilpentanal
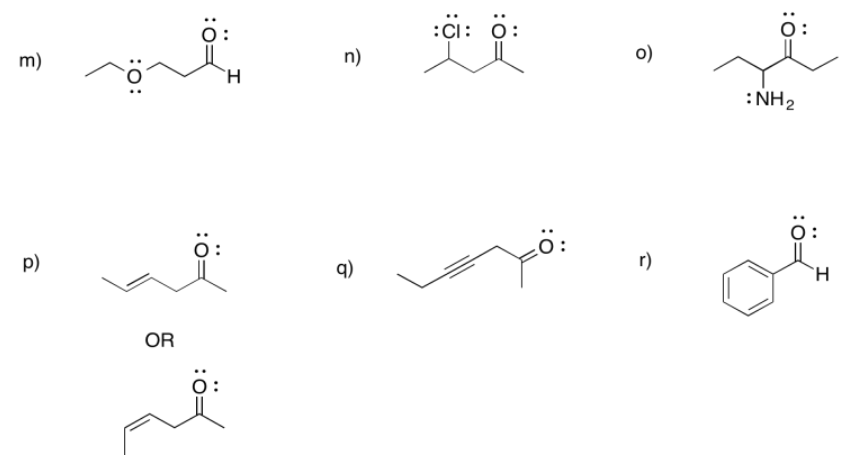
m) 3-etoxipropanal n) 4-cloropentan-2-ona o) 4-aminohexan-3-ona
p) hex-4-en-2-ona (en la solución anterior, se muestra primero (E) -hex-4-en-2-ona y (Z) -hex-4-en-2-ona se muestra en segundo lugar).
q) hept-4-in--2-ona r) benzaldehído (este es un nombre común adoptado para la denominación formal. Benz significa un carbono unido a un anillo de benceno.)
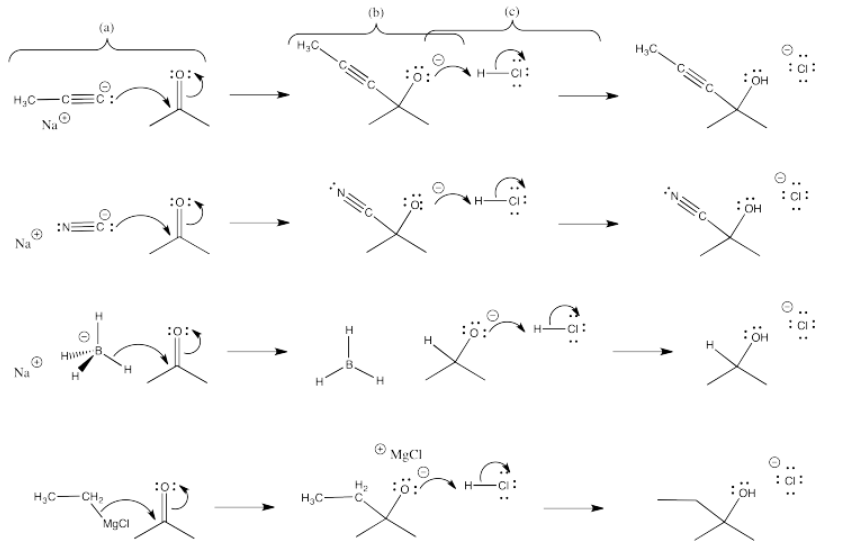
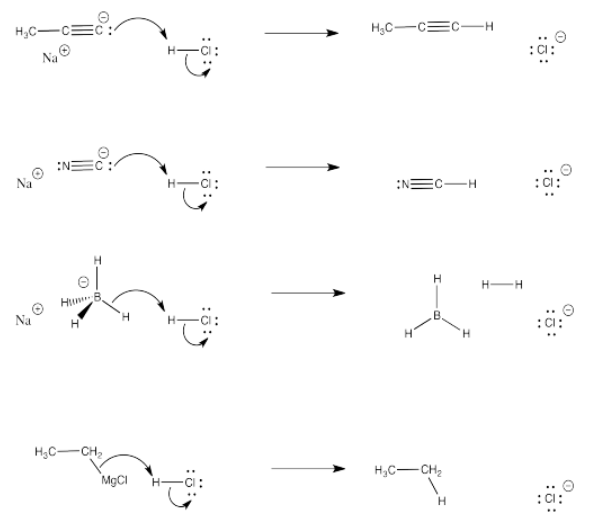

El LUMO en este caso es el π*, un nivel antiadhesión. Si los electrones pueblan este nivel, el enlace π se romperá.
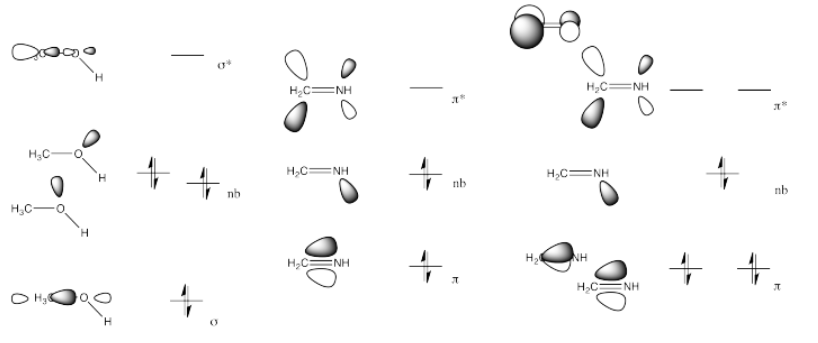
Tanto la imina (b) como el nitrilo (c) tienen un nivel de antiunión pi bajo (π*), similar a un carbonilo.
- Sobre la base del hacinamiento estérico, el primero es el más reactivo, luego el último, luego el medio.
- Sobre la base del hacinamiento estérico, el último es el más reactivo, luego el primero, y luego el medio.
Si bien hay un grupo grande sobre el nitrógeno en ese último compuesto, el sitio de reactividad es el carbono, que está menos abarrotado.
c) Sobre la base de la electrónica, el medio es más reactivo, luego el último, y luego el primero. El átomo de flúor es muy electronegativo y atrae la densidad electrónica hacia sí mismo. Eso deja más carga positiva en el carbono carbonilo cercano. Cuantos más flúor haya en ese carbono cercano, más positivo será el carbono. Cuanto más positivo es el carbono, más atrae electrones de un nucleófilo.
a) propanal b) butanal c) propanal, ¡otra vez!
d) pentanal e) hexanal f) heptanal
a) 3-pentanona b) 3-hexanona c) 4-heptanona
d) 2-butanona e) 3-octanona f) 5-decanona
a) 2-metil-3-pentanona o 2-metilpentan-3-ona b) 4-etil-3-hexanona o 4-etilhexan-3-ona
c) 3,3-dimetil-2-butanona o 3,3-dimetilbutan-2-ona d) 2,5,5-trimetil-4-heptanona o 2,5,5-trimetilheptan-4-ona
e) 6-etil-4-metil-3-octanona o 6-etil-4-metiloctan-3-ona f) 6-etil-4,5-dimetil-3-octanona o 6-etil-4,5-dimetiloctan-3-ona
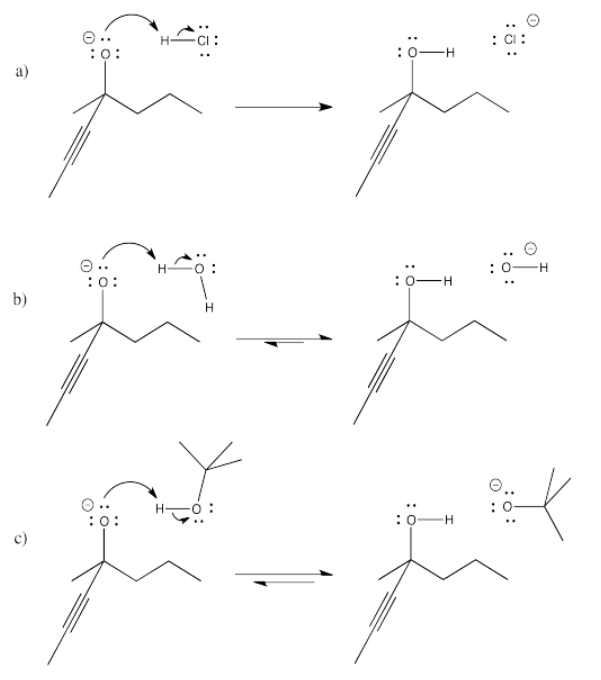
El cloruro de amonio tiene un enlace N-H, normalmente menos polar que el enlace O-H del agua. Sin embargo, la carga positiva hace que este compuesto renuncie más fácilmente a un protón, ya que da como resultado una molécula de amoníaco neutra (sin carga).
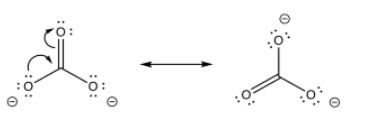
El carbonato de sodio tiene un enlace O-H polar, al igual que el agua. Sin embargo, el anión que resulta de la pérdida de un protón está estabilizado por resonancia. Eso hace que este compuesto sea más ácido que el agua.
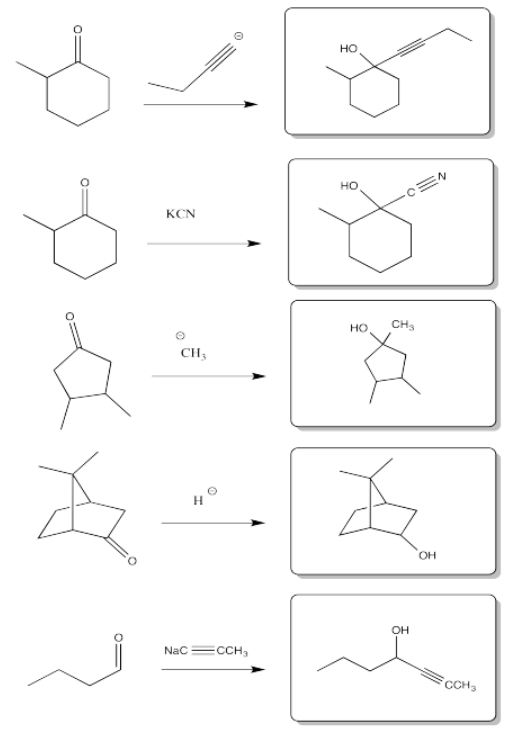
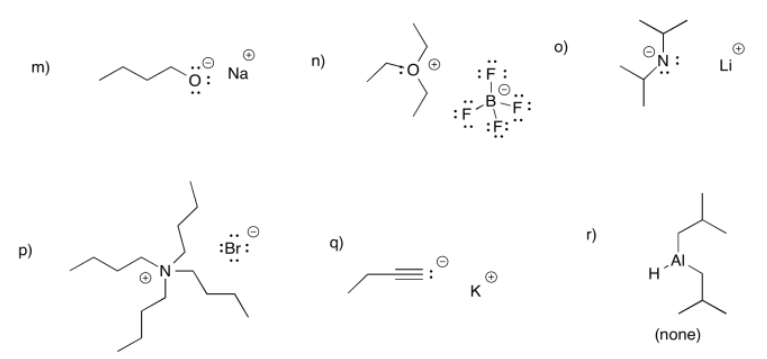
a) En acetiluro, el par solitario está en un carbono lineal o carbono sp. En el anión metilo, el par solitario está en un carbono tetraédrico o carbono sp 3. La descripción “sp” indica que la unión sigma a los vecinos implica un orbital 2s y un orbital 2p sobre carbono; hay una contribución del 50% desde el orbital s.
La descripción “sp 3 “, por otro lado, indica que la unión sigma a los vecinos involucra un orbital 2s y tres orbitales 2p; hay una contribución de 25% desde el orbital s.
El orbital 2s es menor en energía que el orbital 2p. Cuanto mayor sea la contribución orbital s al enlace (o en este caso al par solitario), menor será en energía. Así, un par solitario en un carbono sp es menor en enrgy que un par solitario en un carbono sp 3.
b) En el cianuro, el mismo argumento esbozado en pary (a) es cierto. Además, el nitrógeno electronegativo cercano estabiliza la carga atrayendo la densidad electrónica hacia sí mismo.
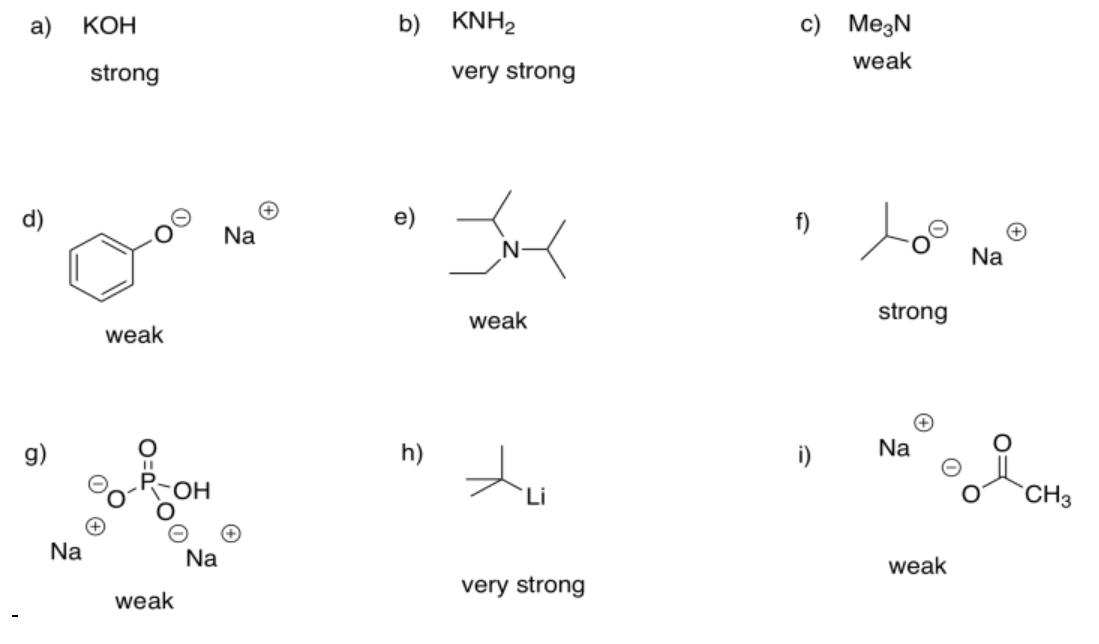
- CH 3 OK, debido al enlace iónico O-K. Se trata de un nucleófilo aniónico. Es más reactivo y nucleofílico que el nucleófilo neutro correspondiente.
- CH 3 NH 2, porque el nitrógeno es menos electronegativo que el oxígeno. Su par solitario se sostiene con menos fuerza y se dona más fácilmente al electrófilo.
- NACH, debido a que el carbono vecino en este caso no tiene el efecto inductivo de extracción de electrones que el nitrógeno tiene en el caso del NaCN. En ese caso, el par solitario se estabiliza y se hace menos reactivo.
- C-c 6 H 11 ONa, debido a que la carga negativa se localiza en un átomo. En c-C 6 H 5 ONa, la carga negativa se deslocaliza en cuatro posiciones diferentes en la molécula. La deslocalización de la carga estabiliza el anión y lo hace menos reactivo.
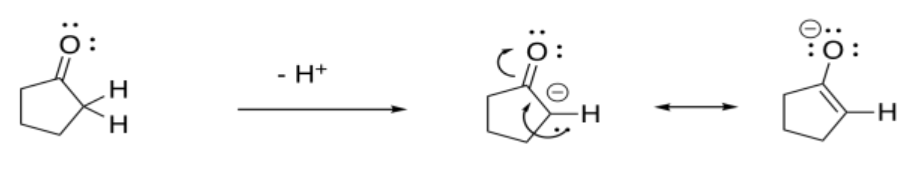
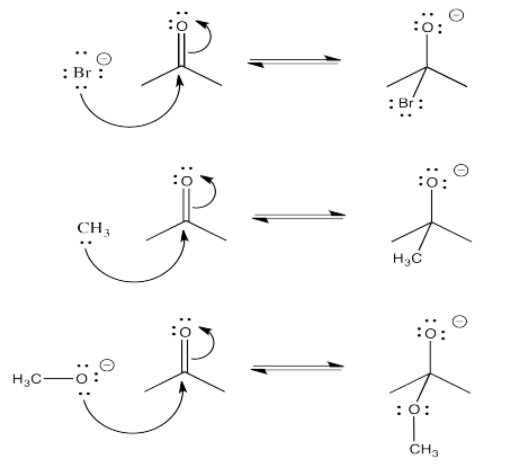
El anión resultante se estabiliza por resonancia.
El caso con más hacinamiento estérico es más probable que resulte en desprotonación.
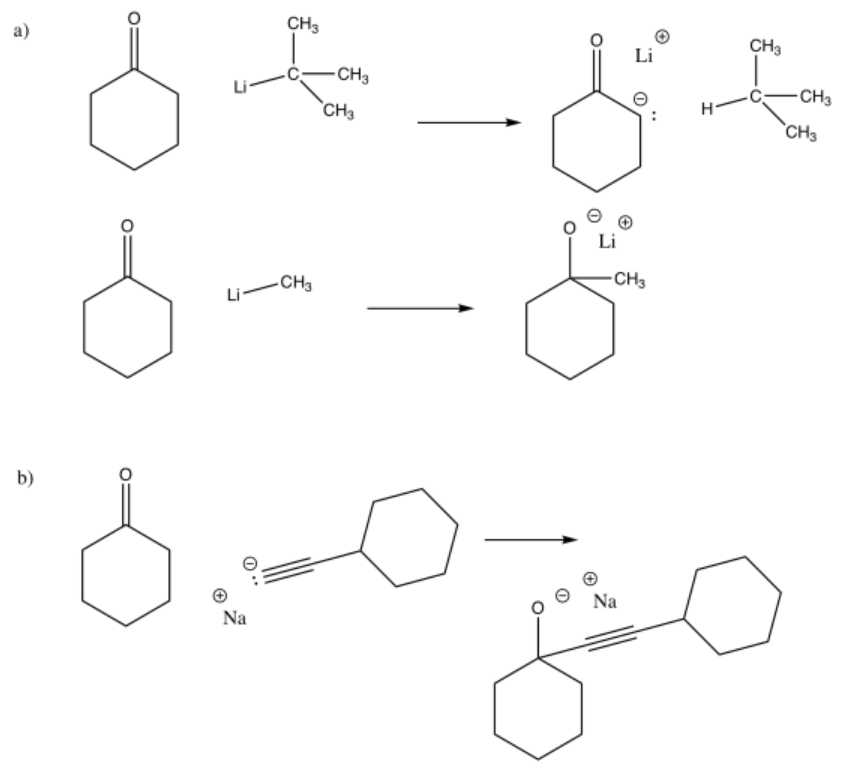
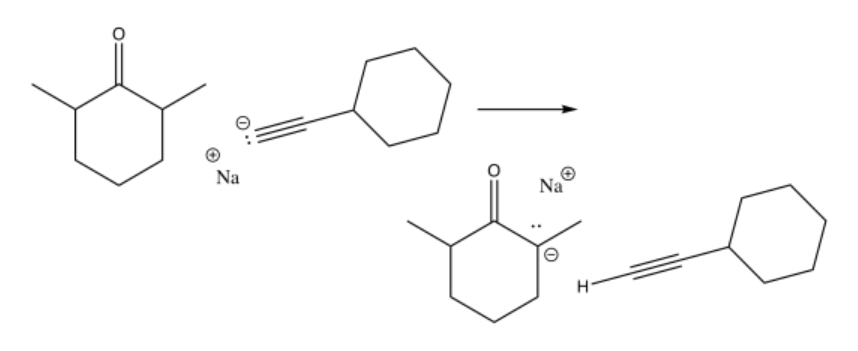
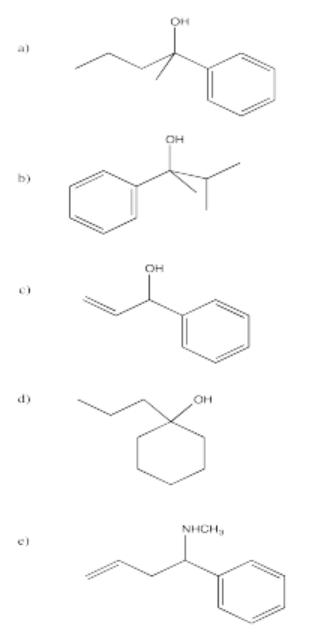
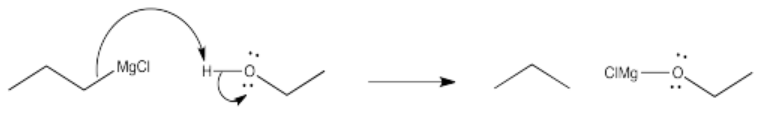
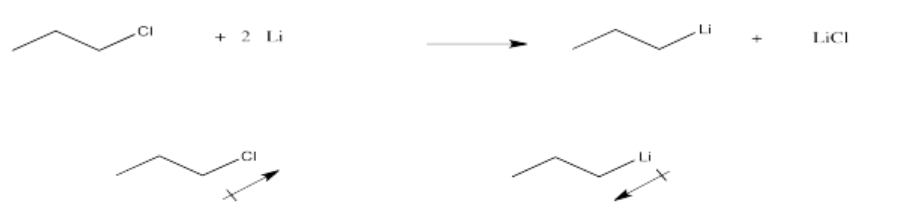
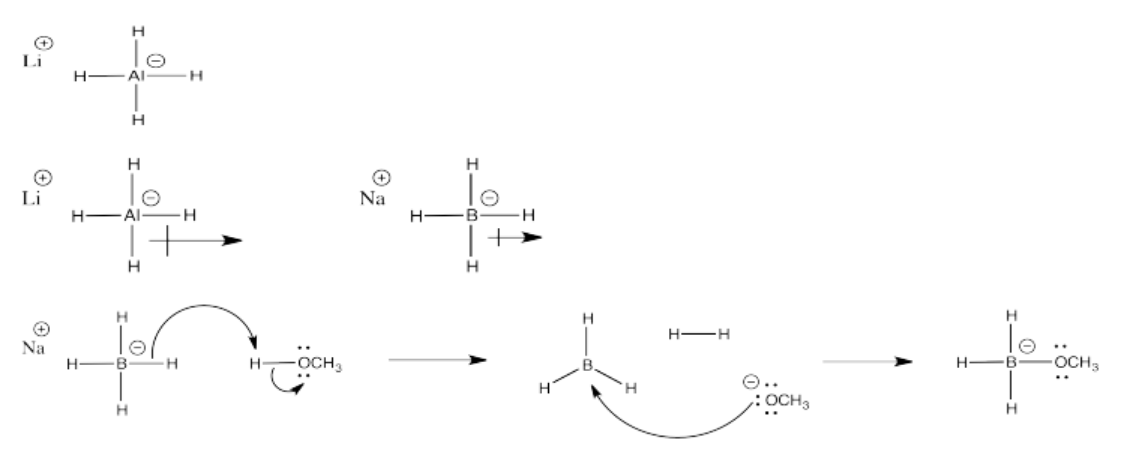
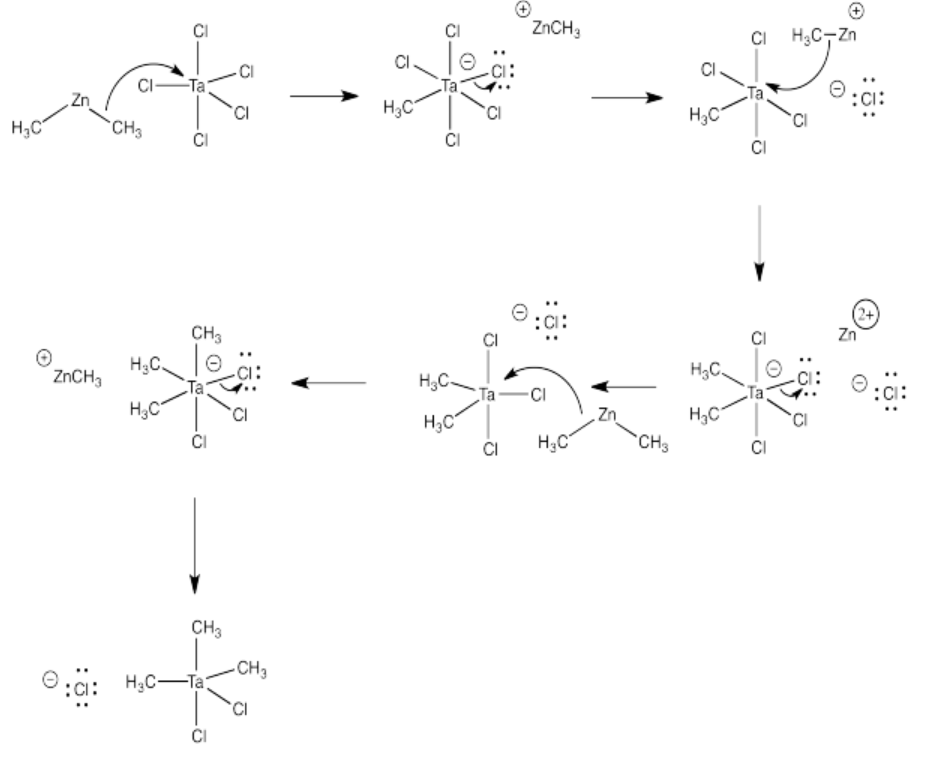
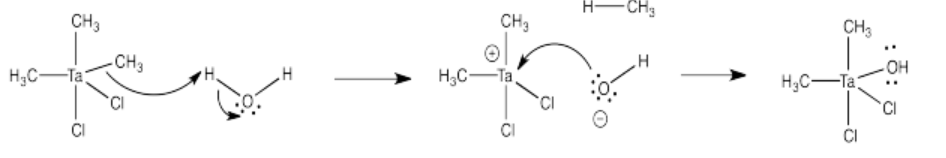
Problema CO11.5.
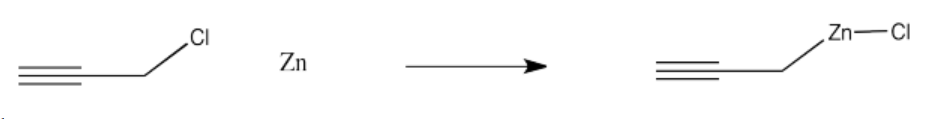
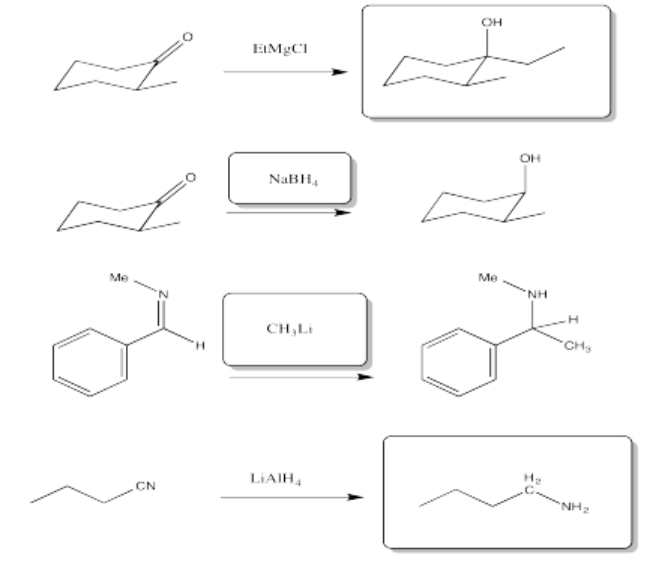
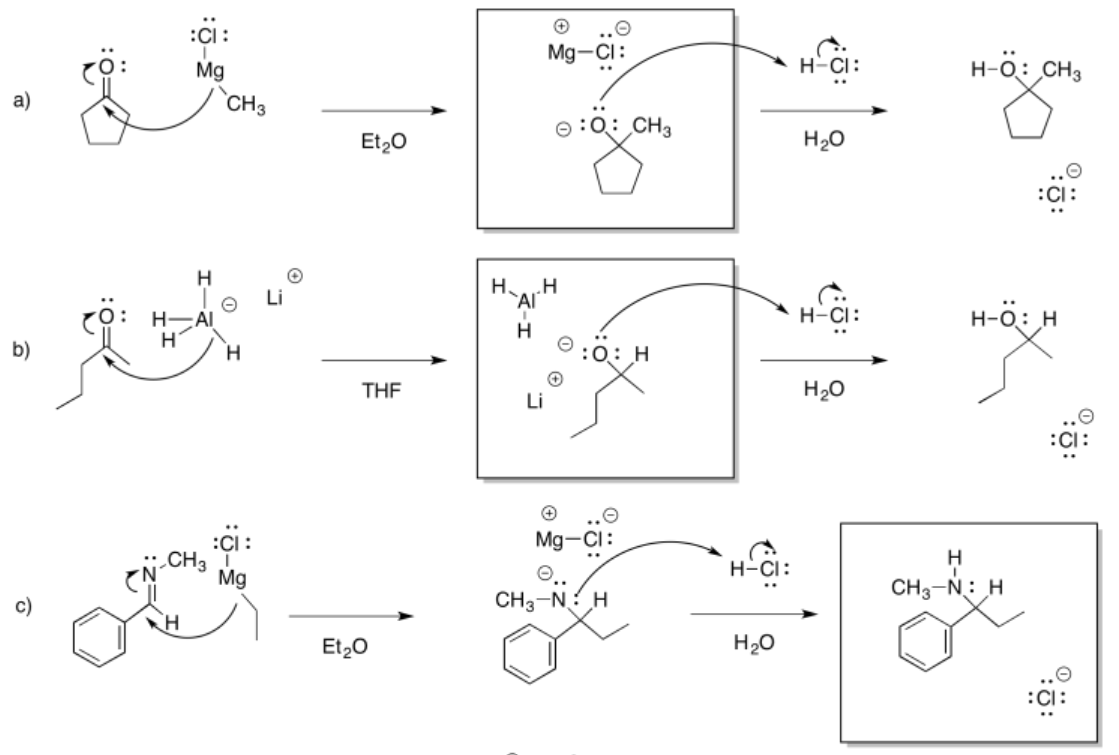
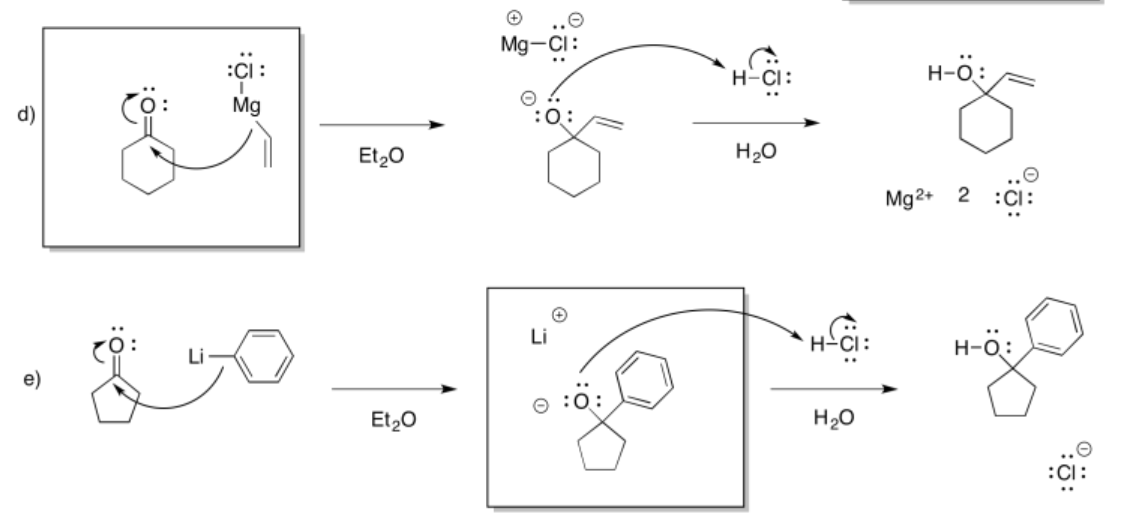
a) pentanol b) 2-butanol c) 4-octanol
d) 2-metilpropan-2-ol o 2-metil-2-pronanol e) 3-metilhexan-2-ol o 3-metil-3-hexanol
f) 5,6-dimetilheptan-1-ol o 5,6-dimetil-1-heptanol
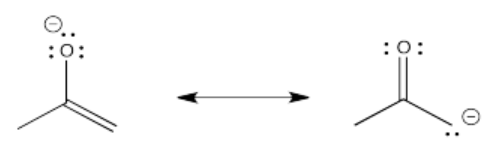
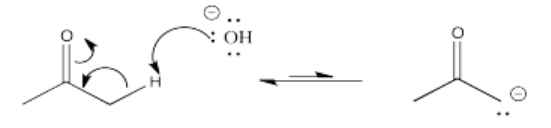
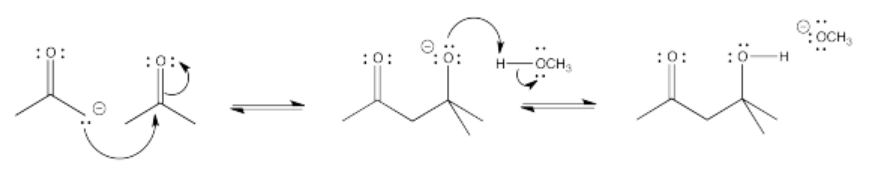
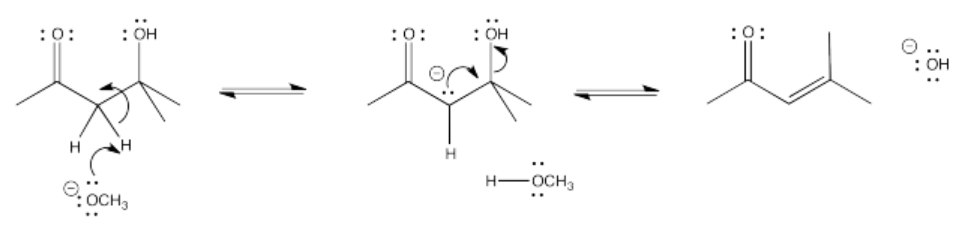
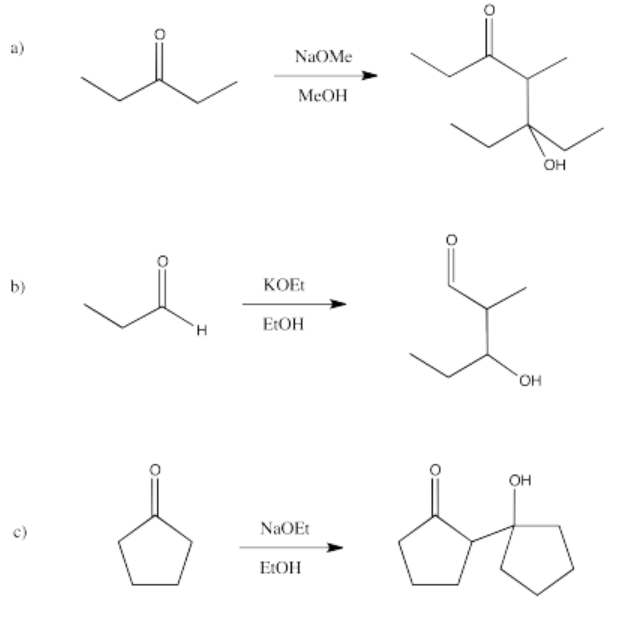
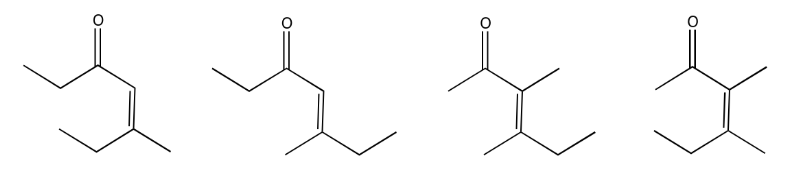
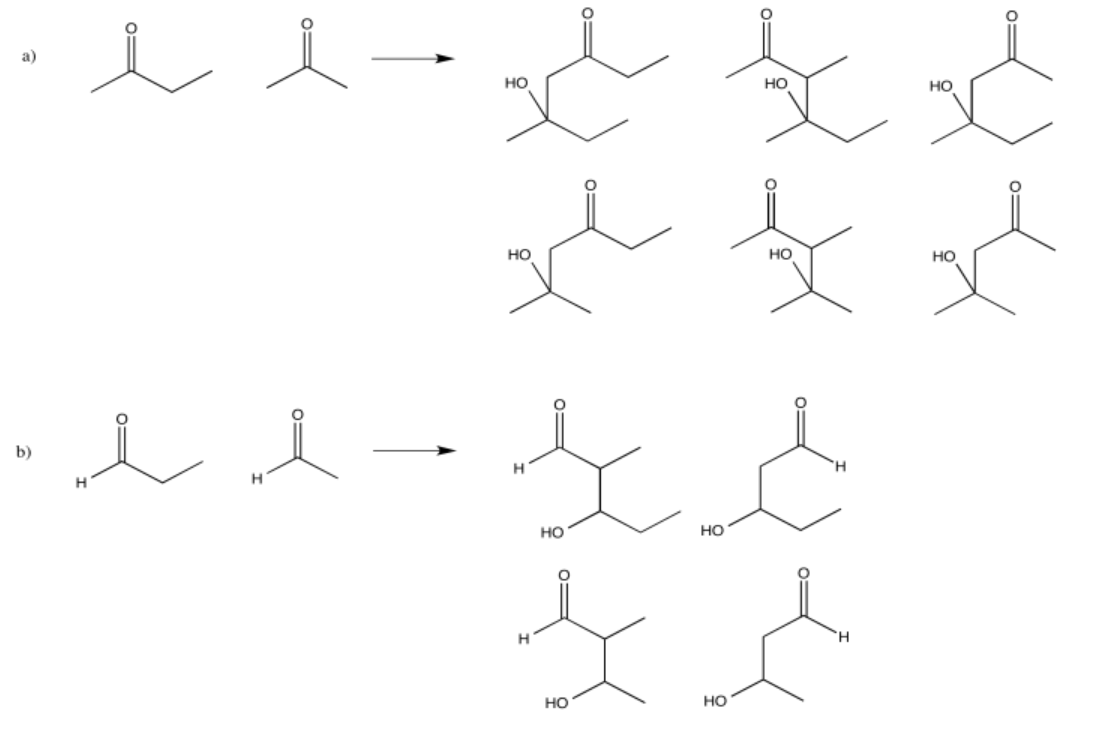
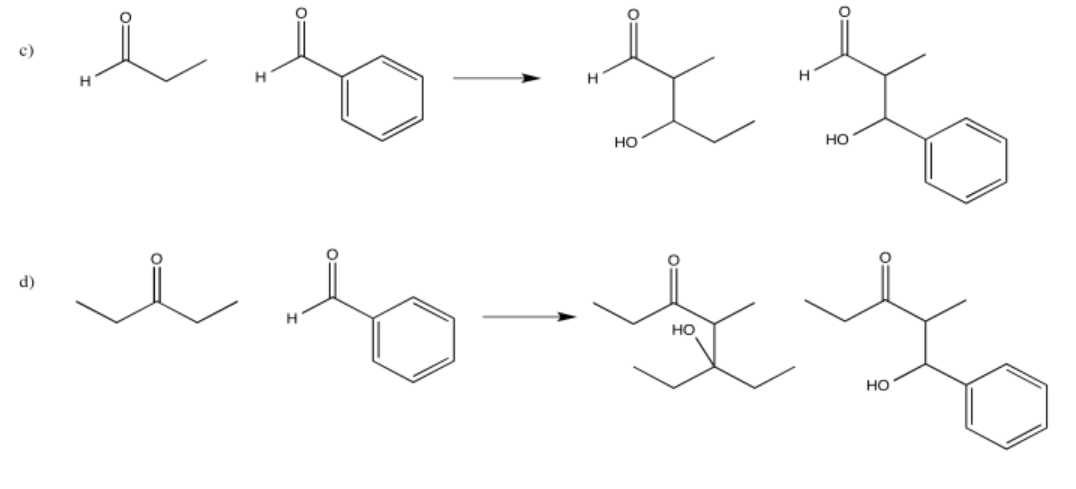
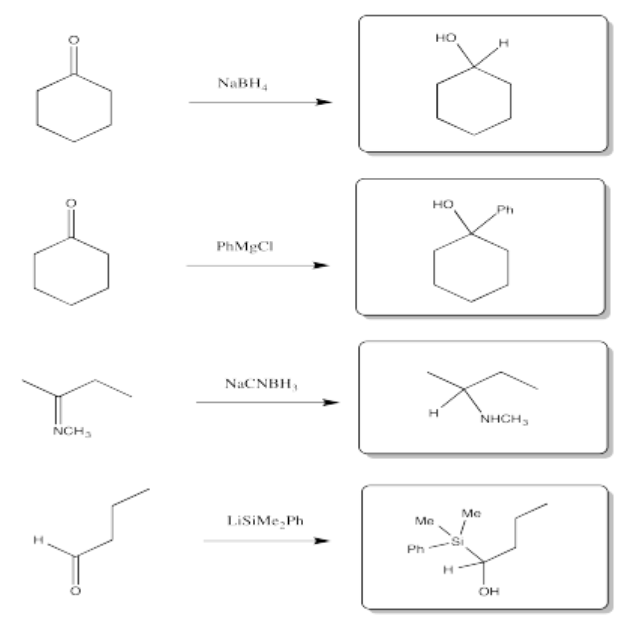
Algunos de estos compuestos no tienen protones alfa, por lo que no pueden formar iones enolados.
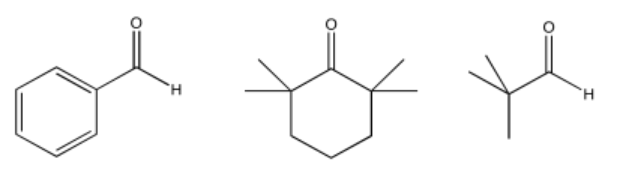
Problema CO12.11.
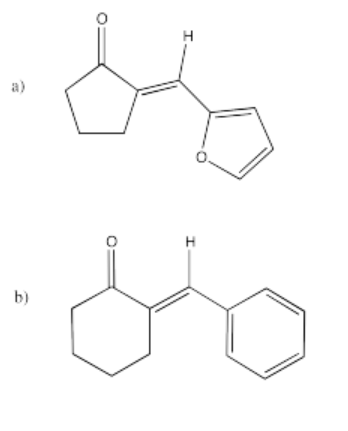
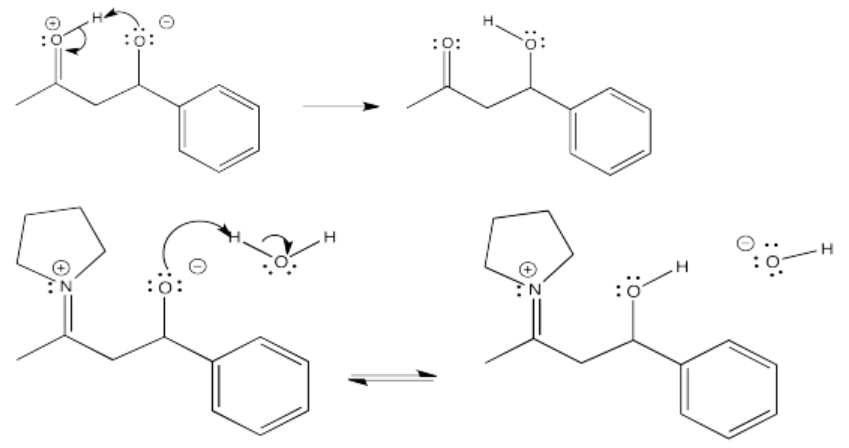
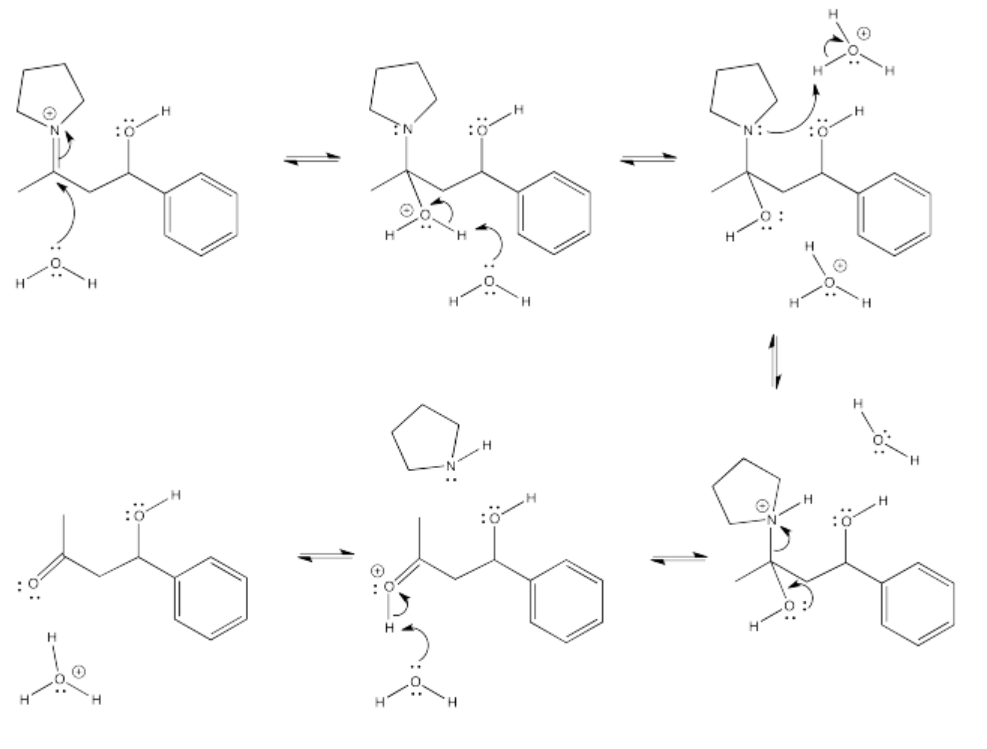
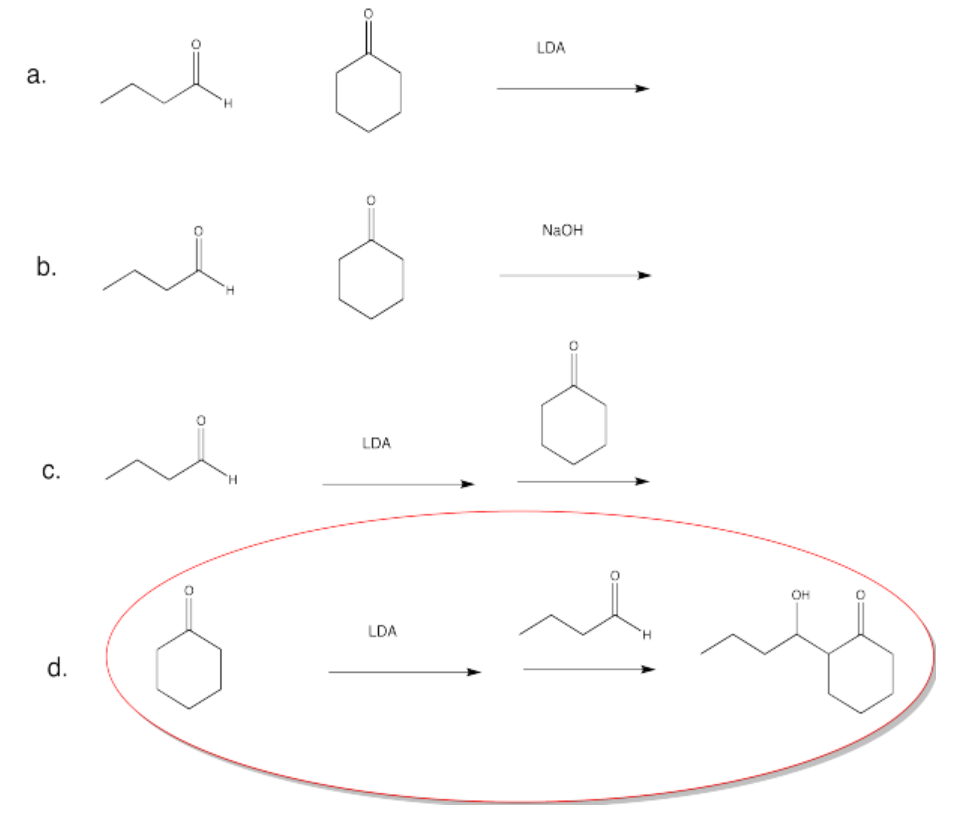
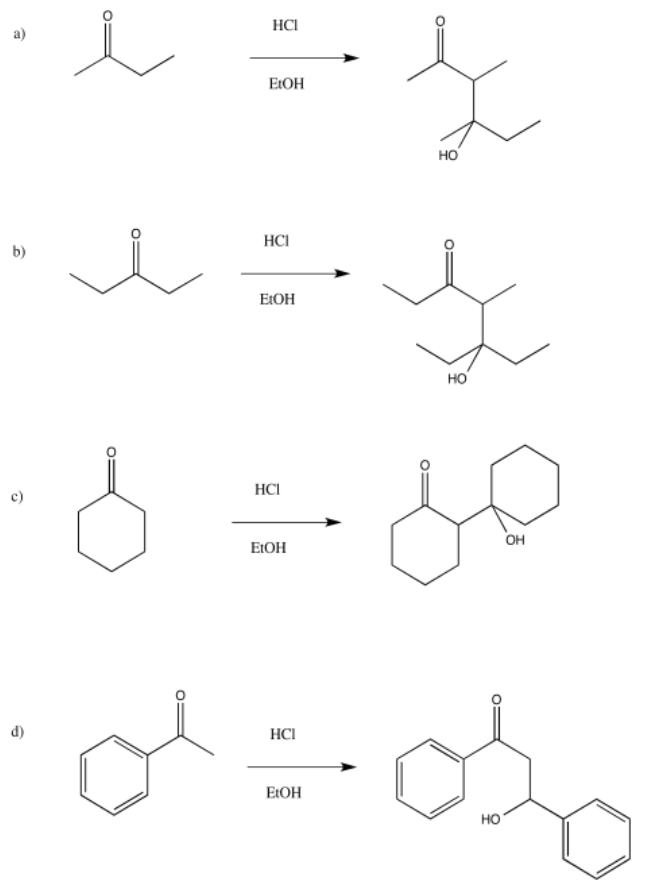
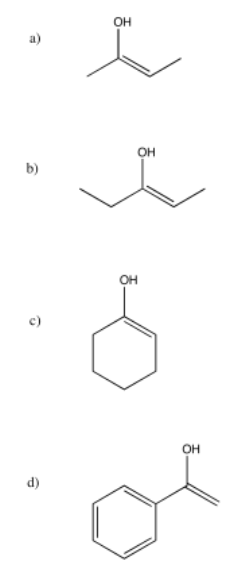
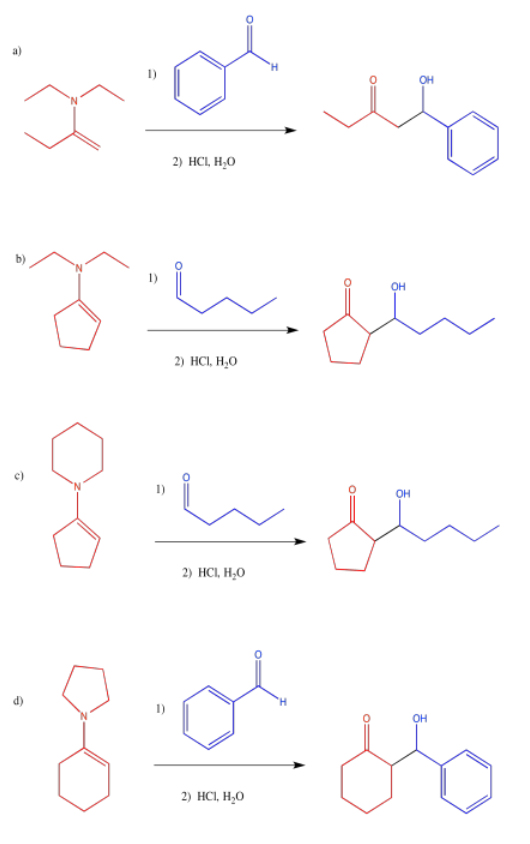
Figura\(\PageIndex{56}\):

