3.21: Los carbonilos son electrófilos
- Page ID
- 79496
El enlace carbonilo es muy polar. Hay una carga positiva parcial en el carbono y una carga parcial negativa en el oxígeno, porque el oxígeno es más electronegativo que el carbono. Esta separación de carga se intensifica debido al doble enlace entre el carbono y el oxígeno. En lugar de simplemente tirar un par de electrones de unión hacia sí mismo, el oxígeno tira dos pares de electrones hacia sí mismo.
- El enlace C=O es muy polar.
- El carbono carbonílico es muy positivo.
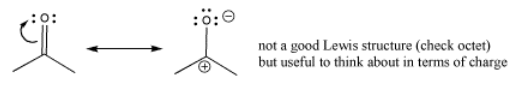
A veces, se dibuja una estructura de resonancia para enfatizar la separación de carga en el carbonilo. La estructura tiene solo un enlace entre el carbono y el oxígeno. En esta estructura, el oxígeno tiene un octeto pero el carbono no. Esta no es realmente una buena estructura de Lewis, porque la otra estructura de resonancia satisface octetos en todos los átomos. Sin embargo, esta estructura de Lewis enfatiza la polaridad del vínculo y a veces se dibuja para reforzar esa idea.
Debido a la carga positiva en el carbono carbonilo, el tema más importante en la química del carbonilo es la reacción del carbonilo como un ácido de Lewis. Las reacciones de los carbonilos casi siempre implican la adición de un donante de electrones al carbono carbonilo.
- Electrofilo es otro término para el ácido de Lewis.
- Los ácidos de Lewis atraen electrones.
- Los ácidos de Lewis tienen una carga positiva en un átomo, una carga positiva parcial en un átomo o un átomo que carece de octeto.
- Los compuestos carbonílicos son buenos electrófilos.
La electrofilicidad de los carbonilos es muy importante en su reactividad. El objetivo de este capítulo es desarrollar una comprensión de cómo reaccionan los carbonilos. Aprenderemos sobre algunos factores clave que se utilizarán en diferentes combinaciones bajo diferentes circunstancias. Eventualmente, construirás un entendimiento que te permitirá seguir tanto las reacciones biológicas como las reacciones sintéticas modernas.
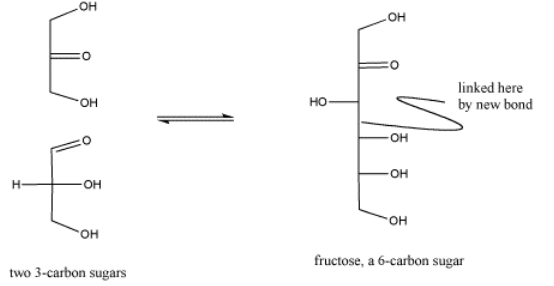
Es importante darse cuenta de que las reacciones biológicas, como la síntesis de carbohidratos, son muy complejas y pueden implicar muchos, muchos pasos. Por ejemplo, la síntesis de carbohidratos mostrada anteriormente implica etapas ácido-base adicionales así como una reacción de un carbonilo. Las etapas ácido-base adicionales pueden involucrar donantes y aceptores de protones así como ácidos de Lewis más generales.
Ejercicio\(\PageIndex{1}\)
Problema CO2.1.
a) Explicar por qué el carbono en una unidad C=O es muy electrófilo, pero el carbono en una unidad C-O lo es mucho menos.
b) Proponer otros enlaces carbono-heteroátomo que puedan hacer que el carbono sea electrófilo (heteroátomo significa no carbono ni hidrógeno).
- Contestar a
-
El doble enlace significa que dos pares de electrones se comparten entre el carbono y el oxígeno, en lugar de solo uno. Como resultado, el oxígeno es capaz de alejar más densidad de electrones del carbono. El carbono se vuelve mucho más positivo en este caso que en el caso de un doble enlace.
No sólo eso, sino que el segundo enlace entre el carbono y el oxígeno es un enlace pi. Esos electrones están más lejos del núcleo que un enlace sigma, en el que los electrones están fuertemente retenidos entre los átomos. Eso significa que los electrones pi son atraídos más fácilmente hacia el oxígeno, por lo que el enlace se polariza aún más.
- Respuesta b
-
Un enlace C=N sería muy similar a un enlace C=O, porque el nitrógeno es el tercer elemento más electronegativo después del oxígeno y el flúor (ignorando los gases nobles).
Ejercicio\(\PageIndex{2}\)
Problema CO2.2.
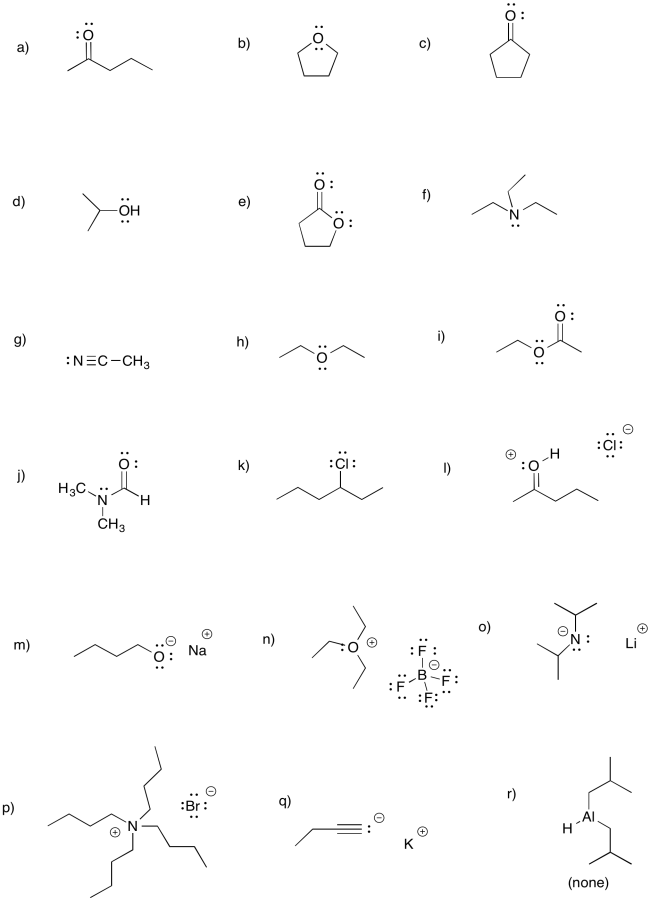
Proporcionar estructuras de línea para los siguientes compuestos.
- Contestar
-
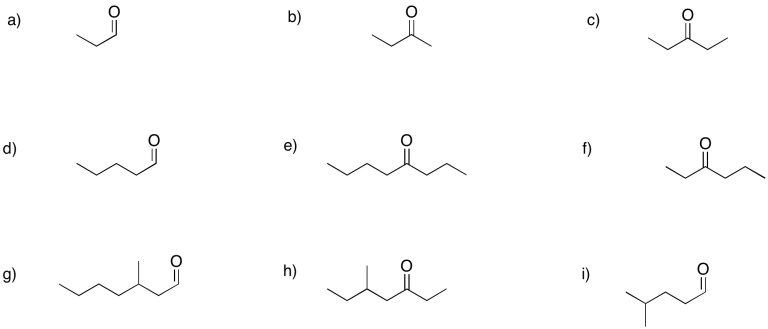
Ejercicio\(\PageIndex{3}\)
Problema CO2.3.
Traduzca las siguientes fórmulas condensadas en estructuras Lewis-Kekule (es decir, como estructuras de Lewis, pero use líneas para enlaces). Todos los compuestos son adehídos o cetonas.
a) CH 3 CH 2 CH 2 CH 2 COCH 3 b) ((CH 3) 2 CH 2 CH 2 COCH 3 c) CH 3 CH 2 CH 2 CH 2 CH (CH 3) COCH 3
d) CH 3 CH 2 CH 2 COCH 2 CH 3 e) CH 3 CH 2 CH 2 COCH 2 CH 2 CH 3 f) CH 3 CH 2 CC (CH 3) COCH 2 CH 3
g) CH 3 CH 2 CH 2 CH 2 CHO h) ((CH 3) 2 CH 2 CHO i) CH 3 CH 2 CH (CH 3) CHO
j) CH 3 CH 2 CH 2 CH (CH 2 CH 3) CHO k) ((CH 3) 3 CH 2 CH 2 CHO l) CH 3 CH 2 CH (CH 3) CH (CH 3) CHO
m) CH 3 CH 2 OCH 2 CH 2 CHO n) CH 3 CHClCH 2 COCH 3 o) CH 3 CH 2 CH (NH 2) COCH 2 CH 3
p) CH 3 CHCHCH 2 COCH 3 q) CH 3 CH 2 CCCH 2 COCH 3 r) C 6 H 5 CHO
- Contestar
-
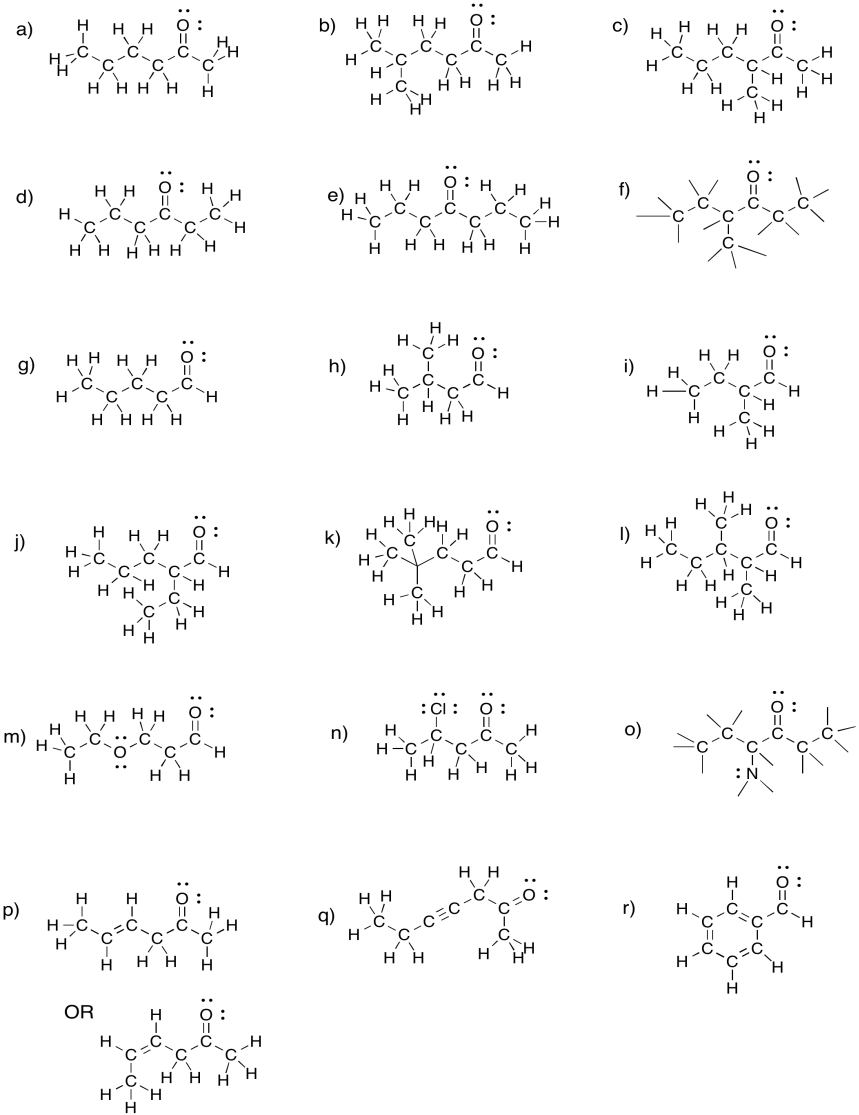
Ejercicio\(\PageIndex{4}\)
Problema CO2.4.
Traducir las fórmulas condensadas del problema anterior en estructuras lineales.
- Contestar
-
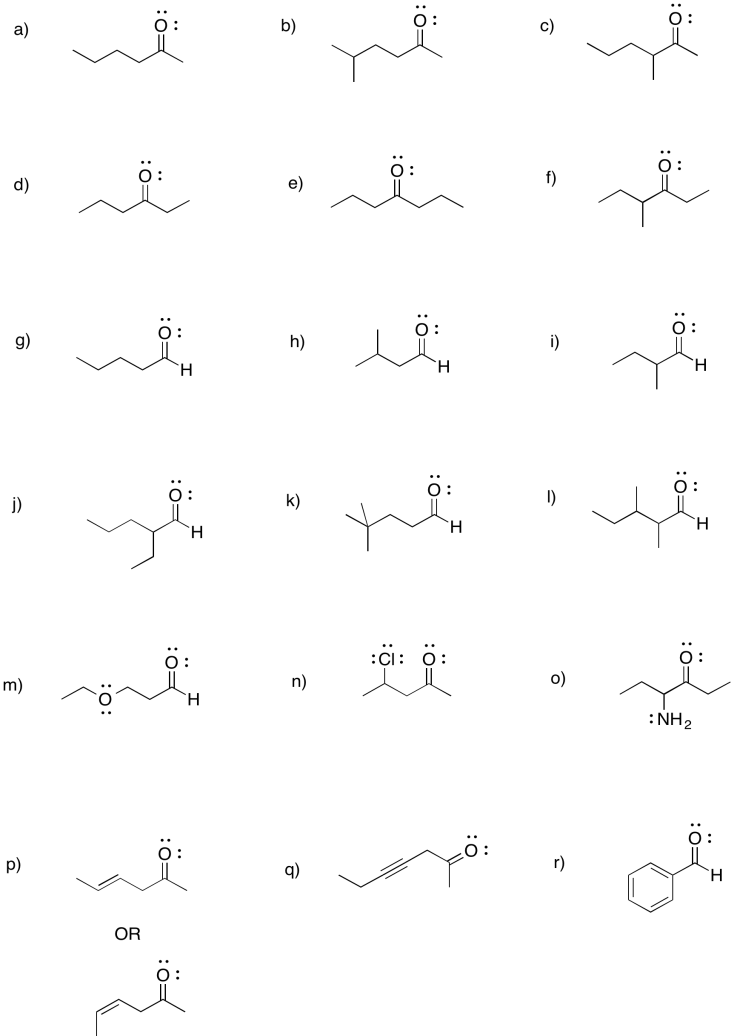
Ejercicio\(\PageIndex{5}\)
Proporcionar nombres IUPAC para los compuestos en el problema anterior. Para obtener ayuda, consulte la sección del grupo funcional, carbonilos simples.
- Contestar a
-
2-hexanona o hexan-2-ona
- Respuesta b
-
5-metilhexan-2-ona
- Respuesta c
-
3-metilhexan-2-ona
- Respuesta d
-
hexan-3-ona
- Respuesta e
-
heptan-4-ona
- Respuesta f
-
4-metilhexan-3-ona
- Respuesta g
-
hexanal
- Respuesta h
-
3-metilbutanal
- Contestar i
-
2-metilbutanal
- Responder j
-
2-etilpentanal
- Responder k
-
4,4-dimetilpentanal
- Contesta l
-
2,3-dimetilpentanal
- Contestar m
-
3-etoxipropanal
- Responder n
-
4-cloropentan-2-ona
- Responder o
-
4-aminohexan-3-ona
- Responder p
-
hex-4-en-2-ona (en la solución anterior, se muestra primero (E) -hex-4-en-2-ona y (Z) -hex-4-en-2-ona se muestra en segundo lugar).
- Contestar q
-
hept-4-in-2-ona
- Responder r
-
benzaldehído (este es un nombre común adoptado para la denominación formal. Benz significa un carbono unido a un anillo de benceno.)
Ejercicio\(\PageIndex{6}\)
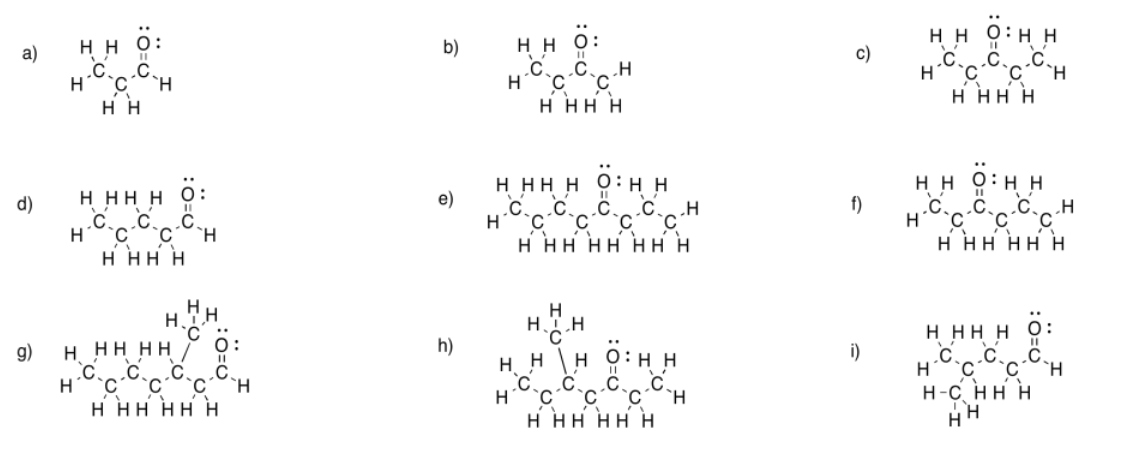
Rellene los pares solitarios faltantes en las siguientes estructuras.
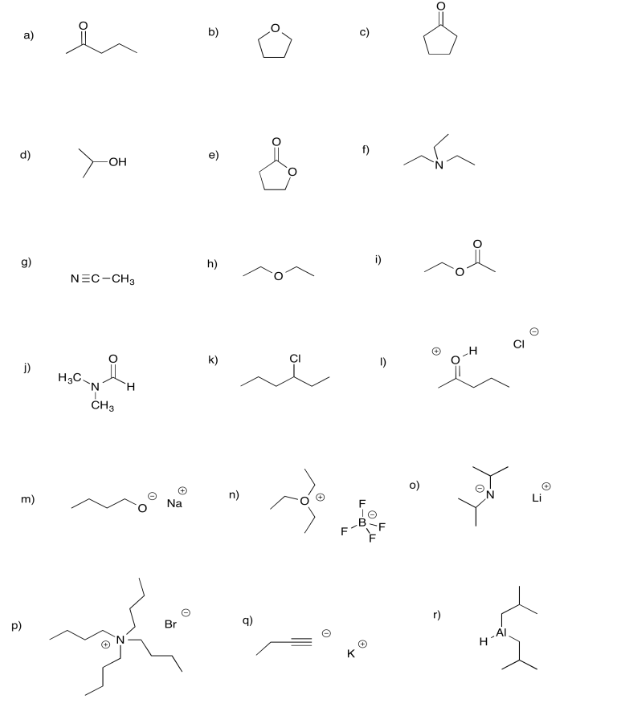
Figura\(\PageIndex{4}\):
- Contestar
-