5.8: Interconversión- Bajando
- Page ID
- 79241
La curva de energía potencial que une los carboxiloides se puede utilizar como guía de cómo estos compuestos pueden ser interconvertidos. En general, es posible tomar un compuesto que es más alto en el cerro de esquí y convertirlo en un compuesto que es más bajo en el cerro de esquí.
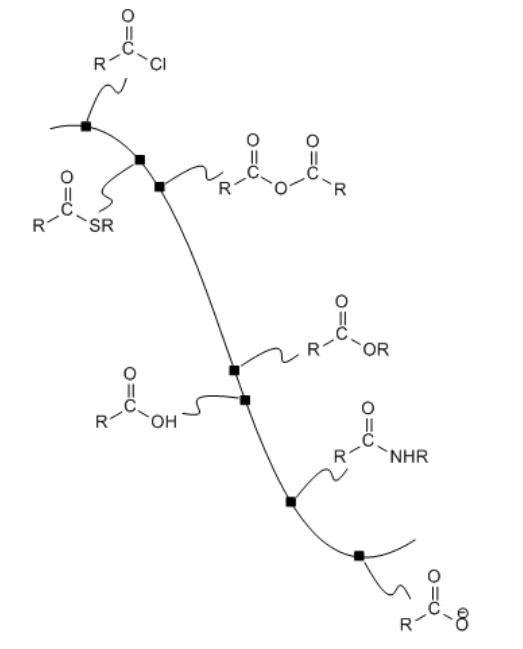
Figura\(\PageIndex{1}\): La superficie de energía potencial que une los carboxloides.
Por ejemplo, los cloruros de ácido son ampliamente utilizados para elaborar otros carboxiloides. Al elegir el nucleófilo correcto, un cloruro de ácido podría convertirse en cualquiera de los otros derivados. Este es realmente el objetivo de un cloruro de ácido; no tiene otra función que proporcionar una manera fácil de hacer otros derivados.
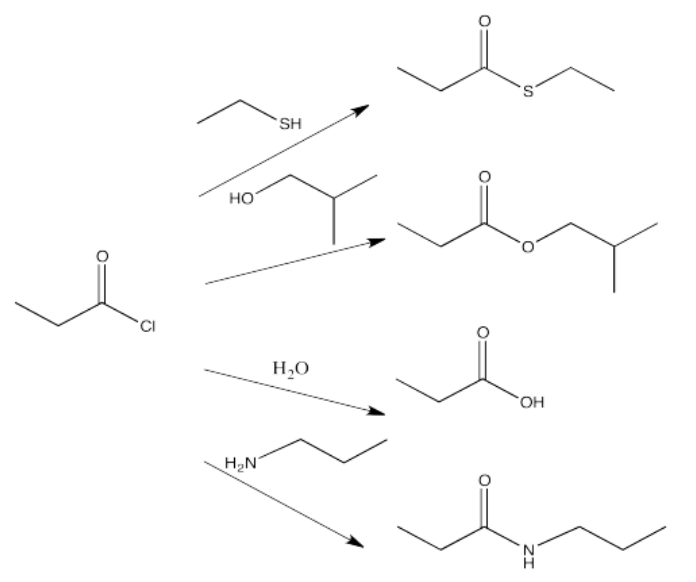
Los anhidridos de ácido, también altos en la curva de energía potencial, también se utilizan de la misma manera. Podrían ser utilizados para hacer cualquiera de los derivados más bajos de lo que son en la colina de esquí. A su vez, los anhidridos de ácido podrían estar hechos de cloruros de ácido. Sin embargo, debido a que un anhídrido de ácido juega el mismo papel que un cloruro de ácido —proporcionando una fuente con la que hacer los otros derivados— normalmente no haríamos un anhídrido de ácido a partir de un cloruro de ácido. O bien haríamos uno de los otros derivados directamente del cloruro de ácido, o bien lo haríamos a partir de un anhídrido de ácido que se obtuvo de otra manera.
Ejercicio\(\PageIndex{1}\)
Muestra todas las formas en que podrías hacer los siguientes compuestos bajando por la colina de esquí. (Mostrar el material de partida, el reactivo agregado y una flecha de reacción que va al producto.) Para obtener ayuda con los nombres, consulte el apéndice.
- propanoato de etilo
- ácido butanoico
- N-metilhexanamida
- pentanoato de tioetilo
- octanoato de potasio
- Responder
-

Ejercicio\(\PageIndex{2}\)
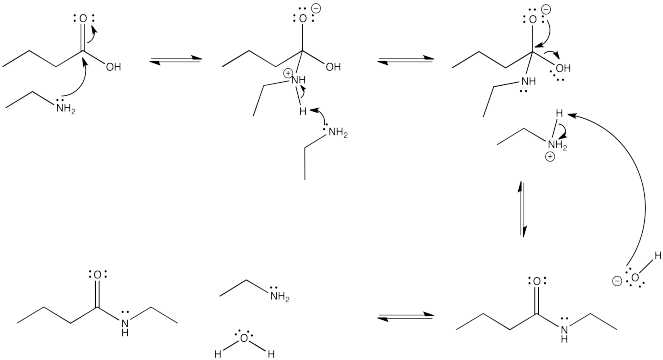
La conversión de un ácido carboxílico en una amida se complica por una reacción secundaria, como resultado de lo cual la formación de amida se convierte en un proceso cuesta arriba.
- Mostrar el mecanismo para la conversión del ácido butanoico en N-etilbutanamida mediante la adición de etilamina.
- Mostrar la reacción secundaria que ocurriría fácilmente entre estos dos reactivos.
- Explique por qué la formación de amidas se convierte en un proceso cuesta arriba como resultado de esta reacción.
- Responder
-
En ocasiones, dos carboxiloides están lo suficientemente cerca en la colina de esquí como para que sea posible convertir en cualquier dirección entre ellos. En otras palabras, existe un equilibrio entre estos dos compuestos, y la constante de equilibrio está lo suficientemente cerca de la unidad (K = 1) para que el equilibrio pueda empujarse en cualquier dirección.
Para casos seleccionados, podemos elegir en qué dirección irá el equilibrio cambiando las condiciones de reacción. Para ello, podemos utilizar un importante concepto de equilibrio: el principio de le Chatelier (luh Sha-tell-yay). Según le Chatelier, si las condiciones en la reacción hacen que la reacción se aleje del equilibrio, la reacción cambiará de dirección hasta que vuelva a estar en equilibrio nuevamente. En otras palabras, si la relación real de reactivos a productos se aleja de lo que debería ser, se producirá la reacción correcta para que la relación vuelva a la normalidad.
El principio de le Chatelier debe ser en parte intuitivo. Si se está produciendo una reacción en ambas reacciones, realmente hay dos reacciones, una va en cada dirección. La capacidad de estas reacciones para ocurrir depende en parte de la cantidad de reactivos disponibles para la reacción directa o la reacción inversa. Si se agregan materiales de partida adicionales (en el lado izquierdo de la reacción), hay demasiado reactivo como se define por la constante de equilibrio. El denominador se agrava y la relación de productos a reactivos disminuye. Sin embargo, debido a que hay material de partida extra para la reacción directa, se hace más producto rápidamente, hasta que la relación vuelve a la normalidad.
La situación opuesta aplica si se hace demasiado producto. Desde el punto de vista de la reacción inversa, esos productos de la reacción directa son realmente los reactivos necesarios para ir en sentido contrario. La reacción inversa tiene más material para trabajar, y este material se puede convertir rápidamente en la materia en el lado izquierdo de la reacción.
Ejercicio\(\PageIndex{3}\)
Dibujar el mecanismo para la conversión de:
- propanoato de hexilo a ácido propanoico.
- ácido propanoico a propanoato de hexilo.
- Responder a
-
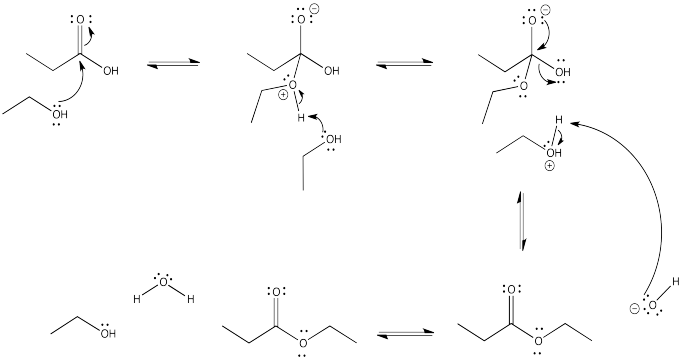
- Respuesta b
-
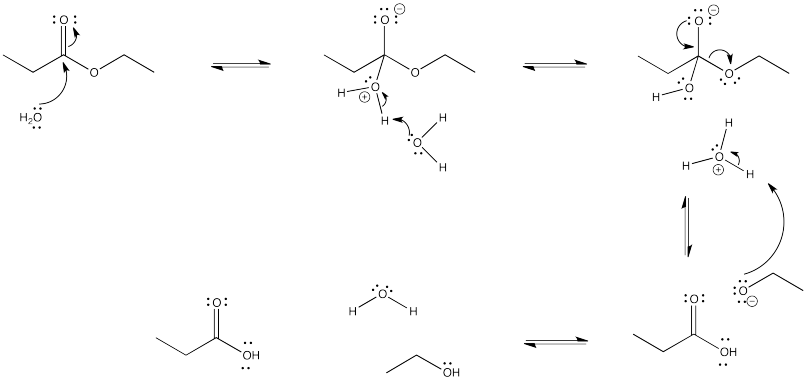
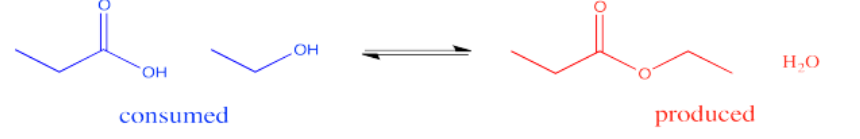
En la interconversión de carboxiloides, el equilibrio puede ser influenciado de diferentes maneras. La conversión entre ésteres y ácidos carboxílicos puede estar influenciada por el disolvente utilizado para la reacción. Por ejemplo, un éster podría convertirse en un ácido carboxílico en condiciones acuosas, pero un ácido carboxílico podría convertirse en un éster usando el alcohol apropiado como disolvente. En otras palabras, debido a que el agua y el alcohol pueden verse como reactivos en estos casos, agregar más puede desplazar la reacción hacia un lado. El solvente suele estar presente en concentraciones muchas decenas o cientos o miles de veces superiores a las de los reactivos y productos. Por lo tanto, cambiar el solvente tiene un gran impacto en la dirección del equilibrio.
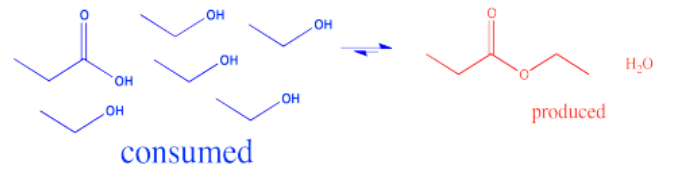
Otra estrategia utilizada para influir en el equilibrio implica la remoción del producto. Por ejemplo, si el agua es un producto de la reacción, se puede agregar un agente secante para absorber el agua. Los agentes secantes incluyen compuestos como MgSO 4 o zeolitas (aluminosilicatos mixtos que contienen Al, Si, O y otros iones metálicos como Mg 2+, Ca 2+ o Ti 4+).
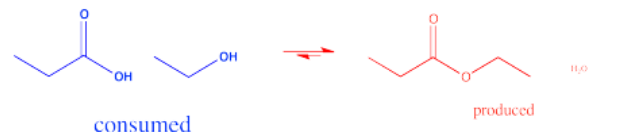
Si un ácido carboxílico es producto de una reacción, su concentración puede ser disminuida convirtiéndolo en una sal carboxilato; esto sucedería fácilmente en presencia de base. En cualquier caso, la desaparición de un producto de la reacción (o un producto secundario) arrastraría la reacción hacia la derecha para reemplazar esos productos y restablecer la relación de equilibrio correcta.
Ejercicio\(\PageIndex{4}\)
Mostrar, con flechas curvas, cómo un ion magnesio podría eliminar el agua de la solución.
- Responder
-

Ejercicio\(\PageIndex{5}\)
Mostrar, con flechas curvas, cómo el hidróxido de sodio eliminaría el ácido butanoico de la solución.
- Responder
-

Ejercicio\(\PageIndex{6}\)
Para cada
una de las siguientes reacciones: a. Predecir el nucleófilo que se necesitaría para elaborar este producto.
b. Con base en la ubicación en el cerro, ¿se vería favorecida termodinámicamente esta reacción?
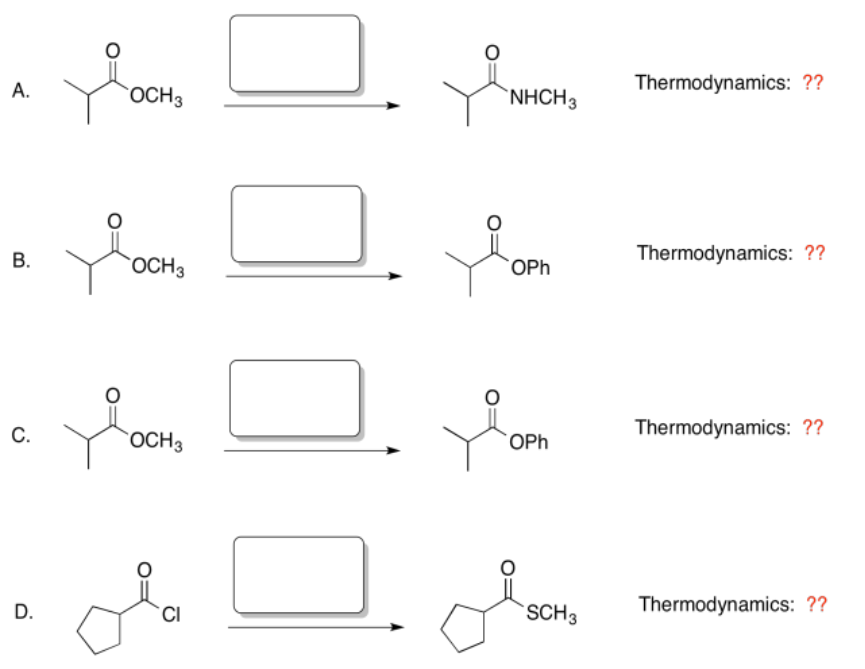
Responder-

Ejercicio\(\PageIndex{7}\)
Rellene los intermedios faltantes y agregue flechas curvas para mostrar el movimiento de electrones.
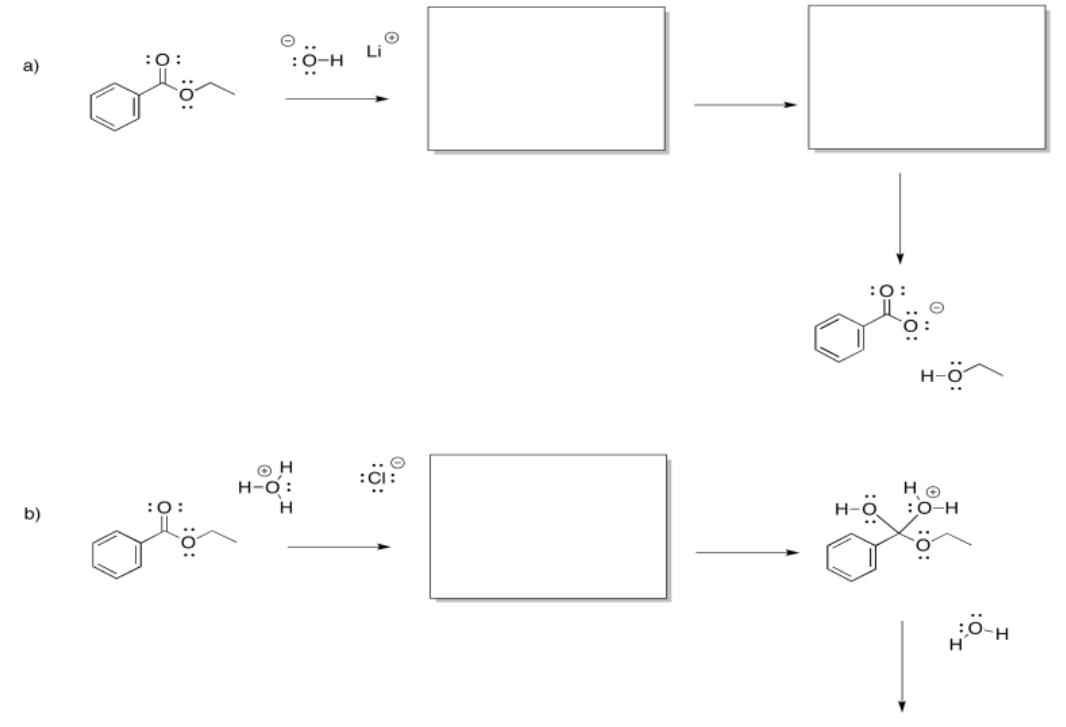
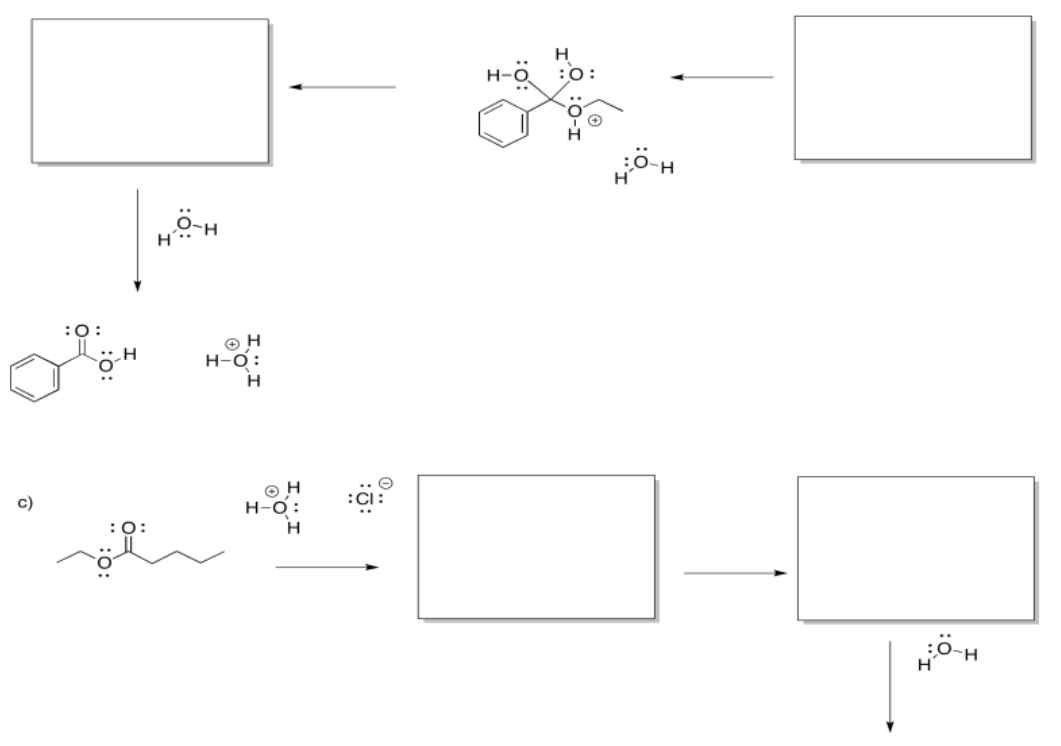
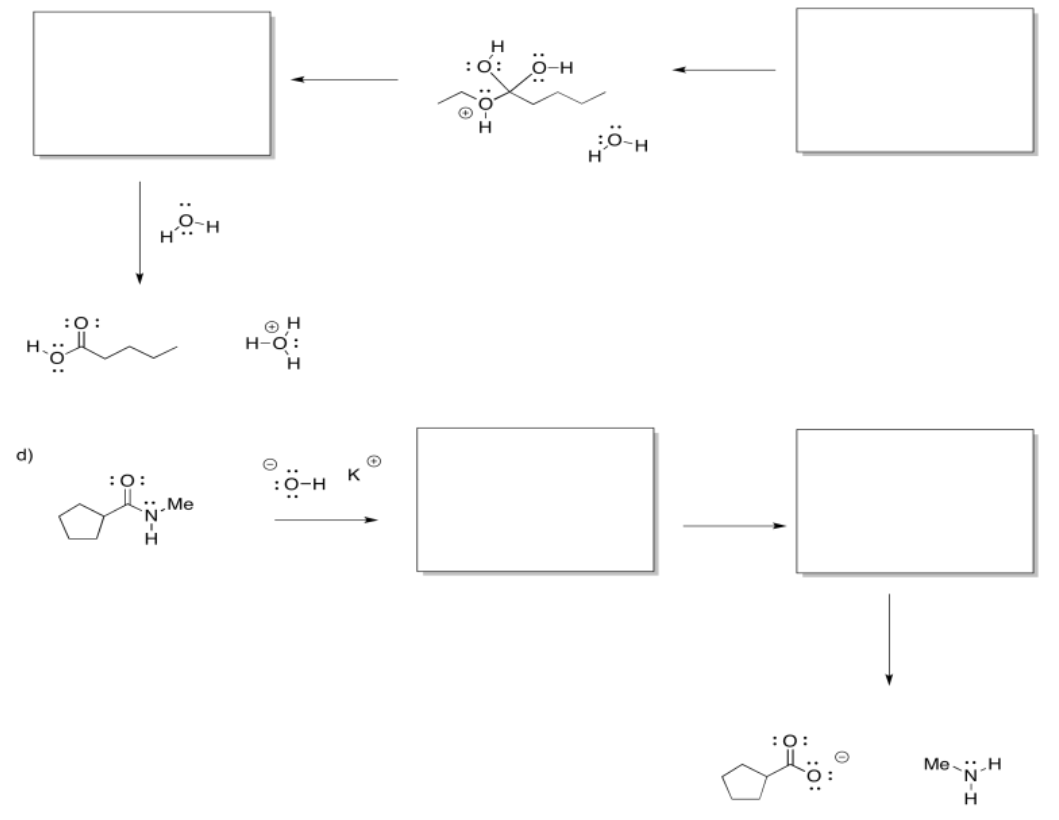
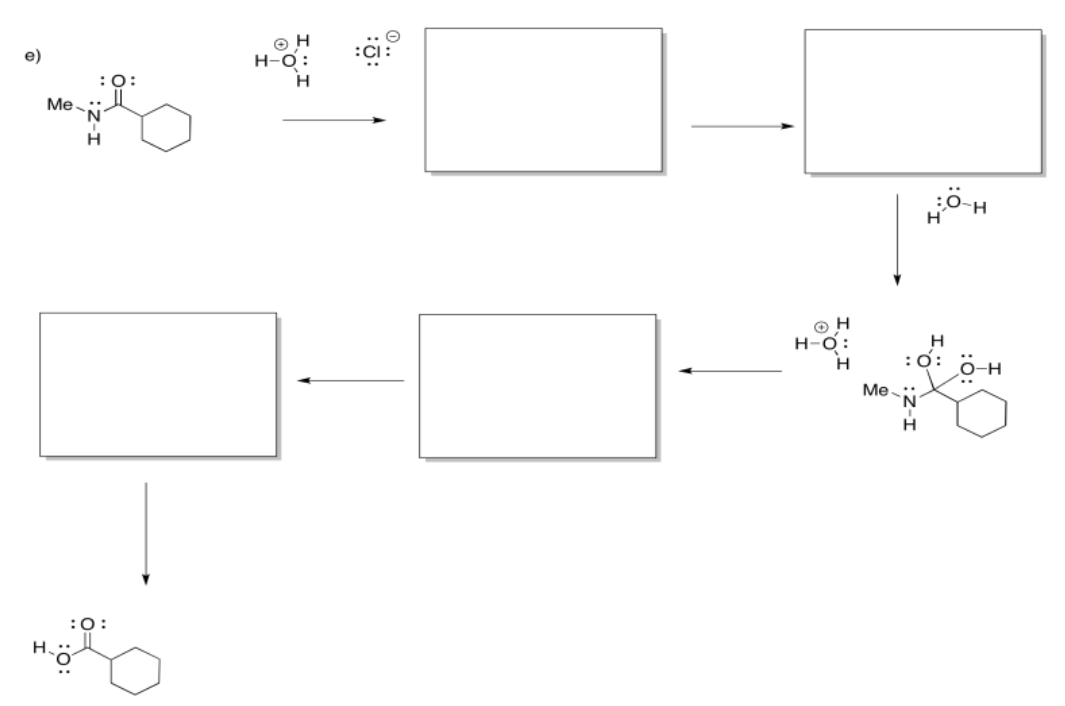
Responder-


