5.10: Nucleófilos Semi-Aniónicos
- Page ID
- 79243
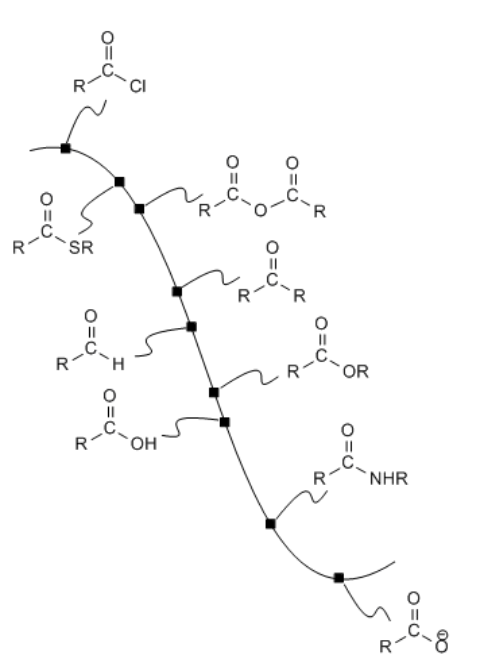
Los carboxiloides se pueden interconvertir mediante la adición de nucleófilos heteroatómicos típicos: aminas, alcoholes, tioles y agua. Además, otros nucleófilos pueden desplazar al “grupo lábil” sobre un carboxiloide, siempre que el nucleófilo sea lo suficientemente reactivo.
Ejercicio\(\PageIndex{1}\)
¿Podría un haluro, como el bromuro o el cloruro, reemplazar fácilmente a un grupo eliminable carboxiloide? Explique.
- Contestar
-
Debido a que los cloruros de ácido están en la parte superior del diagrama de reactividad de carboxiloides (la colina de esquí), y es probable que otros haluros sean similares en reactividad al cloruro, esta reacción sería cuesta arriba de los otros carboxiloides.
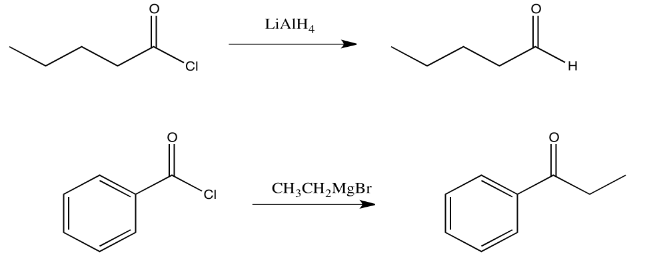
Los aniones de carbono e hidrógeno (o “semianiones”) son muy buenos nucleófilos. Anteriormente, vimos cómo pueden reaccionar con carbonilos simples. Aunque el par solitario en un carbono o un hidrógeno suele estar enmascarado en un enlace covalente con un metal moderadamente electropositivo como el aluminio o el magnesio, ese par de electrones de enlace sigue siendo lo suficientemente nucleófilo como para donar a un buen electrófilo. Estos nucleófilos a menudo pueden reaccionar con derivados de ácido carboxílico.
Ejercicio\(\PageIndex{2}\)
Dibujar un mecanismo para la sustitución del cloruro en cloruro de propanoilo con un hidruro de hidruro de litio y aluminio.
Ejercicio\(\PageIndex{3}\)
Dibujar un mecanismo para la sustitución del cloruro en cloruro de propanoilo por un metilo de cloruro de metilmagnesio.
La adición de un reactivo de Grignard (haluro de alquilmagnesio) a un carboxiloide da como resultado la formación de una cetona. La adición de un reactivo de hidruro complejo (como hidruro de litio y aluminio) a un carboxiloide da como resultado la formación de un aldehído. Ya hemos visto que estos reactivos pueden agregarse a aldehídos y cetonas para proporcionar alcoholes.
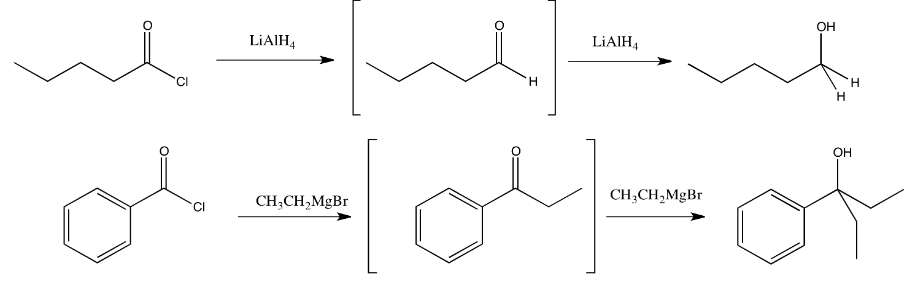
Entonces, ¿qué pasa si se agrega un reactivo de Grignard a un cloruro de ácido o a un anhídrido de ácido? El carboxiloide se convertiría en una cetona. Si aún hay más moléculas de Grignard alrededor, probablemente convertirían la cetona en un ion alcóxido (y finalmente en un alcohol por protonación). El caso es que es muy probable que haya más moléculas de Grignard alrededor. Una reacción tiende a involucrar millones de moléculas reaccionantes, por lo que para cuando los primeros mil o más moléculas de carboxiloide se hayan convertido en cetona, cientos de esas moléculas de cetona ya se han convertido en alcóxido.
En la mayoría de los casos, los reactivos alquílicos y los reactivos de hidruro se agregarán dos veces a los Ellos convertirán el carboxiloide en un aldehído o cetona. Debido a que los aldehídos y cetonas también reaccionan con los nucleófilos de hidruro y alquilo, reaccionarán por segunda vez.
Ejercicio\(\PageIndex{4}\)
Los reactivos de Grignard no afectarán el reemplazo del grupo de salida en los ácidos carboxílicos. Mostrar por qué esa reacción particular no ocurre, con la ayuda de un mecanismo.
Ejercicio\(\PageIndex{5}\)
Los reactivos de Grignard generalmente no reaccionan con amidas ni iones carboxilato. Explique por qué.
Cuando una serie de compuestos varía de más reactivos a menos reactivos en un tipo de reacción particular, surge la posibilidad de selectividad. Algunos reactivos pueden reaccionar con unos pocos carboxiloides, pero no con otros. Por ejemplo, los organocupratos como (CH 3) 2 CuLi, que generalmente no reaccionan bien con aldehídos y cetonas, son muy selectivos en términos de con qué carboxiloides reaccionarán.
Ejercicio\(\PageIndex{6}\)
¿Qué carboxiloides crees que reaccionarán con (CH 3) 2 cULi? Mostrar la reacción en cada caso (el reactivo, reactivo y una flecha de reacción que va al producto). Explica tu razonamiento.
- Contestar
-
Los cloruros de ácido reaccionan típicamente con estos reactivos de cuprato.
Ejercicio\(\PageIndex{7}\)
Los reactivos de hidruro complejo pueden ser muy selectivos hacia los carboxiloides. Por ejemplo, el borohidruro de sodio no es lo suficientemente potente como para reaccionar con ésteres.
- ¿Con cuál de los carboxiloides puede reaccionar el borohidruro de sodio? Explique.
- ¿Con qué otros carboxiloides NO puede reaccionar el borohidruro de sodio? Explique.
- Contestar
-
Los borohidruros podrían reaccionar presumiblemente con cloruros de ácido, anhidridos y tioésteres, que son los carboxiloides más reactivos. Probablemente no puedan reaccionar con amids o iones carboxilato, que están aún más abajo que los ésteres.
Ejercicio\(\PageIndex{8}\)
El hidruro de litio y aluminio puede inducir la sustitución carboxílica con sales carboxilato como el octanoato de sodio.
- ¿Cuál sería el producto final de esta reacción? Explique.
- ¿Con qué otros carboxiloides puede reaccionar el hidruro de litio y aluminio? Explique.
Ejercicio\(\PageIndex{9}\)
a) ¿Cuál es más reactivo: hidruro de litio y aluminio o borohidruro de sodio?
- ¿Cuál es más selectivo: hidruro de litio y aluminio o borohidruro de sodio?
- ¿Cómo se puede explicar la diferencia de reactividad entre el hidruro de litio y aluminio y el borohidruro de sodio?
Ejercicio\(\PageIndex{10}\)
La reacción del hidruro de litio y aluminio con amidas es inusual ya que el producto final de la reacción es generalmente una amina.
- ¿Por qué esta reacción parece ser diferente de otras reacciones carboxiloides?
- Dibuja un mecanismo para esta reacción. (Pista: en algún momento, un átomo de oxígeno dona un par de electrones al aluminio.)
- Proponer una razón por la cual esta reacción de hidruro sigue un camino diferente al de otras reacciones de hidruros con carboxiloides.
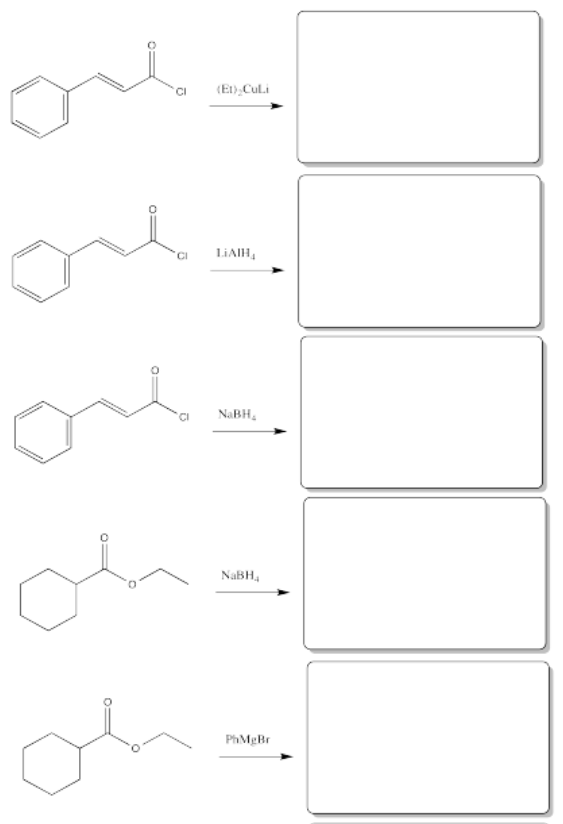
Ejercicio\(\PageIndex{11}\)
Rellene los productos de las siguientes reacciones.
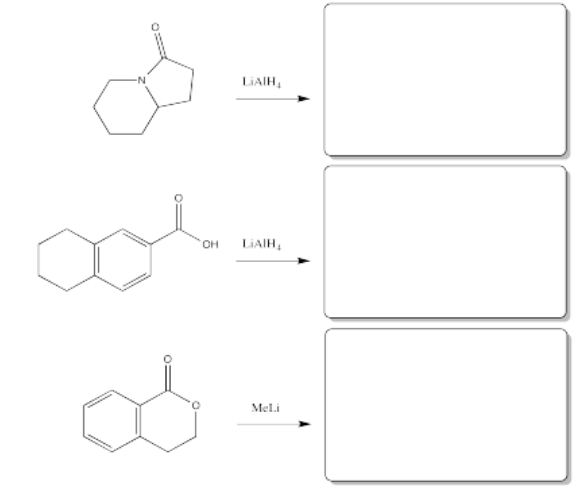
- Contestar
-


