5.11: Condensación y descarboxilación de enolatos - claisen
- Page ID
- 79240
Los reactivos de alquilmagnesio, alquilcupratos e hidruros complejos pueden reaccionar con carboxiloides. Cuando lo hacen, un nucleófilo de carbono o hidrógeno se une al carbono carbonilo, generalmente reemplazando al grupo látigo en esa posición.
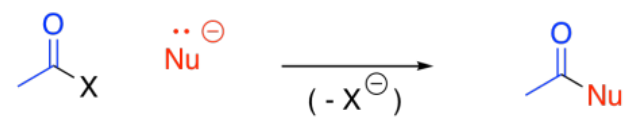
Otro nucleófilo de carbono común es un ion enolato. Los iones enolato también pueden reaccionar con carboxiloides, aunque no típicamente con amidas.
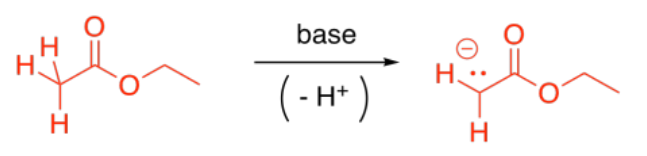
Probablemente la reacción enolato más común que involucra a carboxiloides es la reacción de ésteres. Si se agrega una base fuerte a la solución de éster, algunos de los ésteres se desprotonarán, formando aniones enolados. Estos iones serán nucleófilos.
Algunos ésteres permanecerán protonados. Estos ésteres serán electrófilos. La donación del enolato al éster, con la consiguiente pérdida del grupo saliente, conduce a un beta-cetoéster.
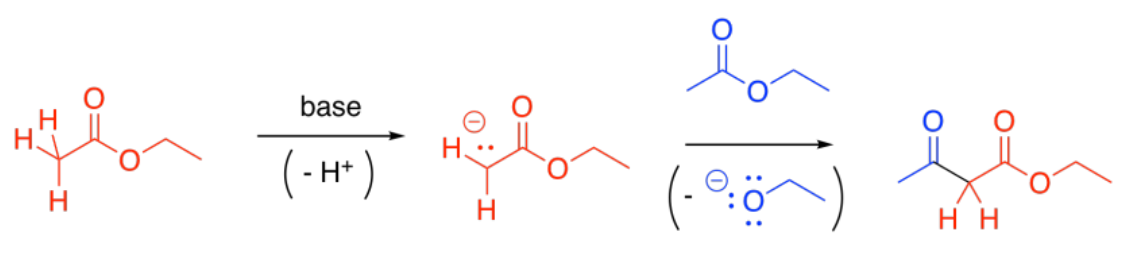
Usted está familiarizado con el término “posición alfa”. Esa es la posición al lado de un carbonilo. La “posición beta” es la siguiente después de la posición alfa. En un beta-cetoéster, hay una cetona en la posición beta del éster. La formación de un beta-cetoéster a partir de dos ésteres se denomina “condensación de Claisen”.
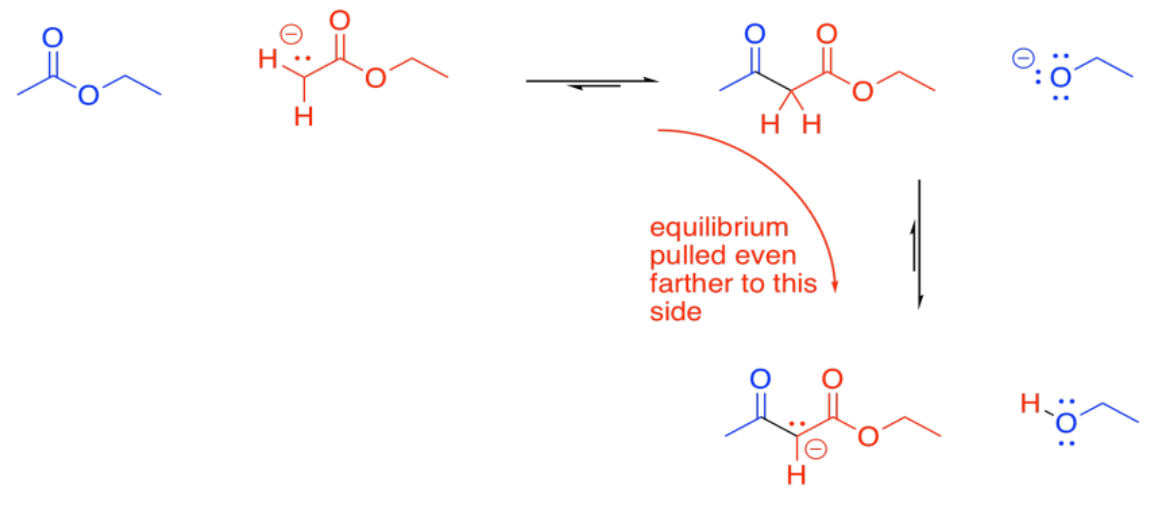
En principio, esta reacción podría concebiblemente ir hacia atrás. El ion enolato podría ser desplazado potencialmente por un alcóxido para volver a un éster y un ion enolato. Eso se debe a que el ion enolato es un ion relativamente estable, y un grupo saliente moderadamente bueno. Sin embargo, eso generalmente no sucede.
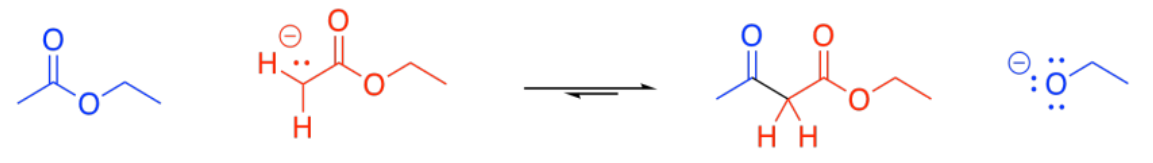
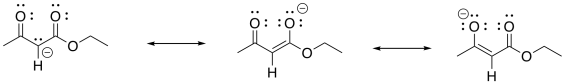
En condiciones básicas, el beta-cetoéster suele ser desprotonado, formando un ion particularmente estable. Esta formación de iones actúa como un “sumidero termodinámico” para la reacción, arrastrándola hacia adelante hasta que se haya consumido todo el éster.
Ejercicio\(\PageIndex{1}\)
Mostrar por qué el ion que resulta de la desprotonación del beta-cetoéster es particularmente estable.
- Contestar
-
Ejercicio\(\PageIndex{2}\)
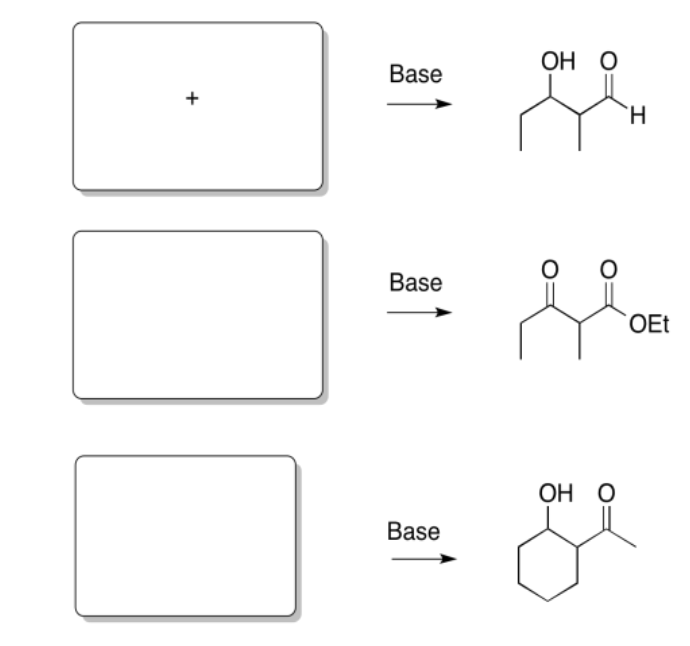
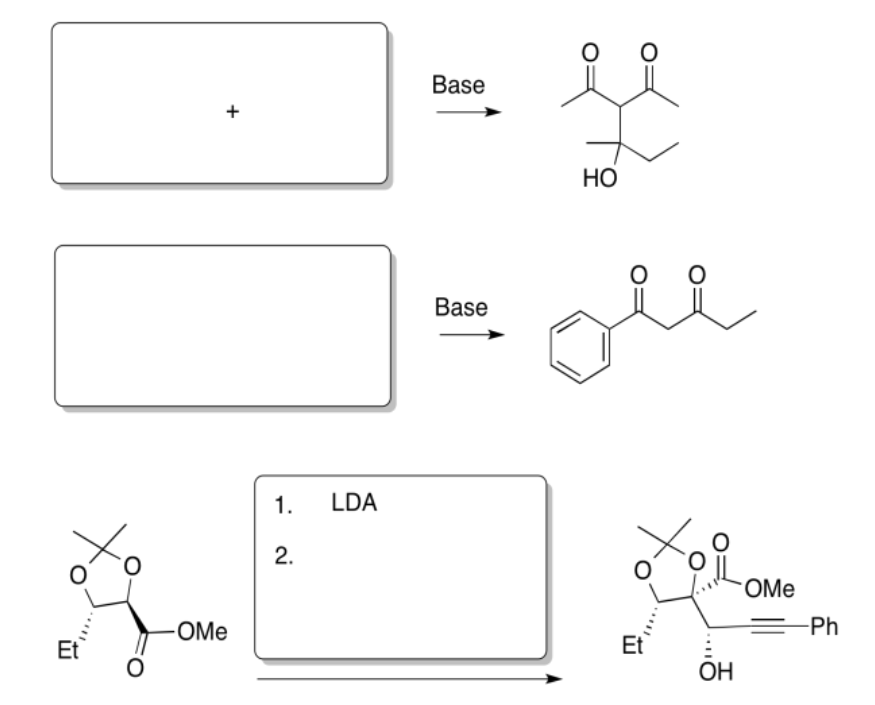
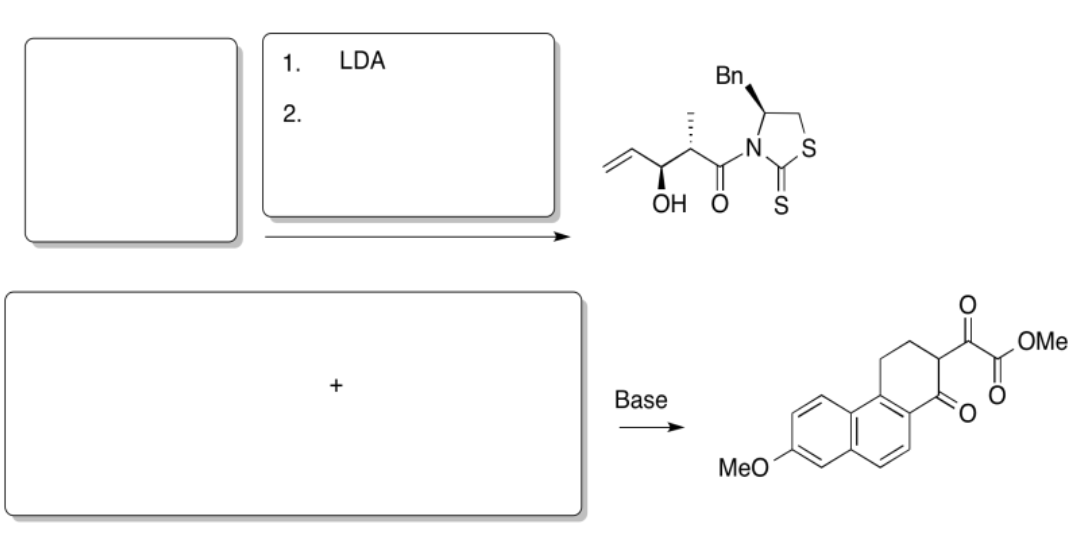
Rellene los productos de las siguientes reacciones.
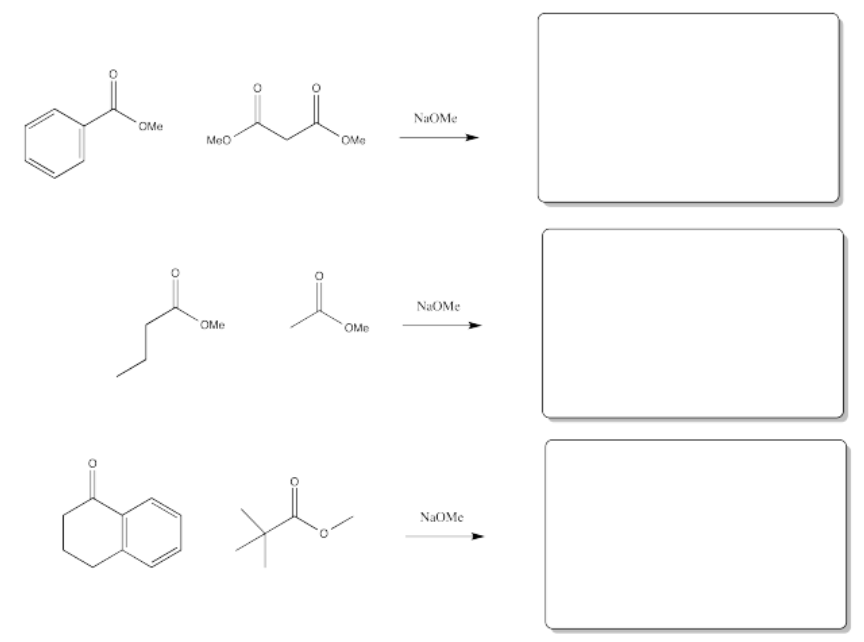
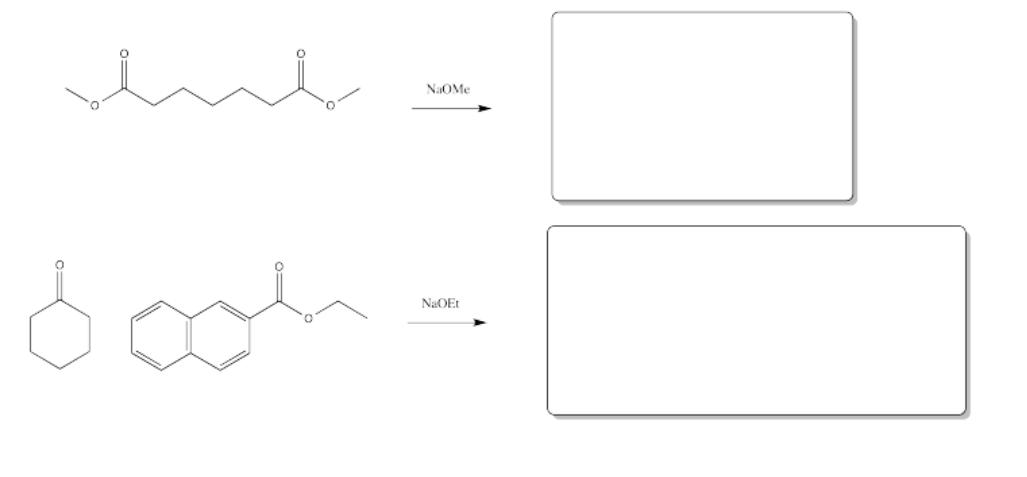
Contestar-
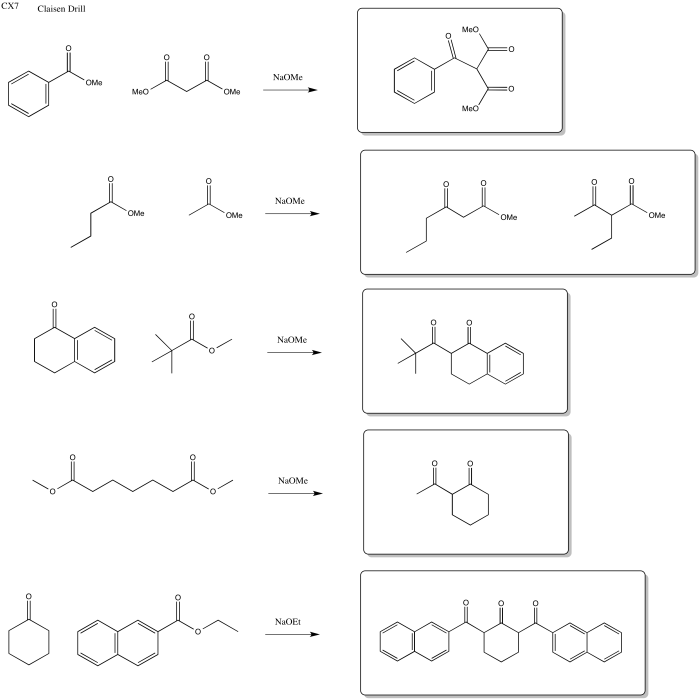
Ejercicio\(\PageIndex{3}\)
Predecir los reactivos necesarios para elaborar estos productos a través de una reacción de Claisen, Aldol o Crossed Aldol.
Contestar-
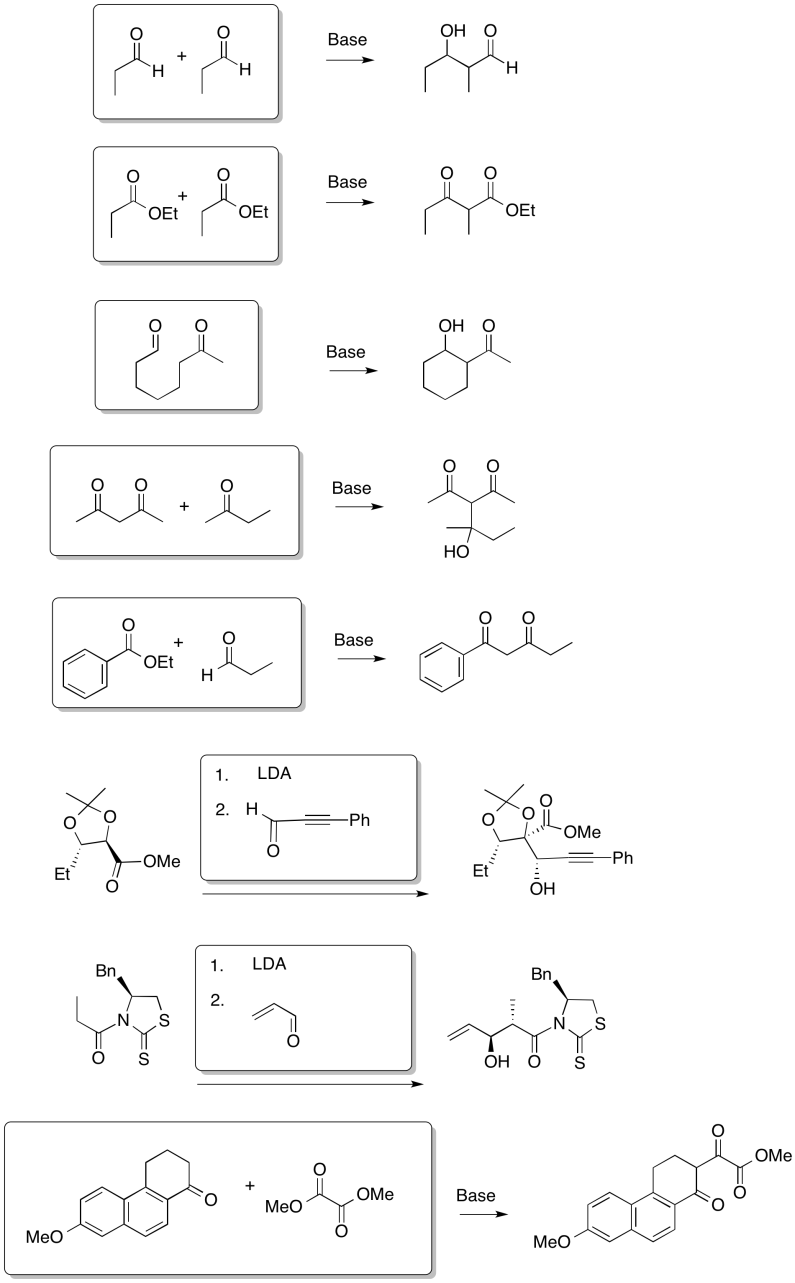
La formación de un beta-cetoéster a partir de dos ésteres se denomina “condensación de Claisen”.

A menudo le sigue otra reacción importante: la descarboxilación. Si un beta-cetoéster se trata con ácido acuoso y se calienta, se producen un par de reacciones. Primero, la porción éster de la molécula se convierte en un ácido carboxílico.
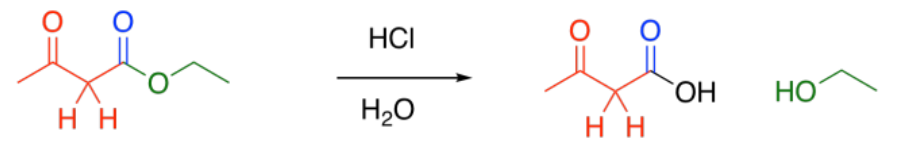
Segundo, el ácido carboxílico es descarboxilado. Se forma dióxido de carbono, y la molécula orgánica se convierte en una cetona. El grupo carboxilo se pierde completamente de la molécula original, y se convierte en CO 2.
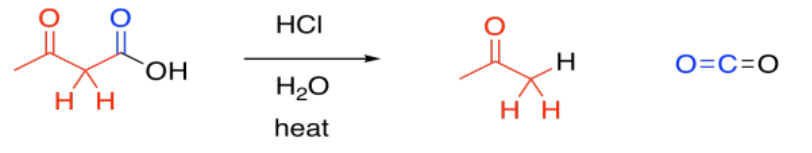
La descarboxilación está relacionada con la reacción retro-aldólica; formalmente, se puede considerar que conduce a un grupo saliente enolato. La descarboxilación ocurre más comúnmente en los beta-cetoácidos, en lugar de en otros ácidos carboxílicos. De lo contrario, ese grupo de salida no podría ocurrir. La facilidad de descarboxilación en beta-cetoácidos está relacionada con la estabilidad del anión enolato.
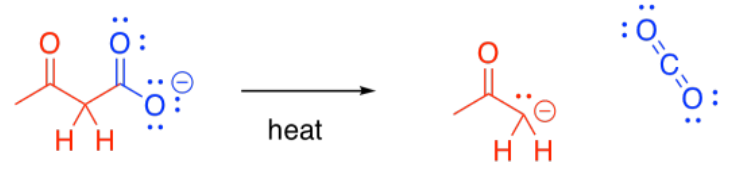
Bajo condiciones ácidas, por supuesto, no se produce un anión enolato; en cambio, se forma un enol. Sin embargo, los enoles se convierten rápidamente en los ceto tautomeros.
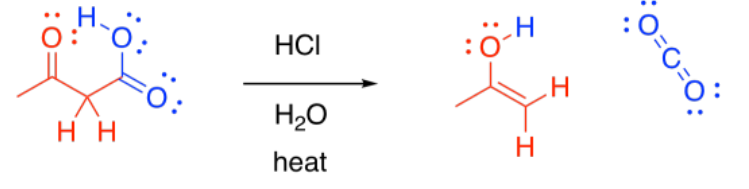
Ejercicio\(\PageIndex{4}\)
Dibuje un mecanismo para:
- Conversión de 3-oxihexanoato de etiloen ácido 3-oxihexanoico. (Oxy es un prefijo que significa que una cetona o aldehído se encuentra a lo largo de la cadena).
- Descarboxilación del ácido 3-oxihexanoico resultante.
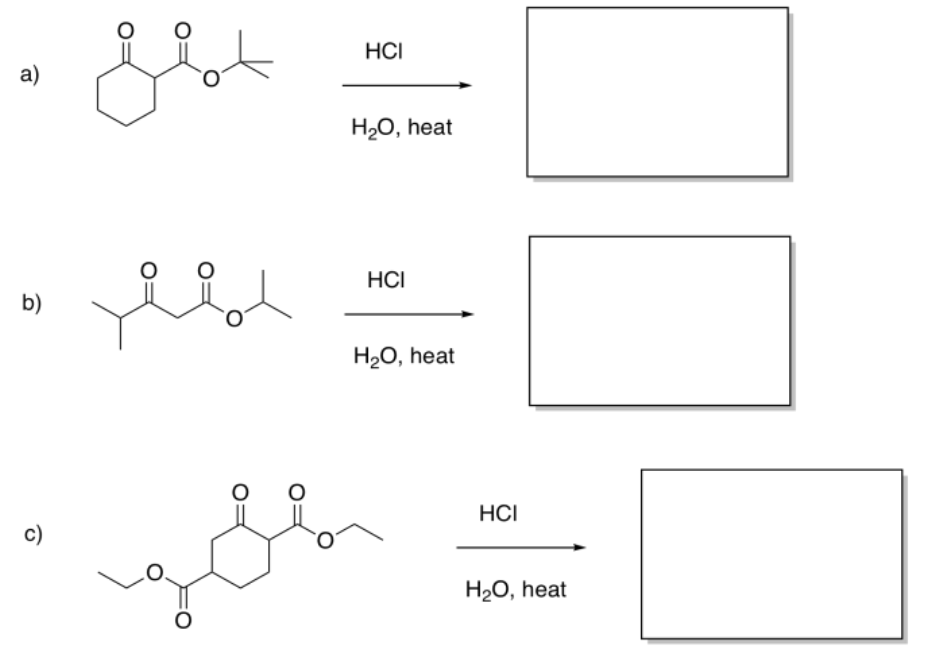
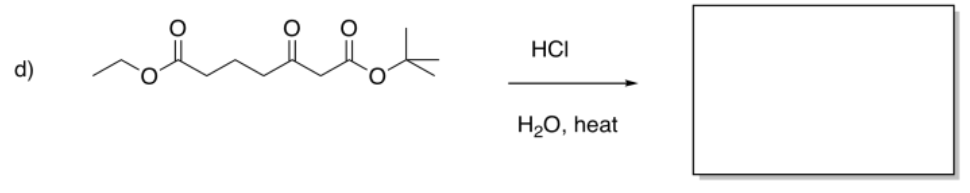
Ejercicio\(\PageIndex{5}\)
Rellene los productos de las siguientes reacciones.
- Contestar
-


