8.4: Mecanismos de la Fase Uno - Escisión
- Page ID
- 79355
Los primeros pasos de la glucólisis implican cambios relativamente menores. El azúcar se fosforila, en dos etapas diferentes, y se emplean un par de tautomerizaciones de ceto-enol para mover la posición carbonilo un carbono por la cadena. La migración de carbonilo permite que la molécula de fructosa sufra una escisión o escisión, en la que la molécula se corta por la mitad. Eso da un par de azúcares de tres carbonos. Los azúcares de tres carbonos como estos son importantes en la fase dos de la glucólisis, la fase productora de energía.

Para entender cómo la molécula se divide en dos, vamos a imaginar un caso complementario, porque podría parecer más familiar. La reacción que se muestra a continuación se denomina reacción aldólica. Ese es el que un ion enolato, con un carbono cargado negativamente junto a un carbonilo, dona a un carbonilo regular. El ion enolato actúa como el nucleófilo, donando electrones al carbonilo neutro, que actúa como electrófilo. El carbonilo electrófilo se abre para formar un ion alcóxido, que luego recoge un protón para hacer que el alcohol forme parte del producto aldólico.

Mostrar por qué el ion enolato es muy estable, aunque otros aniones de carbono no suelen ser fáciles de formar.
Los productos de las reacciones aldólicas llevan un patrón fácil de detectar: siempre hay una secuencia carbonil-carbono-alcohol, O=C-C-C-OH. El carbono medio fue el carbono nucleófilo; el carbono unido al OH es el anterior carbono carbonílico electrófilo. El caso es que las reacciones aldólicas son reversibles. Pueden volver a retroceder, reformando sus materiales de partida. Entonces, si miras un producto aldólico, con esa secuencia carbonil-carbono-alcohol, puedes imaginar que la molécula se separa, con una ruptura entre el carbono medio y el carbono del alcohol.

La flecha abierta en la imagen de arriba es un símbolo específico en química que significa “se puede hacer a partir de”. El producto aldólico se puede elaborar a partir del enolato y el carbonilo. Pero si una reacción aldólica es reversible, entonces lo contrario también es cierto: un enolato y un carbonilo pueden formarse a partir de un producto aldólico, caracterizado por su patrón O=C-C-C-OH. Esta reacción inversa se denomina reacción retro-aldólica.
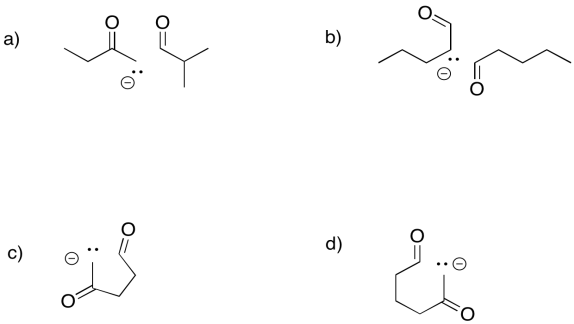
Predecir los productos de las siguientes reacciones aldólicas.
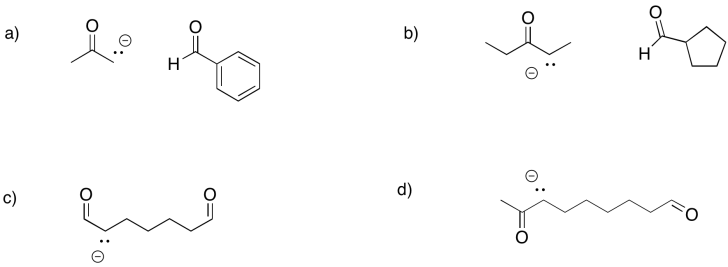
- Responder
-
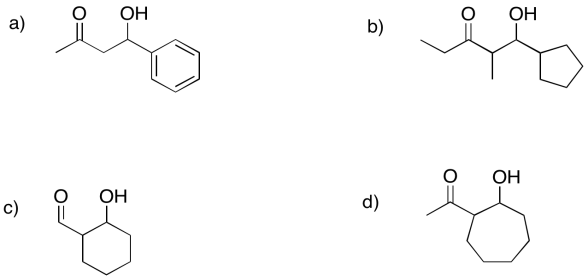
Predecir los precursores que podrían usarse para formar estos compuestos a través de reacciones aldólicas.
- Responder
-
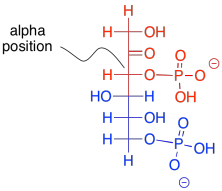
¿Qué hace posibles las reacciones retro-aldólicas? Lo mismo que hizo posible la reacción aldólica directa: la estabilidad de un anión enolato. Los enlaces carbono-carbono son en realidad bastante difíciles de romper, porque el par de electrones que forman el enlace no es probable que se desplace de una manera u otra. El enolato proporciona un mecanismo de liberación. Un par de electrones pueden desplazarse al carbono próximo al carbonilo, o a la posición alfa, porque allí formarán un anión estable.
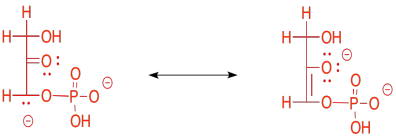
El ion enolato que resultaría de una reacción retro-aldólica de FBP sería estable porque la carga negativa está deslocalizada. Esa deslocalización de carga de un anión enolato es parte de lo que hace posibles las reacciones retro-aldólicas en primer lugar. No se puede simplemente tener una ruptura de enlace C-C en un lugar aleatorio y que uno de los carbonos forme un anión; eso nunca sucedería. Sin embargo, si el anión se estabiliza de alguna manera, entonces eso lo cambia todo.
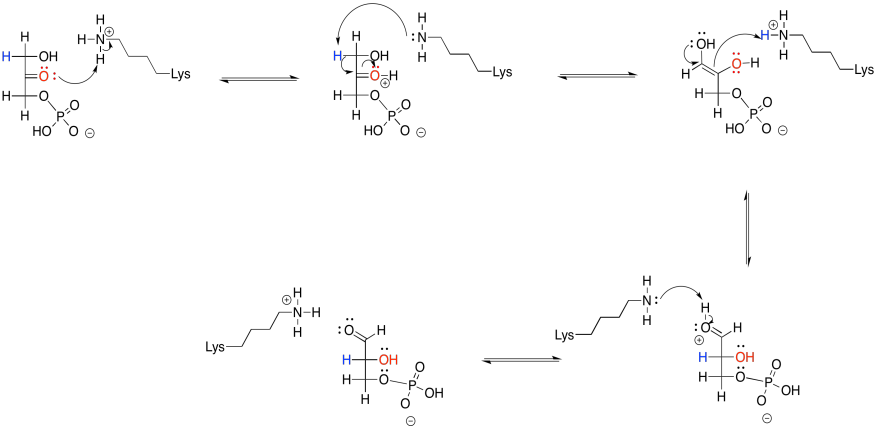
Proporcionar un mecanismo para la reacción retro-aldólica de fructosa-1,6-bisfosfato.
- Responder
-
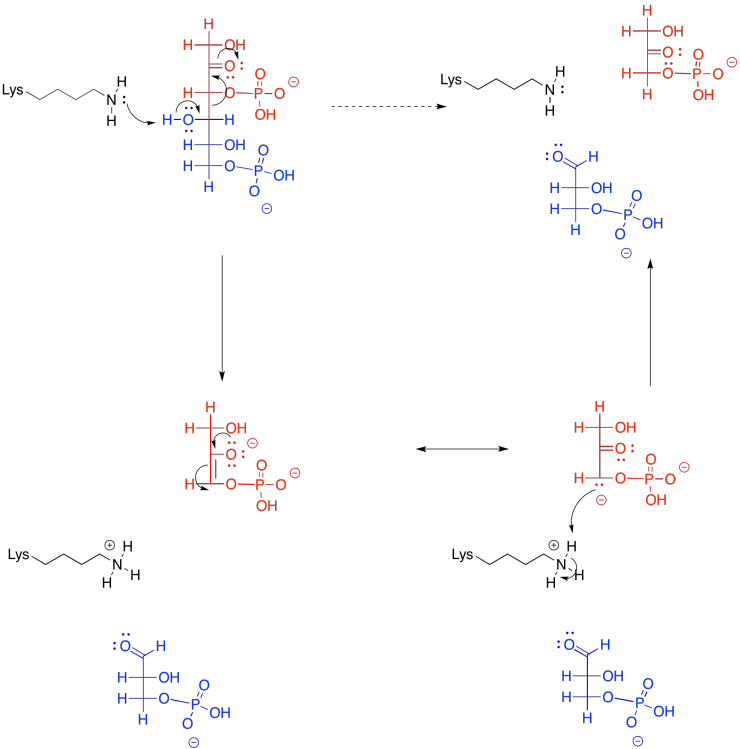
Sin embargo, esa no es toda la historia. En realidad, la reacción retro-aldólica de la FBP sufre catálisis de iminio. Eso significa que la reacción se acelera a través de la acción de un residuo de lisina en la enzima, fructosa bisfosfato aldolasa. La lisina, que contiene una cadena lateral de amina nucleófila, transforma el carbonilo de fructosa-1,6-bisfosfato en un ion iminio. Los bioquímicos suelen llamar a este tipo de estructura una base Schiff. Su estructura es muy similar a la original, pero contiene un grupo C=N en lugar de un grupo C=O. A pH biológico común, lo más probable es que el nitrógeno en la base de Schiff esté protonado.
¿Cómo ayuda eso a las cosas? Bueno, la estabilidad de carga es siempre un factor clave durante las reacciones. Cuesta energía estabilizar las cargas. Si podemos evitar generar la carga negativa de un anión enolato, aunque sea relativamente estable, eso podría facilitar las cosas. La base Schiff ya está cargada positivamente por su basicidad, por lo que cuando acepta un par de electrones se vuelve neutra. No tiene cargo para necesitar estabilización. Ese paso debería ser menos difícil que un paso similar que resulte en un anión.
Entonces, al agregar un par de pasos a la reacción —agregar la lisina al azúcar y luego quitársela nuevamente— la reacción se acelera. Puede parecer confuso que agreguemos pasos a la reacción, haciendo que la reacción general sea más larga, pero la reacción se vuelve más rápida. Eso es porque, aunque hay pasos adicionales, cada paso individual es mucho más fácil de lo que era antes. Es como la diferencia entre saltar a través de un río y pisar una serie de piedras. Dar los pasos adicionales puede ser la forma más rápida y segura de llegar allí.
Los productos de la escisión de FBP son gliceraldehído-3-fosfato (G3P) y fosfato de dihidroxiacetona (DHAP). Posteriormente, el fosfato de dihidroxiacetona se somete a isomerización para dar otra molécula de gliceraldehído-3-fosfato. Esta reacción se produce a través de la formación inicial de un tautmero de enol. Es similar a la isomerización de glucosa-6-fosfato a fructosa-6-fosfato que vimos anteriormente.

Entonces, cuando se forma la fructosa-1,6-bisfosfato, produce una molécula de gliceraldehído-3-fosfato y una molécula de fosfato de dihidroxiacetona, pero esa molécula de fosfato de dihidroxiacetona se convierte luego en otra molécula de gliceraldehído-3-fosfato. Así, el resultado general de esta parte de la reacción es transformar el azúcar de seis carbonos (primero glucosa y luego fructosa) en gliceraldehído-3-fosfato. Aquí es donde comienza la fase dos de la glucólisis.
Proporcionar un mecanismo para la reacción de isomerización de fosfato de dihidroxiacetona a gliceraldehído-3-fosfato.
- Responder
-