8.5: Catálisis en la Fase Uno
- Page ID
- 79386
Las reacciones en bioquímica suelen ser catalizadas por enzimas. En una reacción catalizada, se dispone de una vía alternativa que facilita el paso de los reactivos a los productos. Eso no quiere decir que haya menos pasos. De hecho, normalmente hay más etapas en una reacción catalizada que en una no catalizada. Significa que la energía general necesaria para atravesar la barrera catalizada es menor que la energía necesaria para superar la barrera no catalizada. Es como subir las escaleras hasta el segundo piso en lugar de dar un salto corriendo por la ventana: más escalones, pero en general ahorrará tiempo.
Hasta el momento, las reacciones que hemos visto en la glucólisis son solo las reacciones globales. Al observar las reacciones generales, obtenemos una idea bastante clara de lo que está sucediendo en cada etapa del camino. Incluso tenemos alguna idea de cómo podrían ocurrir esas reacciones, porque podemos identificar nucleófilos y electrófilos familares que parecen estar involucrados. Aquí, tomaremos una mirada más detallada a las vías catalíticas tomadas durante la primera fase de la glucólisis.
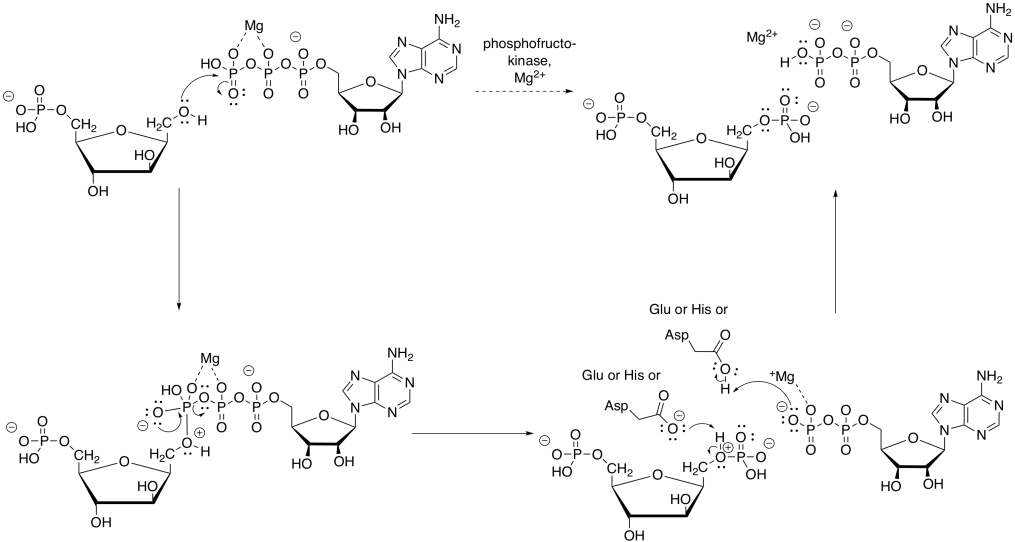
Esencialmente, cada paso de la glucólisis implica catálisis, y así las reacciones implican cofactores y pasos detallados que hemos pasado por alto hasta ahora. El primer paso, la fosforilación de la glucosa para proporcionar glucosa-6-fosfato, requiere el consumo de ATP. Durante esa etapa, el grupo hidroxi terminal de la glucosa toma fosfato del ATP, dejando ADP.
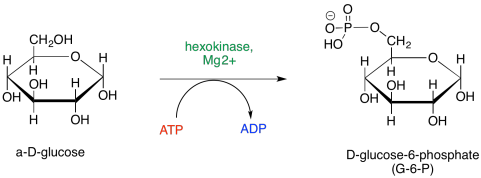
Parece que ese primer paso debería ser bastante sencillo, porque pensamos en el ATP como esta fuente de energía de alta energía para la célula, por lo que debe ser realmente reactiva. Sin embargo, el ATP no es tan reactivo como se podría pensar. Eso es algo bueno. Si reaccionaba con demasiada facilidad, no podría viajar alrededor de la célula en absoluto; se hidrolizaría la primera vez que se encontrara con una molécula de agua, y realmente hay muchísimos de esos en una célula típica. Para poder reaccionar, el ATP necesita ser activado.
Parte de la catálisis de la fosforilación de la glucosa implica simplemente la unión de ATP a un ion magnesio. Una vez unido al ion magnesio, el ATP se vuelve más electrófilo, debido a esa carga positiva en el ion magnesio.
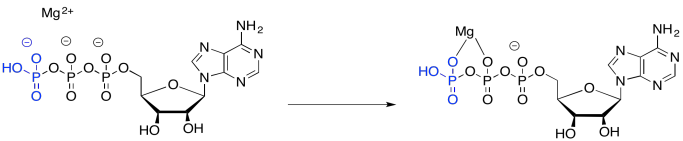
Si bien es poco probable que un nucleófilo, como el agua, done al ATP —en parte debido a la carga negativa sobre el ATP—, es más probable que done al ATP una vez que se lleve a cabo la coordinación, porque el ion magnesio ha nivelado esa carga negativa.

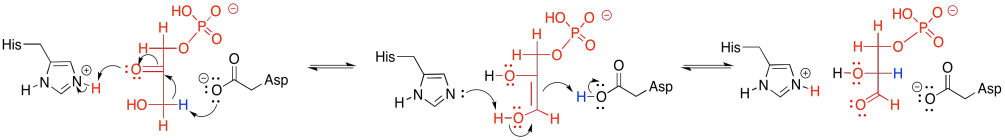
Otro aspecto de la catálisis en la fosforilación de la glucosa implica la eliminación de un protón. Un grupo hidroxilo se convierte en un fosfato y se pierde un protón. La catálisis ácido-base es bastante común en la bioquímica. Solo hay un puñado de aminoácidos que comúnmente participan en los pasos de desprotonación: aspartato, glutamato, lisina e histidina. Todos estos residuos tienen dos estructuras en equilibrio: una protonada y otra no protonada. La forma no protonada está lista para eliminar un protón cuando sea necesario.
De igual manera, la catálisis ácido-base se lleva a cabo por restos de aminoácidos cercanos en el sitio activo de la enzima que lleva a cabo la isomerización de glucosa-6-fosfato a fructosa-6-fosfato.

La fosfoglucoisomerasa logra esta tarea eliminando un protón de una posición alfa, y también de un grupo O-H, así como la donación de protones a una posición alfa diferente y un oxígeno diferente.
Un intermedio enol es el punto medio entre los dos isómeros. Si el protón se retirara de ese grupo hidroxi terminal, y un protón volviera a colocarse en la posición alfa, la estructura volvería al G6P original. Si, en cambio, se elimina un protón del segundo grupo hidroxilo a lo largo de la cadena, se obtiene una estructura diferente.

Por supuesto, el mismo tipo de requerimientos catalíticos surgen nuevamente durante la conversión de F6P a FBP. El ATP debe ser activado por magnesio, y las transferencias de protones deben ser realizadas por residuos de aminoácidos ácidos y básicos.

El magnesio se unirá al ATP con el fin de reducir la cantidad de carga negativa. De esa manera, el alcohol nucleofílico puede donar electrones con mayor facilidad. El protón del grupo alcohol puede ser eliminado por una cadena lateral de aminoácido, tal como el carboxilato cargado negativamente de aspartato o glutamato, o una histidina neutra.
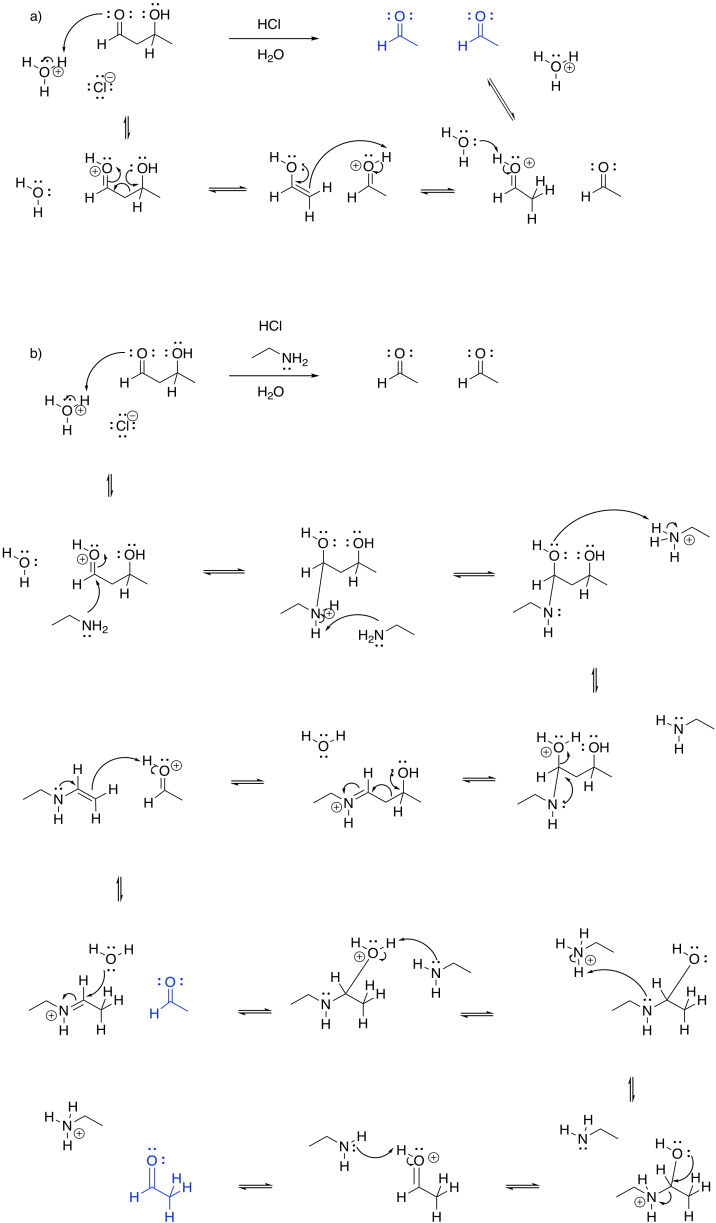
Un tipo completamente diferente de catálisis ocurre durante la etapa de escisión de la fase uno, cuando el azúcar de seis carbonos se escinde en un par de azúcares de tres carbonos. Tal vez recuerde que esta escisión se logra a través de una reacción retro-aldólica: una reacción aldólica entra en reversa, escupiendo un enolato o enol y un carbonilo.

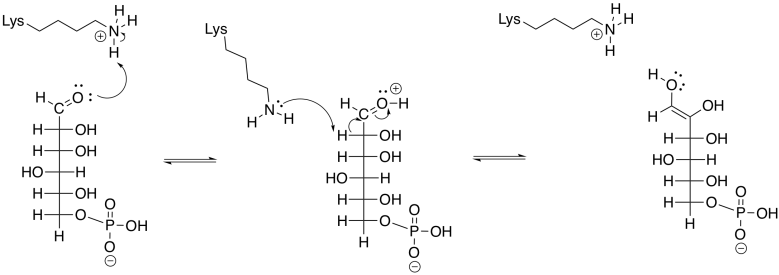
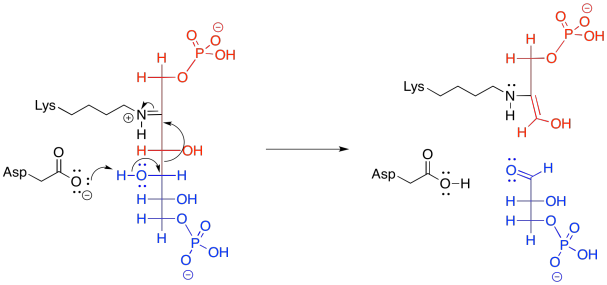
Esa etapa retro-aldólica se logra a través de la catálisis de iones iminio. Muy a menudo en reacciones bioquímicas, un residuo de lisina se une con un carbonilo para formar un ion iminio, que contiene un enlace C=N electrófilo, o una enamina, con una unidad nucleofílica N-C=C. El proceso comienza con la donación de la lisina, en su forma no protonada, al carbonilo de FBP.
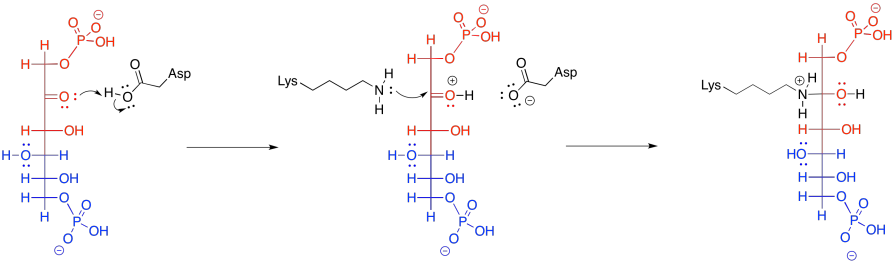
Frecuentemente, las reacciones enzimáticas se presentan en una forma más condensada. Se muestran múltiples pasos a la vez; pero no cualquier paso. En el siguiente ejemplo, la FBP reacciona tanto con la lisina como con el aspartato al mismo tiempo. Nunca dibujamos tres moléculas que se juntan a la vez, porque la probabilidad de que tres moléculas colisionen al mismo tiempo es casi nula. En este caso, eso no es un problema; el aspartato y la lisina son ambos parte de una misma molécula. Además, en este punto, la FBP ya se ha unido a la enzima, por lo que todo es un gran ensamblaje.
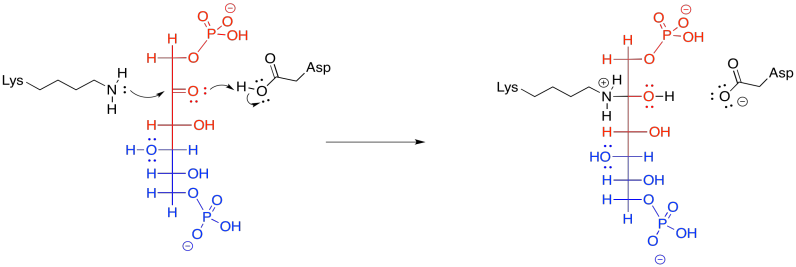
Posteriormente, la carbinolamina experimenta desplazamiento de agua para producir la imina, C=N.
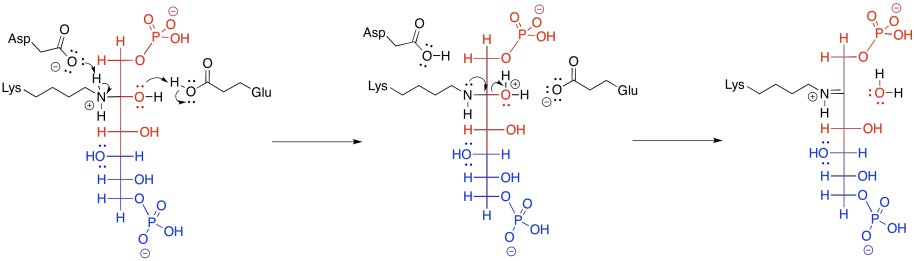
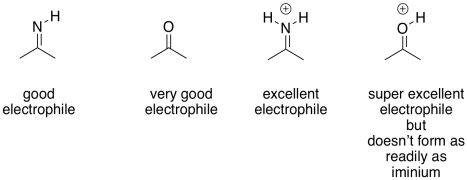
Las iminas y enaminas son aproximadamente equivalentes a carbonilos y enolatos, respectivamente. Las enaminas son muy buenos nucleófilos, al igual que los enolatos. Los enolados son un poco mejores, por la carga negativa. No obstante, a pesar de que son nucleófilos neutros, las enaminas son casi igual de buenas, porque la reacción es impulsada por un átomo de nitrógeno menos electronegativo; que está más dispuesto a donar sus electrones. Además, en el ambiente de la célula, las enaminas se forman mucho más fácilmente que los enolatos. Eso es porque no hay una gran cantidad de LDA o incluso NaOH flotando dentro de tus celdas. Como resultado, las enaminas a menudo se emplean como nucleófilos en los casos en los que se podría pensar en usar un enolato.
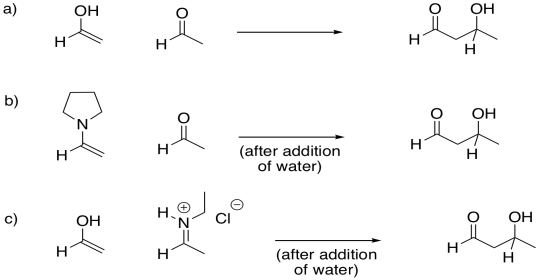
Proporcionar mecanismos para las siguientes reacciones de tipo aldol.
Contestar-

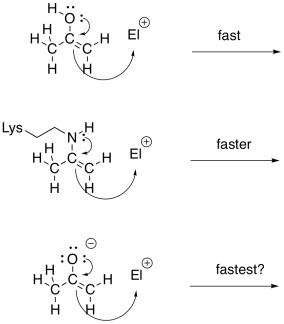
La unidad imina no es un electrófilo inherentemente mejor que un carbonilo; después de todo, contiene un enlace C=N menos polar en lugar de un enlace C=O. Sin embargo, el nitrógeno en una imina es mucho más básico que el oxígeno en un carbonilo. Se puede protonar con bastante facilidad bajo condiciones biológicas. El ion iminio resultante, que contiene la unidad C=N-H +, es un electrófilo activado. Por supuesto que reacciona mucho más rápido que un carbonilo regular.
Debido a que los carbonilos pueden formar fácilmente iminas o enaminas, a menudo se convertirán en esos compuestos para hacer reacciones. Este proceso se llama catálisis de enamina e imina.
Las reacciones aldólicas son realmente reversibles. Una reacción retro-aldólica es solo la reacción aldólica que va a la inversa. En ese caso, un enolato o un enol o una enamina podrían salir como un grupo saliente, en lugar de actuar como el nucleófilo inicial.
Proporcionar mecanismos para las siguientes reacciones retro-aldólicas.
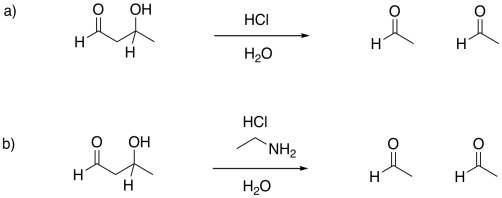
- Contestar
-
En el contexto de una reacción retro-aldólica, necesitamos pensar en la catálisis hacia atrás. En lugar de un ion iminio que actúa como un intermedio activado para recibir un nucleófilo, está aceptando electrones para formar un grupo saliente. En lugar de tener un grupo saliente enolato en la reacción retro-aldólica, tenemos un grupo saliente enamina.
El grupo lisina, que acaba de subirse a bordo para catalizar la reacción, se libera mediante la adición de una molécula de agua.
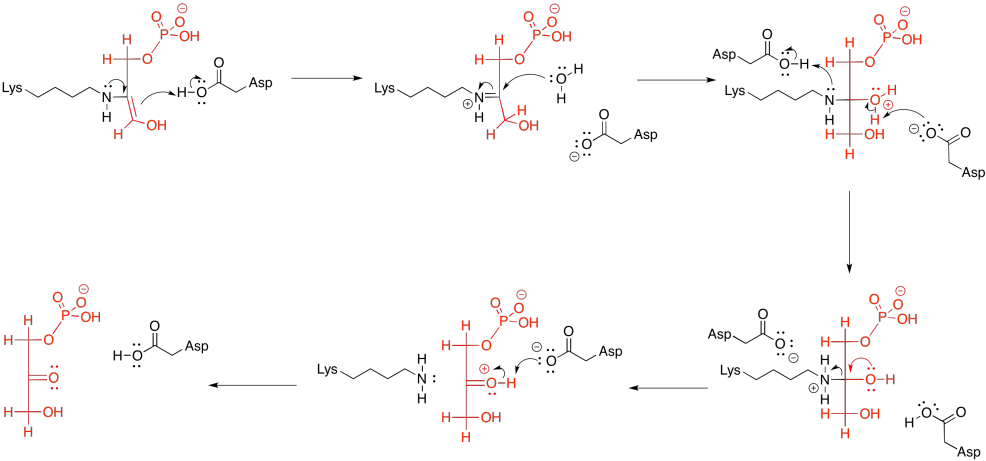
Hay una última reacción en la fase uno, la quinta general en la glucólisis. Es la conversión de DHAP a G3P; pero eso es sólo otro tautomerismo ceto-enol. Los mecanismos catalíticos serán muy parecidos a los que se ven en la conversión de G6P a F6P.

Los sitios de aminoácidos básicos como la histidina neutra y el aspartato aniónico pueden eliminar fácilmente un protón, mientras que los conjugados correspondientes pueden suministrar un protón. El tautomerismo simplemente requiere la eliminación de un protón de una posición alfa. Cuando se devuelve un protón, va al otro extremo del doble enlace en el enol.