1.9: Soluciones a problemas seleccionados
- Page ID
- 78689
Ejercicio 1.2.7:
a) Las moléculas escarlata están desapareciendo con el tiempo. Con el tiempo aparecen moléculas ultramarinas. Sin embargo, el número de moléculas escarlata parece estabilizarse alrededor de la mitad de su número original; el número de moléculas de ultramar alcanza aproximadamente el mismo nivel. Es posible que las moléculas escarlata se conviertan en las ultramarinas, pero alcancen un equilibrio. En este equilibrio, sucede que hay cantidades aproximadamente iguales de los dos compuestos.
b) Debido a que la tasa de crecimiento de las moléculas de bronceado parece rastrear la tasa de pérdida de las marrones, parece probable que las marrones se estén convirtiendo en moléculas de bronceado. En algún momento, el cambio se nivela, por lo que se alcanza un equilibrio. En este equilibrio, las moléculas de bronceado superan en número a las marrones.
c) Las moléculas viridianas parecen estar convertiéndose en oro pero el sistema alcanza el equilibrio, momento en el que todavía hay más moléculas viridianas que las de oro.
Ejercicio 1.3.3:
a) e 2 < e 10
b) e 1/4 < e 1/2
c) e -3 > e -4
d) e -1/2 < e -1/3
Ejercicio 1.3.4:
a) La orientación (i) parece más probable que resulte en conexión del oxígeno al carbono con desplazamiento de bromuro. En la orientación (iii), el oxígeno parece listo para colisionar con el átomo de bromo. y en la oreientación (ii), puede colisionar con un átomo de hidrógeno.
Además, verá más adelante que traer el oxígeno a lo largo del eje C-Br (pero lejos del bromo) también es más probable que rompa el enlace C-Br, por razones que involucran superposición orbital molecular.
b) La orientación (ii) parece que el anión de carbono en el ion acetiluro es más probable que se una con el carbono carbonilo. En la opción (i), el carbono va a colisionar con el oxígeno carbonilo. En la opción (iii), puede colisionar con el carbono alfa, junto al carbonilo. Tener el enfoque nucleofílico desde fuera del plano del carbonilo, como en la opción (ii), disminuye la posibilidad de colisión con átomos distintos al carbono carbonilo.
Nuevamente, también hay razones orbitales moleculares que hacen de este enfoque el preferido.
Ejercicio 1.3.5:
a) Esperaríamos la barrera más baja para romper el enlace Cr-Co. La barrera para romper el enlace Mo-Co sería ligeramente menor que para romper el enlace W-CO.
b) Solo con base en esta información, podríamos esperar que la escisión de Cr-Co ocurra más rápidamente. La escisión de Mo-CO sería ligeramente más rápida que la escisión de W-CO.
Ejercicio 1.3.6:
- Solo sobre esta base, esperaríamos la barrera más baja para la escisión C=C, seguida de C=N y luego C=O con la barrera más alta.
- Esta tendencia es exactamente lo contrario de lo que acabamos de predecir en base a las fortalezas de los bonos.
- Puede haber algunas razones diferentes para estas diferencias. Por ejemplo, la electrofilicidad del carbono puede ser un factor. Con base en las diferencias de electronegatividad, el carbono C=O debería ser más positivo, el carbono C=N menos y el carbono C=C no en absoluto. Esa electrofilicidad puede elevar un poco el reactivo en energía.
Alternativamente, puede haber factores de estabilización de carga en el intermedio primero formado, que pueden reflejarse en el estado de transición en el camino hacia allí. Estos tres átomos diferentes (O, N, C) se encuentran todos en una fila de la tabla periódica, por lo que las diferencias de electronegatividad deberían dominar la estabilidad de carga. El ion alcóxido sería el más estable, el ion amida de estabilidad media y el anión alquilo menos estable de todos. Esa tendencia reduciría la barrera a la formación de alcóxido y elevaría la barrera a la formación de un anión alquilo basado en carbono.
Ejercicio 1.4.1:
Las vacantes en las redes cristalinas dan a otros átomos lugares para moverse, por lo que actúan como un camino a través del cual los átomos pueden moverse. La difusión a través del sólido se acelera enormemente.
Ejercicio 1.4.2:
a) Los pequeños puntos rojos se encuentran en fase gaseosa, por lo que se distribuyen por todo el contenedor. Los puntos grises más grandes son los sólidos, que se encuentran a lo largo del fondo del contenedor.
b) El sólido de la izquierda se divide en partículas más finas, con mucha más superficie. Si el gas reacciona sobre la superficie del sólido, la reacción será mucho más rápida a la izquierda.
Ejercicio 1.4.3:
Los tres disolventes tienen momentos dipolares. Además, las tres moléculas tienen pares solitarios de oxígeno, por lo que son capaces de aceptar enlaces de hidrógeno de donantes de enlaces de hidrógeno.
Sin embargo, algunos de los disolventes son mucho más polares que otros. El agua es capaz de donar enlaces de hidrógeno, debido a su hidrógeno parcialmente positivo unido al oxígeno. Es el más polar de estos solventes.
La DMF también es muy polar, porque tiene un enlace polar C=O. Este carbonilo en particular se parece más a + N=C-O -debido a la donación de pares solitarios del nitrógeno, por lo que es bastante polar e interactuará fuertemente con otras especies a través de fuerzas dipolo-dipolo (o fuerzas ión-dipolo, si la otra molécula es una sal).
El THF solo tiene un dipolo moderado en comparación con los demás. Aunque seguirá interactuando a través de fuerzas dipolo-dipolo (o ión-dipolo), lo hace de manera menos efectiva que el agua o DMF.
Ejercicio 1.4.4:
El agua sería un muy buen disolvente para (a) y (d), porque ambas moléculas serían muy buenas en enlaces de hidrógeno. Aunque el agua puede ser capaz de disolver pequeñas cantidades de las otras, su solubilidad estaría limitada por la necesidad de que las moléculas de agua liberen enlaces de hidrógeno entre sí para dejar espacio a las porciones no polares de estas moléculas.
El THF podría disolver bastante bien las otras moléculas: (b), (c), (e) y (f). Todas esas moléculas contienen enlaces polares, como THF, y podrían interactuar a través de fuerzas dipolo-dipolo. El THF podría disolver pequeñas cantidades de (a) y (d) pero puede no ser lo suficientemente polar como para superar las fuerzas intermoleculares más fuertes entre estas moléculas.
La DMF puede ser capaz de disolver todas estas moléculas en un grado moderado. Aunque no es un solvente prótico, su dipolo es suficiente para ayudar a superar los enlaces de hidrógeno entre (a) y (d).
Ejercicio 1.5.1:
Upper East Side. Mucha más gente por pie cuadrado.
Ejercicio 1.5.2:
a) 8.41 personas km -2
b) 1,600 personas km -2
c) 15.2 personas km -2
d) 13.5 personas km -2
e) 12.7 personas km -2
f) 1,930 personas km -2
g) 24.6 personas km -2
Ranking: Baréin > Vaticano > Jamaica > Argentina > China > Malawi > Rusia
Ejercicio 1.5.3:
a) El volumen es constante, pero el número de moléculas va en aumento. La concentración va en aumento.
b) El número de moléculas es constante, pero el volumen es decreciente. La concentración va en aumento.
Ejercicio 1.5.4:
En ambos casos, las moléculas están cada vez más densamente empaquetadas. Las colisiones se harían más frecuentes a medida que avanzamos de izquierda a derecha.
Ejercicio 1.5.5:
a) El número de moléculas azules va en aumento, pero el número de moléculas rojas se mantiene igual.
b) Las colisiones entre moléculas rojas y azules se harían más frecuentes a medida que avanzamos de izquierda a derecha. La mayor densidad de moléculas azules hace que las colisiones sean más probables.
c) La respuesta permanecería igual.
d) La respuesta se mantendría igual cualitativamente, pero diferiría cuantitativamente. El número de colisiones aumentaría más bruscamente si aumentaran las concentraciones de moléculas tanto rojas como azules, en lugar de solo aumentar una concentración.
Ejercicio 1.5.6:
a) Media docena, una docena, dos docenas.
b) La concentración se está duplicando a medida que vamos de izquierda a derecha de un vaso de precipitados al siguiente.
Ejercicio 1.5.7:
a) El elefante pesa\(6800kg \times 1000 \frac{g}{kg} = 6800000g = 6.8 \times 10^{6} g \)
b) Tenemos\(47600 kg \times \frac{1 elephant}{6800 kg} = 7 elephants\). Muy afortunada.
c)\(7 mice \times 25 \frac{g}{mouse} = 175g\)
d)\(10 mice \times 25 \frac{g}{mouse} = 250g\)
Ejercicio 1.5.8:
El peso de 7 moléculas azules = el peso de 2 moléculas rojas. 1 molécula roja = 7/2 x el peso de una molécula azul. \(MW_{red} = 3.5 \times MW_{blue} = 3.5 \times 60 \frac{g}{mol} = 210 \frac{g}{mol}\)
El peso de 6 moléculas azules = el peso de 6 moléculas de naranja. \(MW_{orange} = MW_{blue} 60 \frac{g}{mol}\)
El peso de 6 moléculas azules = el peso de 1 molécula gris. \(MW_{grey} = 6 \times MW_{blue} = 6 \times 60 \frac{g}{mol} = 360 \frac{g}{mol}\)
Ejercicio 1.5.9:
Un mol de material se corresponde con el equivalente numérico de la suma de masas atómicas en una molécula, en gramos.
a) Masas atómicas en NO 2: 14 amu (N) + 32 amu (2 x O) = 46 amu. 1 mol de NO 2 es 46 g de NO 2.
b) 180 g
c) 106 g
d) 142 g.
Ejercicio 1.5.10:
a)\(3g \times \frac{1mol}{180g} = 0.017 mol\)
b)\(10g \times \frac{1mol}{106 g} = 0.094mol \)
c)\(30g \times \frac{142mol}{g} =0.21 mol\)
Ejercicio 1.5.11:
a)\(5g \times \frac{1mol}{180g} = 0.028mol; \frac{0.028 mol}{50mL} = 5.6 \times 10^{-4} \frac{mol}{mL} \times 1000 \frac{mL}{L} = 0.56 \frac{mol}{L}\)
b)\(11g \times \frac{1mol}{106g} = 0.104mol; \frac{0.104 mol}{25mL} = 4.16 \times 10^{-3} \frac{mol}{mL} \times 1000 \frac {mL}{L} = 4.2 \frac{mol}{L}\)
c)\(9g \times \frac{1mol}{156g} = 0.058 mol; \frac{0.058mol}{60mL} = 9.61 \times 10^{-4} \frac{mol}{mL} \times 1000 \frac{mL}{L} 0.96 \frac{mol}{L}\)
Ejercicio 1.6.1:
a) Tasa de (a) = 1/2 x Tasa de original
b) Tasa de (b) = 1/2 x Tasa de original
c) Tasa de (c) = 3/4 x Tasa de original
d) Tasa de (d) = 1/2 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se duplica. Como resultado, la concentración se reduce a la mitad.
e) Tasa de (e) = 2 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se reduce a la mitad. En consecuencia, la concentración se duplica.
f) Tasa de (f) = Tasa de original; aunque se duplica el número de moléculas, también se duplica el volumen, dejando la concentración sin cambios.
Ejercicio 1.6.2:
a) Tasa de (a) = 1/2 x Tasa de original
b) Tasa de (b) = 1/2 x 1/2 = 1/4 x Tasa de original
c) Tasa de (c) = 2 x Tasa de original
d) Tasa de (d) = 1/2 x 1/2 = 1/4 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se duplica. Como resultado, la concentración se reduce a la mitad.
e) Tasa de (e) = 2 x 2 = 4 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se reduce a la mitad. Como resultado, se duplica la concentración de cada reactivo.
f) Tasa de (f) = Tasa de original; aunque se duplica el número de moléculas, también se duplica el volumen, dejando la concentración sin cambios.
Ejercicio 1.6.3:
a) Tasa de (a) = Tasa de original; la superficie del sólido blanco parece ser la misma.
b) Tasa de (b) = 1/2 x Tasa de original; la superficie del sólido blanco parece estar cortada por la mitad.
c) Tasa de (c) = 2 x Tasa de original; la superficie del sólido blanco parece estar duplicada.
d) Los tamaños más pequeños de las partículas en (d) hacen que sea más difícil responder a esta pregunta. Supongamos que estos sólidos blancos son esféricos y que el radio de una esfera en (d) es la mitad que el de una esfera en el original. La superficie de una esfera es\(A = 4 \pi r^{2}\). La relación de las áreas superficiales de una esfera con respecto a otra es\(\frac{A_{1}}{A_{2}} = \frac{4 \pi r_{1}^{2}}{4 \pi r_{2}^{2}} = (\frac{r_{1}}{r_{2}})^{2}\). La proporción de áreas superficiales de una esfera original a una esfera en (d) es\(\frac{A_{d}}{A_{0}} = (\frac{1}{2})^{2} = \frac{1}{4}\) Sin embargo, hay 12 esferas en (d) y sólo 4 esferas en la original. Así, la relación de las áreas superficiales totales\(\frac{A_{dT}}{A_{0T}} = (\frac{12}{4}) \times (\frac{1}{4}) = \frac{3}{4}\). La tasa estimada de (d) = 3/4 x la Tasa de original.
e) Supongamos que estos sólidos blancos son esféricos y que el radio de una esfera en (e) es una cuarta parte del de una esfera en el original. La relación de las áreas superficiales de una esfera original a una esfera en (e) es\(\frac{A_{e}}{A_{0}} = (\frac{1}{4})^{2} = \frac{1}{16}\). Sin embargo, hay 40 esferas en (e) y sólo 4 esferas en el original. Así, la relación de las áreas superficiales totales\(\frac{A_{eT}}{A_{0T}} = (\frac{40}{4}) \times (\frac{1}{16}) = \frac{5}{8}\) La tasa estimada de (e) = 5/8 x la Tasa de original.
f) Tasa de (f) = Tasa de original; la superficie del sólido blanco parece ser el sam
Ejercicio 1.6.4:
Al inicio mismo de la reacción, las concentraciones de reactivos no han cambiado mucho. Eso significa que la velocidad de la reacción permanece aproximadamente constante a medida que se consume el primer porcentaje de reactivos. Trazar [producto] vs. tiempo da una línea recta con la pendiente = tasa. Sin embargo, en el transcurso de la reacción, la concentración de reactivos disminuye a medida que se consumen los reactivos. Eso significa que la tasa de formación del producto se ralentiza y una gráfica de [producto] vs. tiempo se curva. No podremos medir la pendiente de una manera sencilla.
Ejercicio 1.6.5:
La pendiente de la primera curva, con [A] o = 1 mol L -1, se puede estimar observando que [C] aumenta de cero a 25 mmol L -1 en 50 segundos. La pendiente está a punto\(\frac{25}{50} = 0.5 \frac{mmol}{Ls}\). La pendiente de la siguiente curva, con\([A]_{0} = 2 \frac{mol}{L}\), es\(1.0 \frac{mmol}{Ls} (\frac{50 \frac{mmol}{L}}{50s})\). La concentración inicial se duplica y la tasa se duplica. La pendiente de la curva final, con\([A]_{0} = 4 \frac{mol}{L}\), es\(2.0 \frac{mol}{Ls} (\frac{100 \frac{mmol}{L}}{50s})\). La concentración inicial se duplica y la tasa se duplica. La reacción depende linealmente de la concentración de A. Lo que pase con [A] también le sucede a la velocidad.
En cuanto a las leyes de tarifas, existe un enfoque matemático para demostrar esta relación.
Supongamos\(Rate = k[A]^{x}\); x es el poder de la relación matemática.
La relación de tasas en dos experimentos es\(\frac{Rate_{1}}{Rate_{2}} = (\frac{k[A_{1}]^{x}}{k[A_{2}]^{x}}) = (\frac{[A_{1}]}{[A_{2}]})^{x}\)
Si tomamos el logaritmo de ambos lados:\(\ln (\frac{Rate_{1}}{Rate_{2}}) = \ln ((\frac{[A_{1}]}{[A_{2}]})^{x}) = x \ln (\frac{[A_{1}]}{[A_{2}]})\)
Entonces\(x = \frac{ln(\frac{Rate_{1}}{Rate_{2}})}{ln(\frac{[A_{1}]}{[A_{2}]})}\)
Ejercicio 1.6.6:
- Cada vez que las concentraciones se duplican (por ejemplo, de 2 a 4 mol L -1), la tasa se cuadruplica (por ejemplo, de 50/50 = 1 mmol L -1 s -1 a 200/50 = 4 mmol L -1 s -1). Una explicación es Tasa = k [A] [B].
- Otra explicación es\(Rate = k[A]^{2} \: or \: Rate = k[B]^{2}\)
- Podríamos ejecutar una serie de experimentos en los que [A] se cambia manteniendo [B] constante (o viceversa).
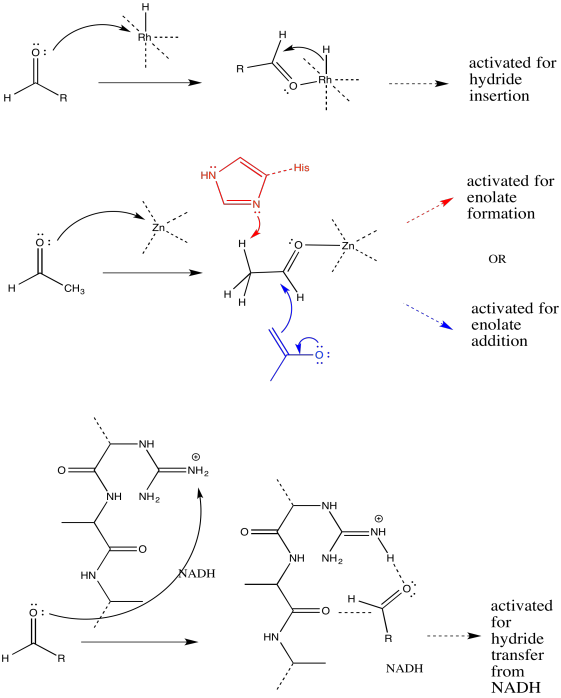
Ejercicio 1.7.1:
a)

b) El primer paso procede en k 1; el segundo en k 2.
c) El segundo paso es probablemente reversible. Es sólo el intercambio de un protón de un grupo OH a otro.
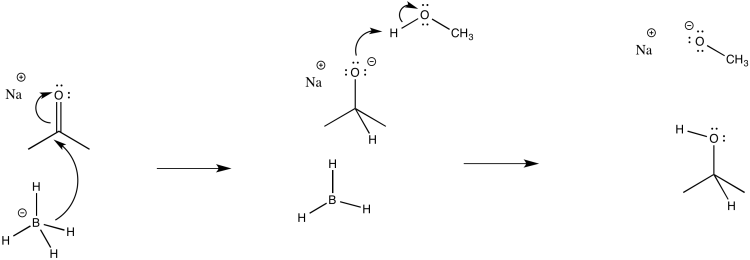
d)
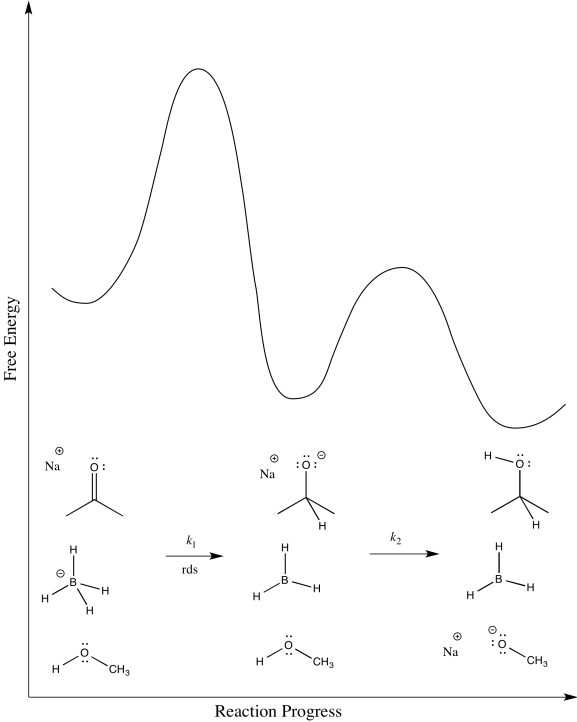
e)\(Rate = k_{1} [ketone][NaBH_{4}]\)
Ejercicio 1.7.2:
a)

b) El primer paso procede en k 1; el segundo en k 2; el tercero en k 3.
c) Existen tres etapas diferentes, cada una de las cuales podría ser la determinación de la tasa.
El primero:

El segundo:
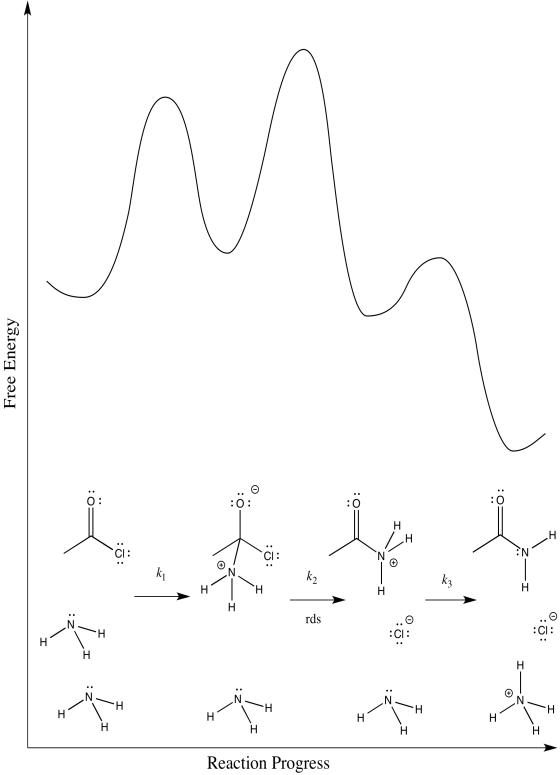
El tercero:
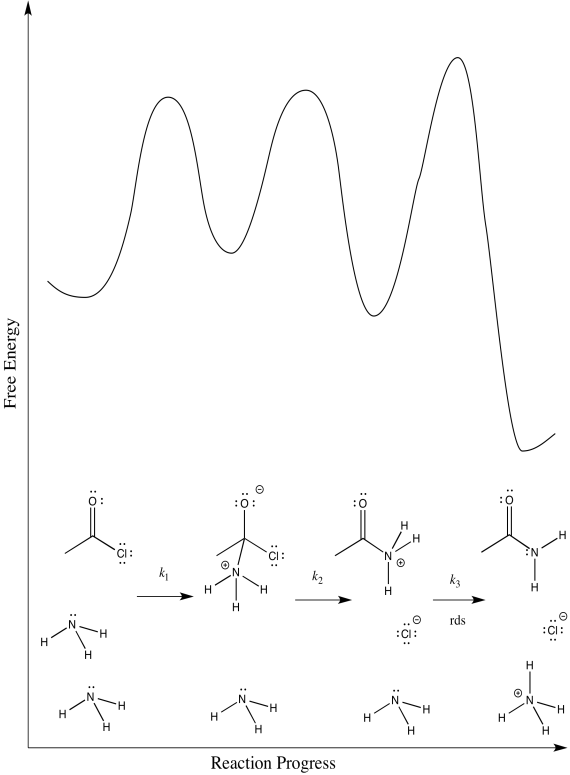
d) Primera:\(Rate = k_{1}[CH_{3}COCl][NH_{3}]\)
Segundo:\(Rate = k_{1}k_{2}[CH_{3}COCl][NH_{3}]\)
Tercero:\(Rate = k_{1}k_{2}k_{3}[CH_{3}COCl][NH_{3}]^{2}\)
La ley tarifaria podría utilizarse para distinguir la tercera de las dos primeras. No obstante, sería imposible decir la diferencia entre los dos primeros utilizando únicamente la ley de tarifas.
e) Probablemente podamos descartar la tercera posibilidad de inmediato. Las transferencias de protones tienden a ocurrir con bastante rapidez, especialmente en presencia de una base razonable como el amoníaco. Medir la ley de tarifas confirmaría rápidamente esta suposición.
Los escenarios 1 y 2 son mucho más difíciles de distinguir. En ambos casos, se está rompiendo un vínculo ya que se está haciendo otro vínculo. Podríamos hacer una suposición educada de que la formación del buen grupo de salida de cloruro es bastante fácil; eso haría del paso 1 el paso determinante de la tasa.
No obstante, siempre nos queda cierta ambigüedad en casos sutiles como éste. Para tener una mejor idea sobre qué estados de transición son los más altos, tendríamos que realizar química computacional.
Ejercicio 1.7.3:
a) i)
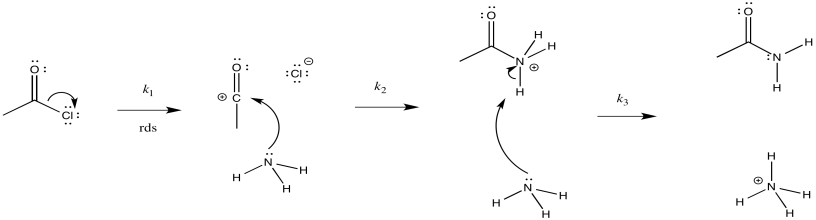
ii)
iii)\(Rate = k_{1}[CH_{3}COCl]\)
b) i)
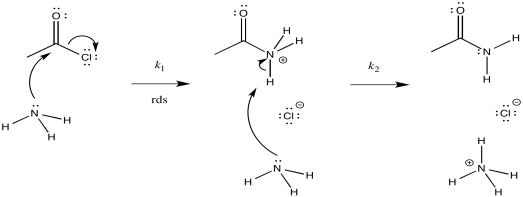
ii)
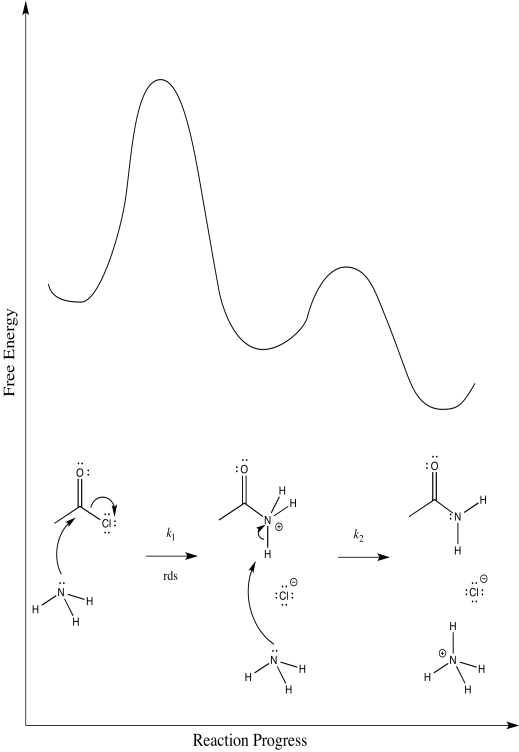
iii)\(Rate = k_{1}[CH_{3}COCl][NH_{3}]\)
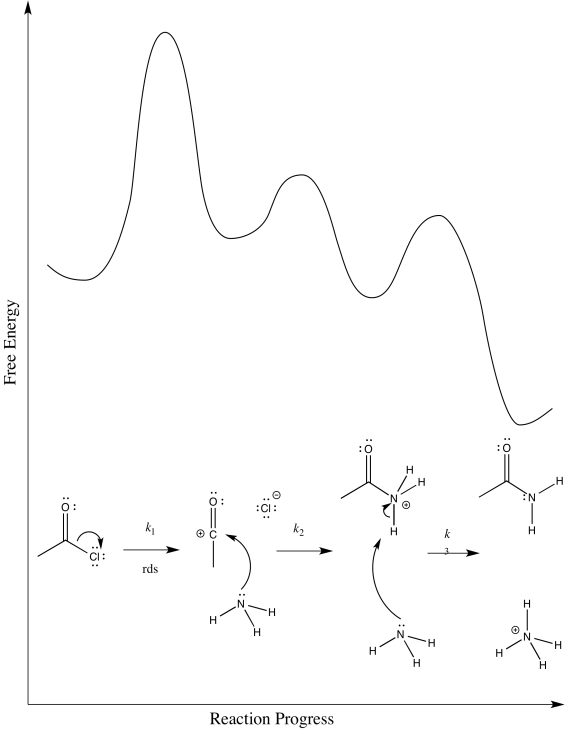
c) Sobre la base de la ley tarifaria, se puede descartar la posibilidad (a), pero no la posibilidad (b)
Ejercicio 1.7.4:
- Hay un cambio de geometría antes o durante el paso de determinación de la velocidad.
- Se puede descartar la posibilidad (b).
Ejercicio 1.7.6
a)
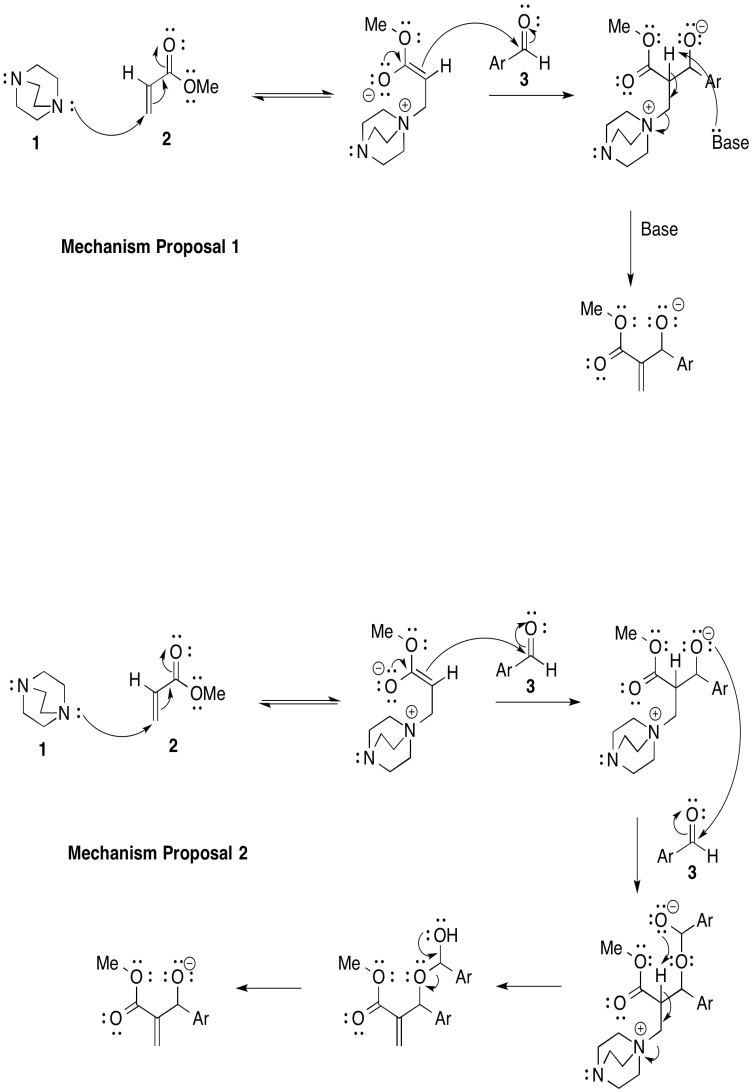
b) Mecanismo 1:\(k[1][2][3]\)
Mecanismo 2:\(k[1][2][3]^{2}\)
c) Primer orden en [1]; primer orden en [2]; segundo orden en [3]
d) Mecanismo 2.
Ejercicio 1.8.2: