1.8: Catálisis
- Page ID
- 78721
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El mecanismo de una reacción es una secuencia de etapas elementales que conducen desde los materiales de partida a una serie de intermedios y eventualmente a los productos. Cada paso implica una barrera de activación. Cada intermedio tiene alguna medida de estabilidad. Podemos realizar un seguimiento de los cambios de energía a lo largo de esta ruta de reacción usando un diagrama de progreso de reacción.
Podemos cambiar la velocidad de una reacción inundando el sistema con reactivo o agregando más energía para ayudarlo a superar la barrera, pero la reacción sigue este mismo camino energético.
No obstante, si agregamos un catalizador, eso ya no es cierto. Un catalizador introduce una vía completamente diferente que antes no estaba allí.
Algunas reacciones simplemente no pueden continuar sin un catalizador. Hay una barrera demasiado alta para proceder. Eso puede ser cierto incluso si la reacción general es exergónica y debe ser favorecida para proceder.
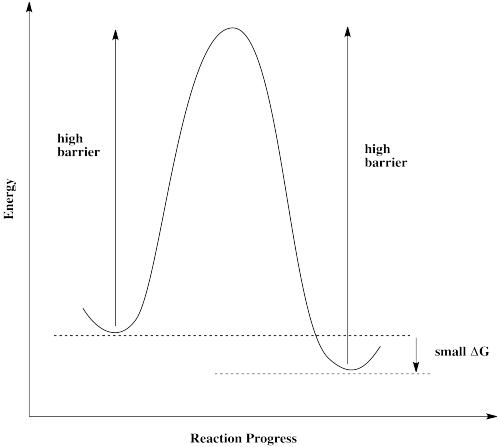
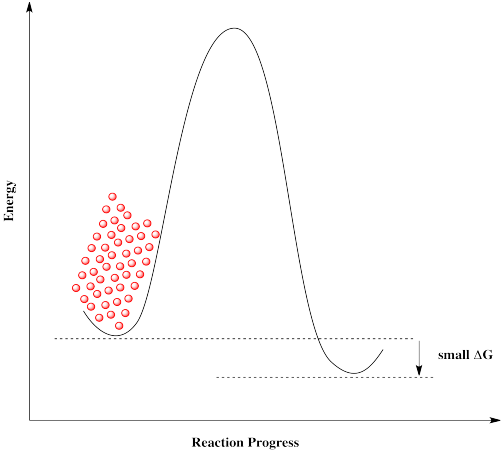
Si las moléculas se acercan a esta barrera desde la izquierda, se encuentran con una barrera muy grande. No pueden proceder, a pesar de que sería energéticamente favorable para ellos llegar a su destino. Las moléculas se atascan.
Lo mismo es cierto si las moléculas se acercan desde la derecha. No pueden superar la barrera, a pesar de que termodinámicamente su destino es solo un salto corto. Estas moléculas están atascadas.
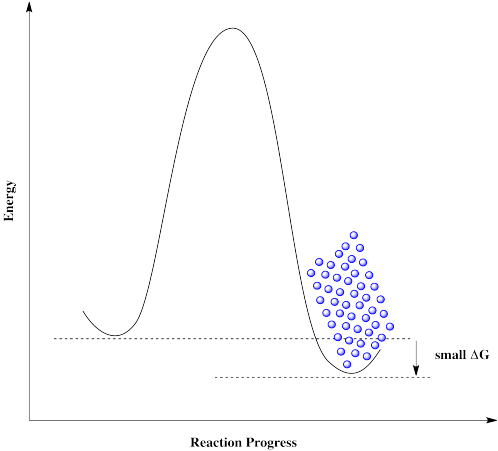
Todo estaría bien si pudiéramos simplemente deshacernos de esa maldita barrera. Las moléculas podrían moverse libremente de un lado a otro, y establecerse donde se supone que deben estar.
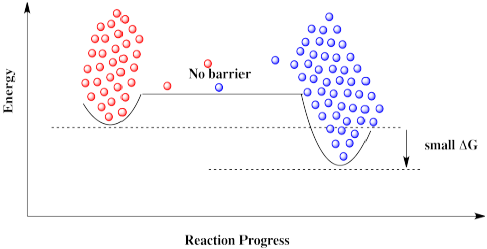
Un catalizador no elimina la barrera, pero ofrece una nueva vía con una barrera más baja. La reacción es capaz de proceder de un lado a otro.
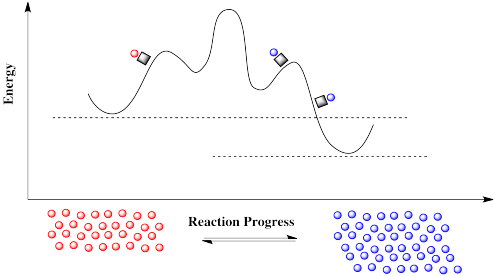
¿Cómo puede de repente haber un nuevo camino? Un diagrama de progreso de reacción traza lo que sucede con la energía a lo largo de una coordenada particular de interés para la molécula. Podemos estar siguiendo un vínculo a medida que se alarga y rompe el curso de una reacción. Pero siempre hay otras posibilidades energéticas que permanecen inéditas en este diagrama. Lo que estamos viendo es simplemente una rebanada a través de una superficie de energía potencial. Una superficie energética potencial es como un paisaje, una cordillera en la que la elevación corresponde a la energía. El diagrama de progreso de la reacción representa una sola vía de un valle energético a otro. En uno de estos valles está el reactivo; el producto está en el otro. El camino de un valle a otro conduce cuesta arriba, sobre un paso de montaña, y de nuevo hacia el otro valle.
Supongamos que vas a visitar a un amigo. Vives en un valle y el amigo vive en otro. Todos los días caminas el mismo camino hacia la casa de tu amigo. No eres un tonto, así que tomas la ruta más fácil, sobre el paso de montaña más bajo.
Un día, en lugar de visitar a nuestro amigo a pie, vamos a tomar el tren. El tren toma un camino completamente diferente al que estamos acostumbrados. Ni siquiera pasa por el mismo paso de montaña; puede tomar otra ruta que era inaccesible a pie, o simplemente puede hacer un túnel a través de la montaña. Además, cuando el tren llega a su destino, recoge más pasajeros y realiza el mismo viaje una y otra vez.
En giros moleculares, es el reactivo el que toma el tren, una vía de baja energía, en su camino hacia el producto. Ese tren es un catalizador, y tiene algunas características muy importantes.
- Un catalizador toma una vía de reacción que es menor en energía que la habitual.
- Un catalizador regresa una y otra vez para tomar más moléculas a través de la reacción.
Ese reciclaje del catalizador a veces se denomina “volumen de negocios”. El número de recambio de un catalizador es el número de veces que el catalizador es capaz de regresar y llevar a cabo la reacción nuevamente. (Eventualmente algo puede salir mal y el catalizador puede dejar de funcionar). El reactivo en una reacción catalítica a menudo se denomina sustrato, particularmente en los casos en los que el catalizador es una enzima de un catalizador de metal de transición. La velocidad a la que el catalizador es capaz de llevar a cabo la reacción sobre nuevos sustratos se denomina frecuencia de rotación. Estos son parámetros importantes para describir la eficiencia de un catalizador.
Los catalizadores de polimerización toman pequeñas moléculas llamadas monómeros y las conectan entre sí usando la misma reacción una y otra vez para formar una larga cadena de polímero. ¿Cuál fue el número mínimo de recambio del catalizador utilizado para elaborar cada uno de los siguientes polímeros? (M n = peso molecular promedio en número, una estimación estadística del tamaño promedio de la cadena polimérica).
- polilactida, M n = 3,000, de lactida, C 6 H 8 O 4.
- poliestireno, M n = 250 mil, de estireno, C 6 H 5 C 2 H 3.
- polietileno de alto módulo (HMPE), M n = 6 millones, de eteno, C 2 H 4.
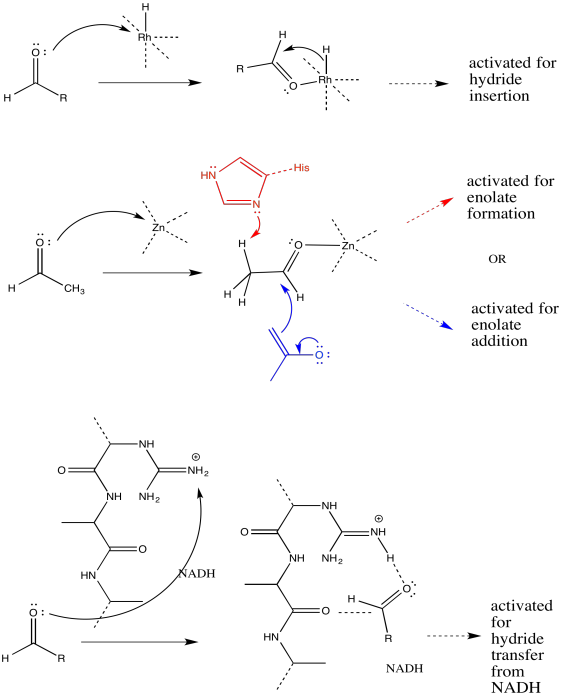
La catálisis a menudo comienza con una etapa de unión, seguida de una o más etapas posteriores necesarias para llevar a cabo la reacción. Para las siguientes reacciones catalizadas, dibuje la etapa de unión usando flechas curvas.
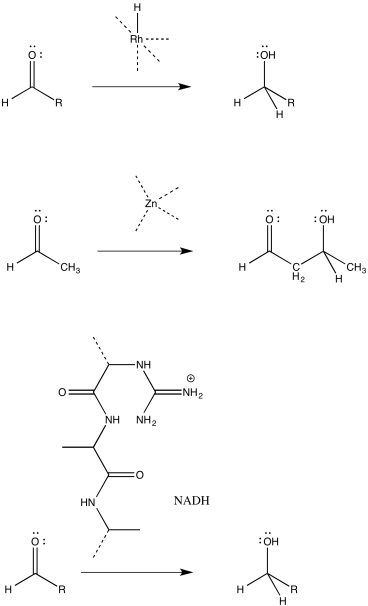
- Contestar
-