2.5: Cinética e Inhibición de Enzimas
- Page ID
- 78777
La cinética de las reacciones que involucran enzimas es un poco diferente de otras reacciones. En primer lugar, a veces hay muchos pasos involucrados. Además, la reacción involucra una molécula enorme y complicada, la enzima. A veces es difícil averiguar qué está pasando dentro de esa enzima.
Sin embargo, podemos pensar en esa reacción y descomponerla en solo unos pocos pasos diferentes. Primero, la enzima tiene que unirse al sustrato. Segundo, la enzima tiene que transformar ese sustrato en el producto. Tercero, el producto debe ser liberado.

Un diagrama de progreso de reacción para este proceso se ve así:

Hay algunas consideraciones energéticas sobre este diagrama en las que debemos pensar. En reacciones normales, los intermedios que se forman a lo largo de la ruta de reacción son más altos en energía que los reactivos o los productos. Podemos pensar en los reactivos subiendo por una cordillera montañosa y deslizándose por el otro lado, hasta llegar a los productos.
En muchos casos de catálisis, el complejo enzima-sustrato (ES) es realmente más bajo en energía que la enzima libre y el sustrato. Eso es por las atracciones intermoleculares que mantienen el sustrato en su lugar dentro de la enzima. Eso es bueno; si la enzima es capaz de sostener firmemente el sustrato, podrá hacer su trabajo. Por supuesto, si el ES es demasiado estable, simplemente se sentará ahí; nunca le pasará nada.
La joroba media del diagrama en realidad representa cualquier número de pasos. En realidad, podríamos representar mejor esos pasos como una serie de colinas y valles individuales. Estamos simplificando un poco al representarlo de esta manera. Sin embargo, a menudo puede darse el caso de que la mayor energía, el paso más lento de esta reacción caiga en algún lugar entre estos pasos.
Cuando observamos la cinética de reacción antes, hicimos la suposición de que cualquier cosa después de la etapa de determinación de la velocidad tuvo poco efecto sobre la velocidad de la reacción. Haremos esa aproximación aquí, también, y pensaremos en dos componentes principales de la reacción. Primero, el sustrato debe estar unido en un complejo enzima-sustrato. Segundo, la enzima tiene que hacer algo con ese sustrato, y convertirlo en otra cosa.

Antes de comenzar a pensar mucho sobre las constantes de velocidad, veremos cómo se ven normalmente los datos en una reacción catalizada por enzimas. Presumiblemente, se requiere sustrato para llegar a cualquier parte de la reacción, por lo que la velocidad de la reacción debería ir más rápida si la concentración del sustrato aumenta. Cuanto más sustrato tengamos reaccionando, más gordos deberíamos hacer producto.
Eso es cierto, pero sólo hasta cierto punto. Supongamos que añadimos cada vez más sustrato a una reacción enzimática. Mira la siguiente gráfica de lo que sucede con la tasa (generalmente representada en bioquímica como v para velocidad).
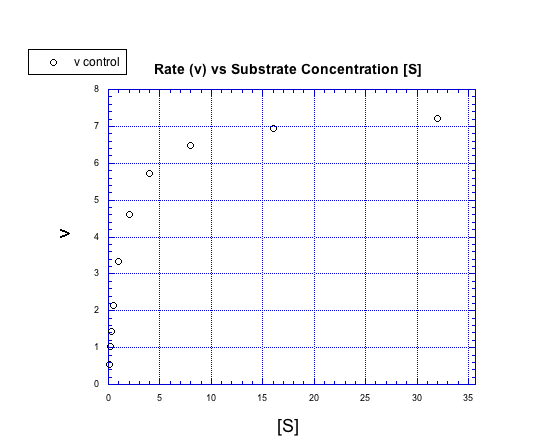
En lugar de formar una línea recta, la gráfica de concentración/tasa es curva. Al principio, la tasa aumenta con el sustrato agregado. Eventualmente, sin embargo, la tasa se nivela, sin importar cuánto sustrato se agregue.
Podemos pensar en que la trama caiga en dos regímenes. Existe el régimen temprano, a baja concentración de sustrato. A través de este rango de concentraciones de sustrato, la tasa aumenta con el sustrato agregado. También existe el régimen tardío, a alta concentración de sustrato. A lo largo de ese rango de concentraciones de sustrato, la tasa permanece plana.
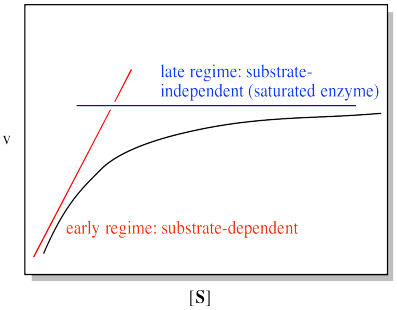
Hay una explicación simple para este comportamiento. Tiene que ver con cómo se llevan a cabo las reacciones enzimáticas, y con las reacciones catalíticas en general. El objetivo de un catalizador es que, además de facilitar una reacción, se regenere. Se recicla: cada molécula enzimática se usa varias veces para convertir muchas moléculas de sustrato en producto. En consecuencia, solo se necesita una cantidad muy pequeña de enzima para llevar a cabo la reacción de manera eficiente. La relación de sustrato a moléculas enzimáticas en una reacción típica puede ser de millones.
Eso es todo muy bueno en términos de eficiencia. Sin embargo, en algún momento, parece que algunas de esas moléculas de sustrato van a quedar esperando mientras las enzimas están ocupadas trabajando en otras. Si la enzima tiene que unirse al sustrato y hacer algún trabajo sobre él, fácilmente podríamos tener una situación en la que todas las moléculas enzimáticas estén llenas. Las moléculas de sustrato adicionales tienen que esperar su turno. En ese punto, agregar sustrato adicional no acelera la reacción. Nos referimos a la enzima como “saturada” en ese punto, lo que significa que no puede agregar más sustrato.
- la reacción alcanza una velocidad máxima a altos niveles de sustrato
- sustrato adicional no aumenta la tasa más allá de ese punto
- la enzima está saturada con sustrato y no puede acomodar más
Por supuesto, si añadimos más enzima, también podríamos manejar más sustrato. Duplicar la cantidad de anzima duplicaría la velocidad máxima de la reacción.
Estudiamos las tasas de reacciones enzimáticas para conocer más sobre cómo funcionan. Una de las cosas más importantes que podemos observar es la respuesta de las enzimas a los inhibidores. Los inhibidores son compuestos que pueden ralentizar la reacción enzimática.
Desde un punto de vista puramente científico, cómo un inhibidor interactúa con la enzima es una pregunta interesante. Sin embargo, hay muchas aplicaciones para esta cuestión en la industria farmacéutica. Supongamos que una enfermedad se puede controlar ralentizando una enzima en particular que está sobreproduciendo algún compuesto pequeño. Los inhibidores podrían producir productos farmacéuticos útiles. No obstante, nos gustaría tener una buena idea de cómo está funcionando esa droga. Ese conocimiento podría decirnos algo sobre cómo construir una mejor droga, por ejemplo.
Los inhibidores pueden funcionar de diferentes maneras. El efecto que tiene un inhibidor en la gráfica de velocidad/concentración puede decirnos algo sobre lo que está haciendo el inhibidor. Por ejemplo, mira la siguiente trama. La reacción regular que involucra la enzima y el sustrato se grafica con círculos negros. Los cuadrados azules muestran la misma reacción en presencia de un inhibidor.

Si comparamos puntos de datos individuales de ambas curvas al mismo valor de [S], es claro que la velocidad de la reacción siempre es más lenta cuando el inhibidor está presente. Por ejemplo, cuando la concentración de sustrato es de aproximadamente 16 unidades, la velocidad de la reacción regular es de aproximadamente 7 unidades, pero la velocidad de la reacción con inhibidor agregado es de solo 6 unidades.
Pero algo interesante está ocurriendo. Para cuando lleguemos al siguiente punto de datos, [S] = 32 unidades, la velocidad de la reacción inhibida casi se ha puesto al día con la normal. Si miras de cerca, la reacción inhibida está cerrando constantemente la brecha a lo largo de la gráfica.
Eso significa que si agregas suficiente sustrato, puedes neutralizar el efecto del inhibidor. ¿Cómo hace eso?
La explicación más simple es que el inhibidor puede unirse a la enzima en lugar del sustrato. Hay una constante de equilibrio para la unión enzima-inhibidor, así como hay una constante de equilibrio para la unión enzima-sustrato. Sin embargo, si agregamos suficiente sustrato, podemos desplazar el inhibidor por completo, uniendo solo sustrato. ¿Recuerdas a Le Chatelier? Cuanto más sustrato tenemos, más se desplaza el equilibrio hacia el complejo enzima-sustrato.
Este tipo de inhibición se llama inhibición competitiva. El inhibidor y el sustrato están compitiendo por el mismo sitio de unión en la enzima.
- Un inhibidor competitivo compite con el sustrato por el sitio de unión en la enzima.
- A medida que aumenta la concentración de sustrato, eventualmente desplaza al inhibidor.
- La velocidad de reacción se aproxima a la velocidad normal a mayores concentraciones de sustrato.
También hay otros tipos de inhibidores. Por ejemplo, el inhibidor en el siguiente caso no se comporta de la misma manera.

No importa cuánto sustrato se agregue en este caso, la reacción con el inhibidor no puede ponerse al día. Aquí está pasando más que solo competencia por el sitio de unión.
En este caso, el inhibidor está interfiriendo directamente con las etapas de formación del producto de la reacción. La reacción inhibida comienza atrás y nunca se pone al día. Este caso se llama inhibición no competitiva.
También hay otras variaciones más sutiles de inhibición. Por ejemplo, en el siguiente caso, la reacción inhibida se comporta un poco diferente que en los otros casos, pero la diferencia es difícil de ver al principio.
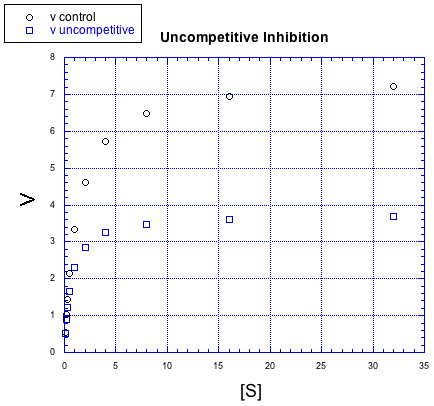
Esta vez, la reacción inhibida parece estar funcionando bien al principio, pero poco a poco se cae. No puede mantenerse al día con la reacción regular. Nuevamente, algo está interfiriendo con los pasos de formación del producto; es por eso que el sustrato agregado finalmente no supera al inhibidor. Pero en las primeras etapas, este caso se ve diferente de la inhibición no competitiva. A este caso se le da el nombre muy similar de “inhibición no competitiva”.
Para conocer un poco más estos inhibidores, tendremos que echar un vistazo a un tratamiento matemático de la cinética.
Caracterizar las siguientes gráficas como representativas de inhibición competitiva o no competitiva.
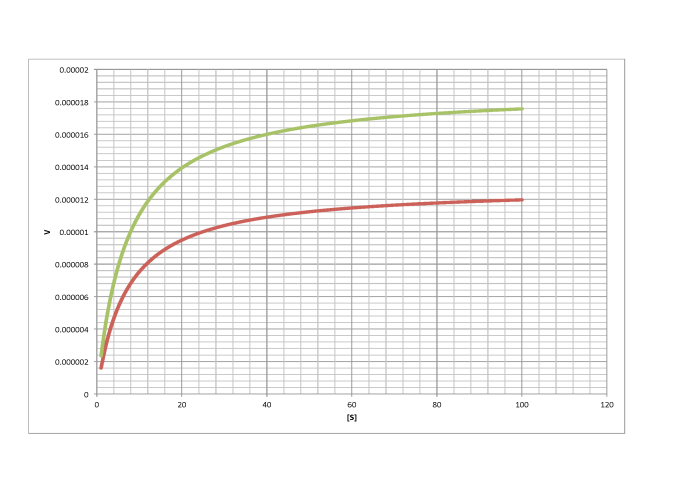
a)
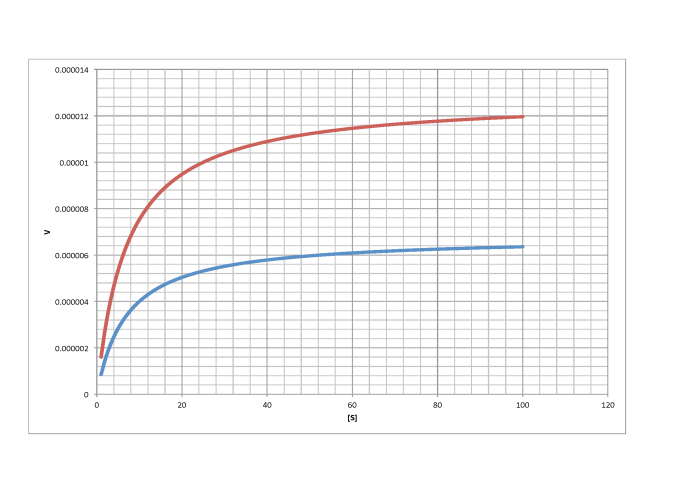
b)
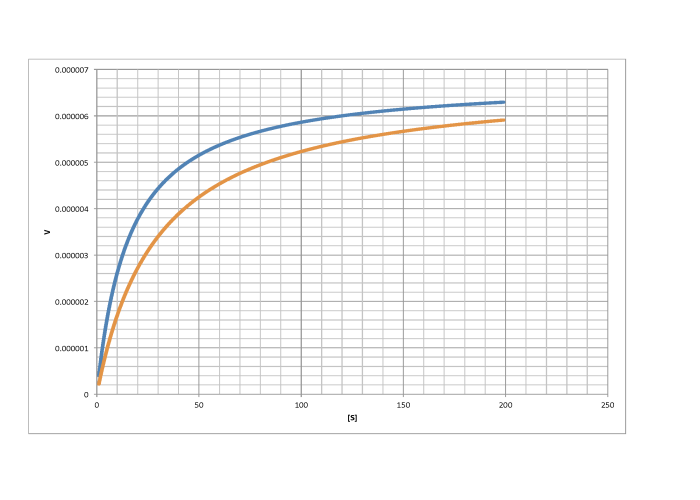
c)
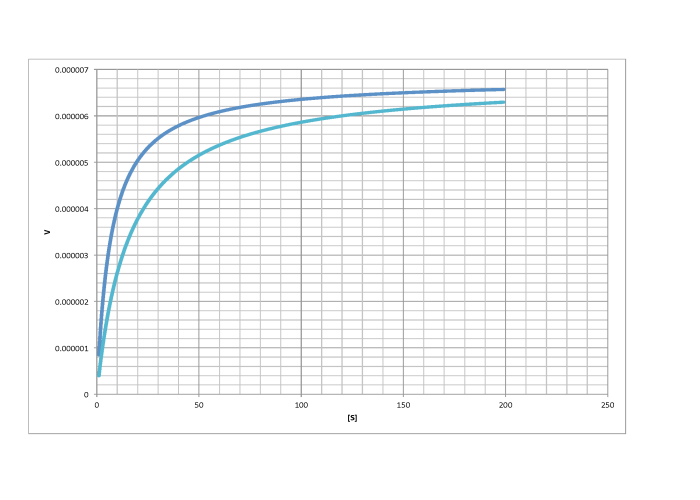
d)
- Contestar a
-
no competitivo
- Respuesta b
-
competitivo
- Respuesta c
-
competitivo
- Respuesta d
-
no competitivo

