4.2: Mecanismo de Sustitución Nucleofílica Alifática
- Page ID
- 78838
La sustitución nucleofílica alifática implica claramente la donación de un par solitario del nucleófilo al carbono tetraédrico electrófilo unido a un halógeno. Podríamos esperar que este carbono sea electrófilo por el halógeno unido a él. Por esa razón, atrae a los nucleófilos. Sin embargo, el mecanismo de la reacción puede ocurrir de un par de maneras diferentes.
Comparar la electronegatividad del carbono con la del flúor, cloro, bromo y yodo.
- Solo sobre esta base, explique por qué el carbono unido al halógeno sería electrófilo.
- ¿Qué compuesto debería ser más electrófilo basado en la electronegatividad: fluorometano, clorometano, bromometano o yodometano?
- Utilice las siguientes fuerzas de enlace para estimar la tendencia cualitativa en las barreras de activación para la sustitución nucleofílica en los cuatro compuestos de la parte (b): C-F 115 kcal/mol; C-Cl 84 kcal/mol; C-Br 72 kcal/mol; C-I 58 kcal/mol.
- Los fluorocarbonos son bastante estables hacia la sustitución nucleofílica alifática; en general, no experimentan esta reacción. Explique por qué.
- Contestar a
-
La electronegatividad del carbono (2.55 en la escala Pauling) es menor que la del flúor (3.98), cloro (3.16), bromo (2.96) o yodo (2.66).
Sobre esa base, el carbono unido a un halógeno es electrófilo porque tiene una carga positiva parcial resultante del enlace polar carbono-halógeno.
- Respuesta b
-
Esperaríamos que un fluoruro de alquilo sea el más electrófilo de estos compuestos, basado en la electronegatividad.
- Respuesta c
-
Suponiendo que la energía requerida para romper el enlace carbono-halógeno juega un papel importante en la barrera de activación (no garantizada), esperaríamos que la barrera de activación sea la más baja con el yoduro de alquilo, luego el bromuro de alquilo, luego el cloruro de alquilo y finalmente el fluoruro de alquilo. Esta predicción contrasta con lo que podríamos esperar basado en la electronegatividad.
- Respuesta d
-
La estabilidad de los fluoruros de alquilo frente a estas reacciones sugiere que existe, de hecho, un papel destacado desempeñado por las fuerzas de enlace, al menos en ese caso. El enlace carbono-fluoruro es lo suficientemente fuerte como para impedir la sustitución nucleofílica en este compuesto.
Al considerar los posibles mecanismos para esta reacción, debemos pensar en los pasos generales de fabricación y ruptura de la unión. En la adición de cianuro de sodio a cloruro de alquilo para hacer un alquilnitrilo, hay una etapa de formación de enlaces (el enlace C-C) y una etapa de ruptura de enlaces (el enlace C-Cl). El mecanismo de reacción más simple implicaría alguna combinación de estos pasos.

Dos posibilidades se presentan de inmediato:
Mecanismo A
El enlace C-C se forma y luego el enlace C-Cl se rompe.
Mecanismo B
El enlace C-Cl se rompe y luego se forma el enlace C-C.
Sin embargo, cierta familiaridad con la vinculación en la segunda fila de la tabla periódica puede sugerirle que el mecanismo A no es muy probable. Ese mecanismo requeriría formar cinco enlaces al carbono antes de que el enlace C-Cl finalmente se rompa. Podemos ignorar con seguridad esta posibilidad.
En cambio, puede haber una tercera posibilidad a considerar.
Mecanismo C
El enlace C-Cl se rompe y el enlace C-C se forma al mismo tiempo.
El Mecanismo C es un mecanismo concertado; dos eventos de creación y ruptura de vínculos ocurren a la vez. No obstante, no se violan las reglas del octeto.
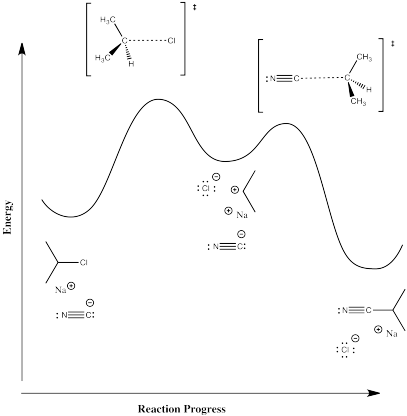
Los diagramas de progreso de reacción para estas dos reacciones se parecerían a las ilustraciones a continuación.
Mecanismo B, ionización y luego adición de nucleófilo:
Mecanismo C, desplazamiento directo del grupo saliente por nucelófilo:
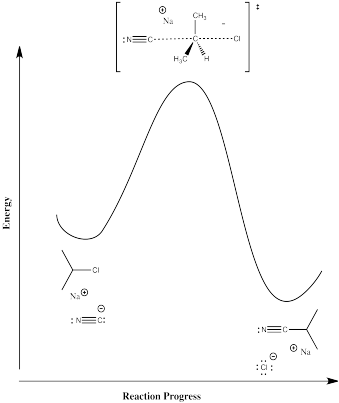
Compare los mecanismos B y C en términos de sus expectativas de los siguientes parámetros:
- Entalpía de activación.
- Entropía de activación.
- Contestar a
-
En el mecanismo B, el disociativo, esperaríamos una mayor entalpía de activación. El primer paso, que parece ser la determinación de la tasa, es un paso de ruptura de enlaces, que costará energía. En el mecanismo C, la ruptura del enlace es compensada por alguna formación de enlaces; en general, esto probablemente cuesta menos energía.
- Respuesta b
-
En el mecanismo B, el caso disociativo, se espera una entropía de activación más positiva. A medida que el enlace al haluro comienza a romperse, los fragmentos de haluro y carbocatión comienzan a moverse independientemente entre sí, ganando grados de libertad y aumentando en entropía. En el mecanismo C, el nucleófilo entrante parece coordinar su movimiento con el del haluro que sale; como resultado, hay menos grados de libertad en este caso.
No hay necesariamente una razón para creer que el mecanismo B es el mecanismo correcto y el mecanismo C es el incorrecto, o viceversa. Cualquiera de ellos puede ser posible. Es posible que tengas que hacer algún trabajo para poder averiguar cuál sucede realmente. Algunos experimentos pueden ayudar a resaltar lo que está sucediendo.
Si se sospecha que los intermedios cargados a lo largo de una ruta de reacción, a veces se puede obtener información ejecutando una reacción en un disolvente más polar y comparando su velocidad con la de la reacción en un disolvente menos polar.
- ¿Están presentes los intermedios cargados, ya sea en el mecanismo B o en el C?
- Explicar cómo cada uno de estos mecanismos podría comportarse en un disolvente más polar.
- Contestar a
-
Los intermedios cargados están presentes en el mecanismo disociativo (B).
- Respuesta b
-
Parece que un disolvente más polar favorecería ambos mecanismos, ya que ambos implican la interacción de un nucleófilo aniónico con un electrófilo y la pérdida de un grupo saliente aniónico. Sin embargo, el caso disociativo (B) implica una acumulación de carga en el intermedio. Es posible que un disolvente más epolar pueda reducir la barrera a esa acumulación de separación de carga, acelerando este mecanismo.
En ocasiones, se puede obtener una distinción entre dos mecanismos posibles comparando las leyes de tasas esperadas de cada mecanismo.
- ¿Cuál cree que es el paso probable que determina la tasa en el mecanismo B?
- ¿Cuál esperas que sea la ley de tarifas para el mecanismo B?
- ¿Cuál cree que es el paso probable que determina la tasa en el mecanismo C?
- ¿Cuál esperas que sea la ley tarifaria para el mecanismo C?
- Contestar a
-
El paso determinante de la tasa es probablemente el de romper el vínculo (el primero).
- Respuesta b
-
Porque el nucleófilo aún no ha participado en ese punto,\(Rate = k[R-X]\), si R-X = el haluro de alquilo.
- Respuesta c
-
Solo hay un paso; es el paso determinante de la tasa, por defecto.
- Respuesta d
-
\(Rate = k[R-X][Nu]\).

