4.18: Sustitución Nucleofílica en Silicio
- Page ID
- 78790
El silicio está en el mismo grupo que el carbono en la tabla periódica, por lo que de alguna manera podría esperarse que se comporte de alguna manera que sea similar al carbono. Puede que no sea sorprendente que el silicio pueda sufrir reacciones de sustitución nucleofílica como el carbono. Sin embargo, existen diferencias tanto en el mecanismo como en las reacciones que son probables que se produzcan.
Probablemente el ejemplo más común de sustitución nucleofílica en el silicio ocurre durante la formación de polímeros de silicona. El silicio forma un enlace bastante fuerte con el oxígeno, por lo que un grupo de salida de cloruro se desplaza fácilmente del silicio para formar un silanol. Si un diclorosilano se expone al agua, se produce un silano diol.

Simplemente ajustando la proporción de silicio que está reaccionando con el agua, podríamos imaginar formar diferentes productos. Una relación 2:1 de H 2 O: Me 2 SiCl 2 podría conducir a un silano diol, Me 2 Si (OH) 2. Sin embargo, una relación 3:2 podría terminar formando un dímero de silicona, Me 2 (HO) SioSiMe 2 (OH). Eso es porque el grupo hidroxi en el primer átomo de silicio sigue siendo un nucleófilo, y podría donar a un segundo átomo de silicio, formando un puente entre dos átomos de silicio.
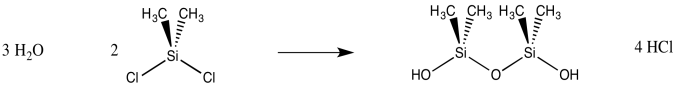
Si el agua se introduce gradualmente en el diclorosilano, resulta la polimerización, porque es más probable que un clorosilano reaccione con un silanol vecino que con moléculas de agua escasas. Se forman muchos puentes Si-O-Si, lo que lleva a un material polimérico: caucho de silicona.

- Las siliconas son polímeros que contienen - (R 2 SiO) - unidades repetitivas.
- Las siliconas se forman a través de la polimerización de compuestos de diclorosilano con agua.
El producto secundario de esta reacción es cloruro de hidrógeno, HCl. Cuando entra en contacto con el agua, el HCl se disocia para dar ácido clorhídrico. El ácido clorhídrico es un ácido fuerte y un riesgo grave para la salud. Debido a eso, existen formulaciones alternativas para hacer silicona que son un poco más seguras. Si el cloro se reemplaza por un grupo acetato, la polimerización aún es posible tras la exposición al agua. Sin embargo, el producto secundario es el ácido acético algo más seguro. Esta ruta se utiliza en siliconas disponibles comercialmente para uso doméstico. Por ejemplo, el calafateo de silicona se puede usar para impermeabilizar alrededor de una bañera o fregadero. El fuerte olor a vinagre cuando se deja curar es el ácido acético que se produce cuando el acetoilsilano reacciona con la humedad del aire.

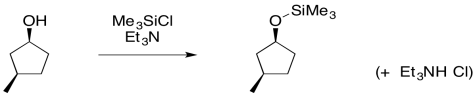
Además de su uso en materiales poliméricos, la sustitución en silicio juega un papel importante en la síntesis orgánica. Los éteres de sililo se pueden hacer de manera similar a la formación de éteres regulares. El enfoque habitual es a través de la adición de un alcohol a un clorosilano. La presencia de una base débil, como una amina terciaria, evita la acumulación de ácido clorhídrico corrosivo. Eso es lo que resultaría si el grupo de salida de cloruro fuera la única base disponible para recoger el protón extra.
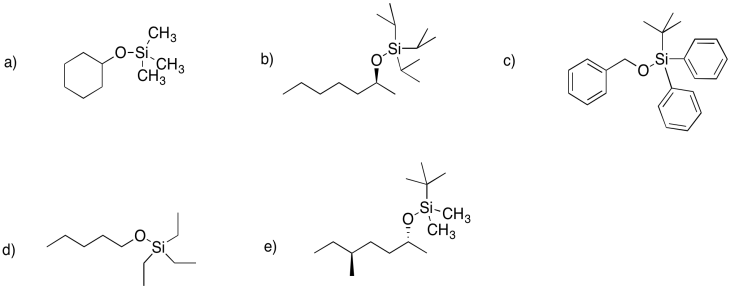
Dibujar estructuras para los siguientes silil éteres.
a) el trimetilsilil éter de ciclohexanol
b) el triisopropilsilil éter de (S) -2-heptanol
c) el terc- butildifenilsililo
d) el trietilsilil éter de pentanol
e) el terc- butildimetilsilil éter de (S) -5-metilheptan2-ol
- Contestar
-
La principal utilidad de los silil éteres es que son tan fáciles de descomponer como de hacer en primer lugar. Se pueden convertir de nuevo en alcoholes en presencia de ácido clorhídrico, aunque el proceso puede ser muy lento. Esa es una de las razones por las que el HCl debe eliminarse durante la formación del éter de siliilo. Aquí hay un equilibrio en el trabajo, y en algún momento una acumulación de HCl conduciría la reacción hacia atrás, evitando la formación adicional del éter silílico.
Los silil éteres se pueden escindir mucho más rápidamente en presencia de ion fluoruro. El reactivo habitual para esta transformación es el fluoruro de tetrabutilamonio (TBAF). El ion tetrabutilammonio es bastante soluble en la mayoría de los solventes orgánicos; eso hace que el reactivo sea mucho más fácil de usar.

La razón por la que la reversibilidad es útil es porque ofrece una manera de “encubrir” temporalmente y al grupo alcohólico. Los alcoholes pueden ser problemáticos durante muchas reacciones. El grupo OH ligeramente ácido, al igual que el grupo OH ligeramente ácido de una molécula de agua, puede interferir con reactivos sensibles. Los compuestos que son altamente básicos, como los compuestos alquilmetálicos (por ejemplo, BuLi, EtMgBr, etc.) y amidas metálicas (por ejemplo, NaNH 2, LDA, etc.) desprotonarán ese grupo OH en lugar de continuar con su negocio previsto con el reactivo. Por ejemplo, si se supone que un reactivo de Grignard se agrega a un carbonilo, pero encuentra un grupo hidroxi, simplemente extraerá el protón del grupo hidroxi. Entonces será neutralizado. Ya no va a ser un nucleófilo, así que no pasará nada después de eso.
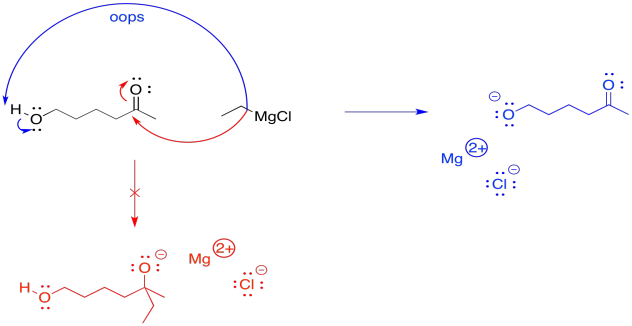
En cambio, si primero se protege el grupo hidroxi, la reacción procederá sin posibilidad de un evento ácido-base accidental. Posteriormente, el grupo hidroxi puede reemplazarse fácilmente.
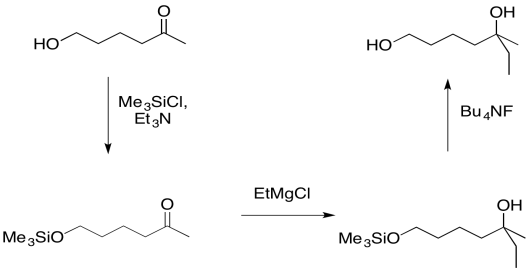
- Los éteres de sililo se pueden usar para proteger alcoholes ligeramente ácidos
- Los éteres de sililo se pueden quitar fácilmente cuando ya no se necesita protección
Los silil éteres comunes incluyen trimetil sililo (Me 3 Si, o TMS); trietilsililo (Et 3 Si, o TES); tri - isopropilsililo (i Pr 3 Si, o TIPS); terc- butildimetilsililo (t BuMe 2 Si, o TBS); y terc- butildifenilsililo (t BuPh 2 Si, TBDPS). El hecho de que una variedad de silil éteres estén comúnmente disponibles permite a los químicos elegir entre diferentes. Como resultado, se podrían usar varios silil éteres diferentes para proteger alcoholes en diferentes posiciones en una molécula más complicada. Entonces pueden elegir qué grupo sililo eliminar, en qué orden. La eliminación selectiva de silil éteres es posible porque son muy sensibles a los efectos estéricos. Cuanto más abarrotado esté el silil éter, más difícil es quitarlo.
- Los éteres de sililo menos concurridos se eliminan con mayor facilidad
- Los éteres de sililo más concurridos se eliminan más lentamente
- Se pueden eliminar los silil éteres menos cromados, dejando intactos los más abarrotados
En cada uno de los siguientes casos, clasificar el orden en que se pudieron eliminar los silil éteres.
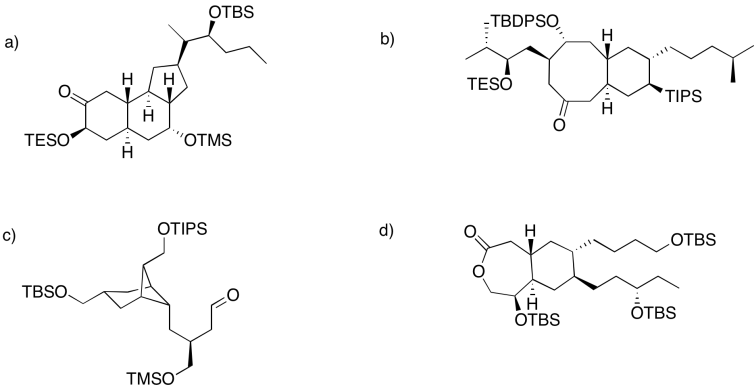
Contestar-
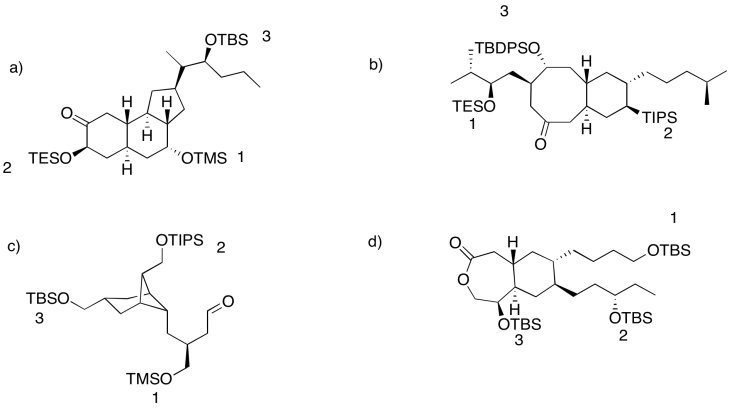
Use un éter de trietilsililo para ayudar a completar las siguientes transformaciones.

Contestar-


