4.17: Sustitución Nucleofílica en Síntesis- Aminas
- Page ID
- 78865
Las aminas se pueden sintetizar a través de la sustitución nucleofílica. Usando un haluro de alquilo y el nucleófilo apropiado, el haluro puede ser reemplazado por un grupo amino.

Si se usara un ion amida como nucleófilo, la eliminación sería algo bastante seguro. Un ion amida es incluso más básico que un ion hidróxido. El átomo de nitrógeno es menos electronegativo que el átomo de oxígeno del hidróxido. Este era el mismo problema con la elaboración de alcoholes y éteres con iones hidróxido o alcóxido, pero ahora el problema es más grave.

En el caso de las síntesis de alcohol y éter, un enfoque fue simplemente usar una forma neutra del nucleófilo en lugar de un anión. Eso podríamos hacer en este caso. El amoníaco todavía tiene un par solitario y es un nucleófilo bastante bueno. No necesitamos una carga negativa sobre el nitrógeno para que éste desplace un halógeno de un haluro de alquilo.
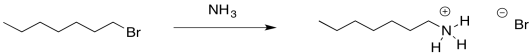
Debido a que el nitrógeno es un poco menos electronegativo que el oxígeno, el amoníaco es un nucleófilo mejor que el agua. Esta sustitución funciona incluso mejor que la sustitución de agua por un haluro. No obstante, existen otros problemas.
El amoníaco es nucleofílico, pero también es básico. Eso puede ser útil. En la síntesis de alcoholes y éteres, la adición de un nucleófilo neutro tuvo que ir acompañada de una base débil, de lo contrario la acumulación de ácido en la reacción podría provocar reacciones secundarias inesperadas, incluida la ruptura de los enlaces éter que estabas tratando de hacer. No obstante, significa que la mitad del amoníaco que pones en la reacción se agotaría en reacciones ácido-base. Tendría que agregar el doble de amoníaco que haluro de alquilo. Una molécula de amoníaco actuaría como nucleófilo en cada reacción, y otra actuaría como base.

Recuerda, el orden de los pasos sí importa aquí. Claro, podrías imaginar algún equilibrio minúsculo en el que un amoníaco ha arrancado un protón de otro, pero un rápido vistazo a una tabla de pKa te dice que eso no es muy probable. El protón solo se eliminará después de que el primer amoníaco haya donado su par solitario y el átomo de nitrógeno neutro se convierta en parte de un ion amonio mucho más ácido.
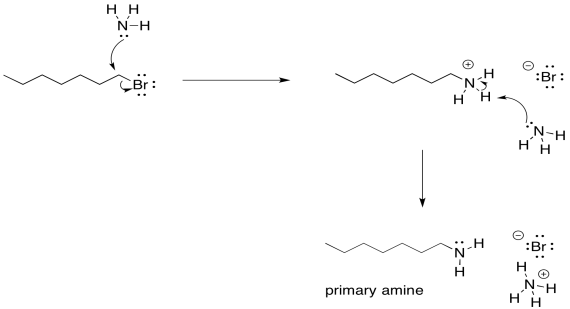
Sin embargo, hay otro problema. Una vez que ese ion amonio ha sido desprotonado, el nitrógeno vuelve a recuperar su par solitario. Se vuelve nucleofílica de nuevo. Debido a que el nitrógeno es bastante nucleófilo, no hay nada que impida que esta amina recién formada reaccione con otro haluro de alquilo. Lo hará, de manera bastante confiable. Eso conducirá a la formación de alguna amina secundaria, además de la amina primaria a la que quizás hayas estado apuntando. Una amina secundaria tiene dos grupos alquilo unidos al nitrógeno, en lugar de solo uno.
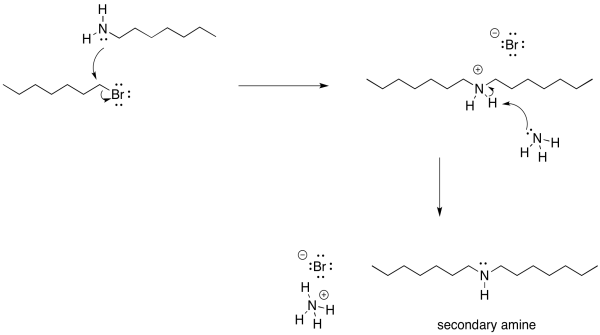
Por supuesto, ahora que hemos empezado por ese camino, no hay vuelta atrás. Tan pronto como ese ion amonio secundario es desprotonado, obtiene un par solitario restaurado. Una vez que tiene un par solitario, se vuelve bastante nucleofílico. Dará a otro haluro de alquilo y formará un ion amonio terciario. Que los iones de amonio terciario se desprotonarán casi de inmediato.
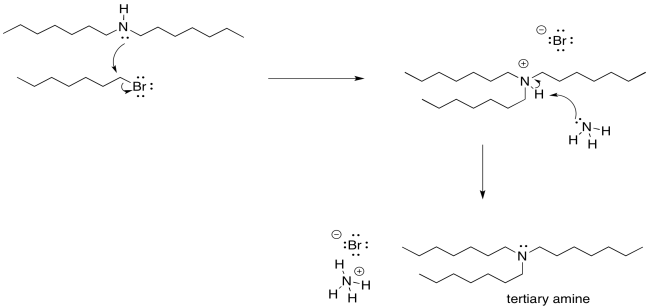
Tan pronto como se forme la amina terciaria, claro que solo va a hacer lo mismo. Donará su par solitario a un haluro de alquilo. Forma un ión de amonio cuaternario. Esta vez, sin embargo, no hay protón en el nitrógeno. No se puede desprotonar fácilmente. Permanece como una sal de amonio cuaternario. Las sales de amonio cuaternario son realmente bastante estables; se utilizan en productos de consumo doméstico todo el tiempo. Los tensioactivos (como los utilizados en los aerosoles de limpieza) y los agentes antiestáticos (que pueden aparecer en las hojas secadoras y champús) suelen utilizar sales de amonio cuaternario.
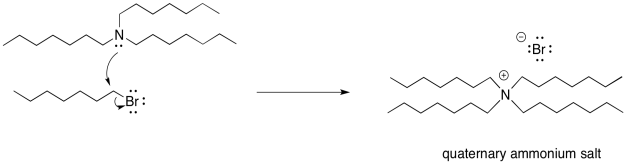
Ahora, volvamos a pensar en nuestra proporción. Supongamos que comenzamos con esa relación 2:1 de amoníaco a haluro de alquilo, sabiendo que tan pronto como una primera molécula de amoníaco se uniera con un alquilo, un segundo amoníaco inmediatamente tomaría un protón. Al formar una sal de amonio cuaternario, en realidad hemos consumido cuatro haluros de alquilo con un nucleófilo de amoníaco. También hemos usado otras tres moléculas de amoníaco como bases. Hemos usado los reactivos en una proporción 1:1 y tendremos la mitad del amoníaco sobrante.
Entonces parece que una relación 2:1 de amoníaco a haluro de alquilo podría conseguirnos una amina primaria, pero una proporción 1:1 podría llevarnos a una sal de amonio cuaternario. ¿Y si hubiéramos parado en una amina secundaria? Entonces usaríamos dos haluros de alquilo como electrófilos, un amoníaco como nucleófilo y dos amoniacos como bases. Esa es una relación 3:2 de amoníaco a haluro de alquilo, o 1, 5:1. Un análisis similar le diría que detenerse en una amina teriaria requeriría una relación de 1. 3:1 de amoníaco a haluro de alquilo.
El punto es que la formación de estas diferentes aminas requieren relaciones de amoníaco a haluro de alquilo que son realmente muy similares. De manera realista, no hay forma de que podamos agregar estas proporciones exactas de reactivos a una reacción y esperar que las cosas se detengan en el lugar correcto. Recuerde, se está produciendo una reacción con millones de moléculas a la vez, y la probabilidad dice que las cuatro vías serán seguidas por fracciones significativas de los reactivos. Todas estas proporciones de amoníaco a haluro de alquilo conducirán a lo mismo: una mezcla de todos los productos posibles. Invariablemente habría algo de amina sobrante o haluro de alquilo sobrante, también, una vez que se hubiera agotado el otro reactivo.
Prácticamente hablando, solo hay dos productos que puedes hacer a partir de esta reacción. Podrías hacer una amina primaria si usaras un gran exceso de amoníaco, de modo que te aseguraste de que cualquier haluro de alquilo era mucho más probable que se encontrara con una molécula de amoníaco mucho antes de que se encontrara con una molécula de amina.

En este caso, tendrías restos de amoníaco. Eso debería ser bastante fácil de quitar debido a su bajo punto de ebullición.
Alternativamente, podrías hacer una sal de amonio cuaternario si usaste un gran exceso de haluro de alquilo.
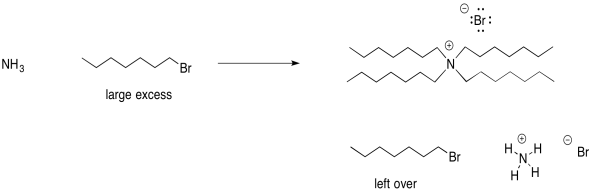
En este escenario, tendrías restos de haluro de alquilo. La diferencia de solubilidad entre el haluro de alquilo y la sal de amonio cuaternario podría ayudar a separar estos dos materiales.
Se puede recordar que en la sección sobre la síntesis de alcoholes y éteres, una estrategia alternativa utilizó un nucleófilo de oxígeno aniónico estabilizado por resonancia para elaborar alcoholes. La misma estrategia se utiliza a menudo con la síntesis de aminas. Este enfoque se denomina síntesis de amina Gabriel.

El nucleófilo en este caso es un ion ftalimida (“Ftal-IM-Id” o “Ftal-IM-Eyed”). El ion ftalimida se forma fácilmente por una base fuerte como el hidróxido de potasio, ya que el anión obtenido es bastante estable. A pesar de que la carga negativa está en un átomo de nitrógeno, los dos carbonilos sirven para deslocalizar la carga y hacer que este ion sea menos reactivo.
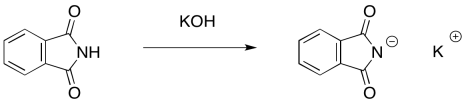
Observe la diferencia de nucleofilia entre la ftalimida neutra y el ion ftalimida. En el compuesto neutro, se deslocaliza el único par solitario sobre el nitrógeno. No está disponible para actuar como nucleófilo. Esto es generalmente cierto con amidas e imidas; el carbonilo vecino une el par solitario de nitrógeno para que no sea básico ni nucleófilo.
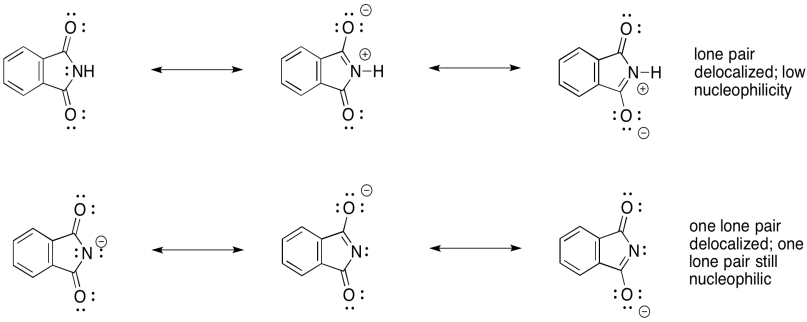
Sin embargo, el ion ftalimida tiene un par solitario de repuesto. Si uno de los pares solitarios está deslocalizado, entonces el otro todavía está disponible para actuar como nucleófilo. Ambos pares solitarios no pueden ser deslocalizados porque son ortogonales entre sí, lo que significa que se ven obligados a estar en diferentes áreas del espacio para minimizar la repulsión de electrones.
El anión ftalimida es así capaz de actuar como nucleófilo. Puede donar a un haluro de alquilo y desplazar el anión haluro.
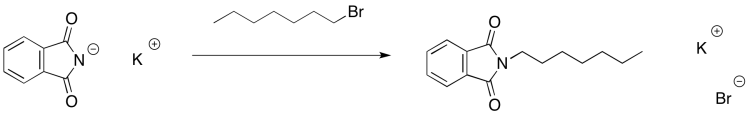
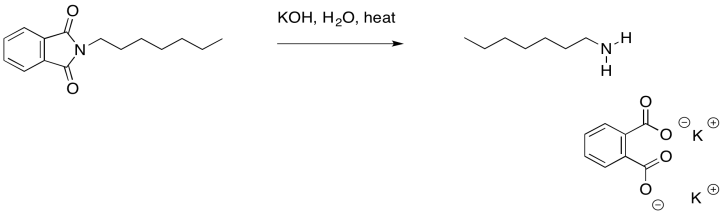
La parte ftalato de la molécula ahora ha cumplido su propósito. Solo estaba ahí para entregar el nitrógeno de una manera que fuera estable, pero adecuadamente reactiva. Podemos deshacernos de él ahora a través de la hidrólisis catalizada por bases. Recuerde, esa es una reacción de sustitución de carboxiloides. La sal ftalato resultante se elimina fácilmente debido a sus propiedades de solubilidad muy diferentes.
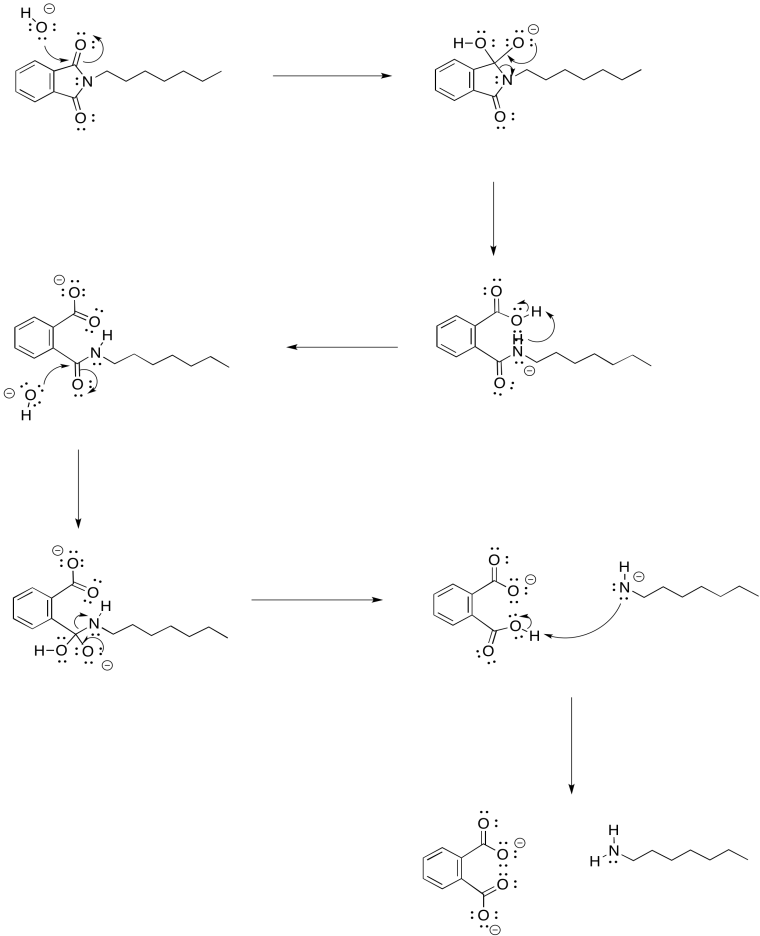
Proporcionar un mecanismo para la hidrólisis de la imida mostrada anteriormente.
- Contestar
-
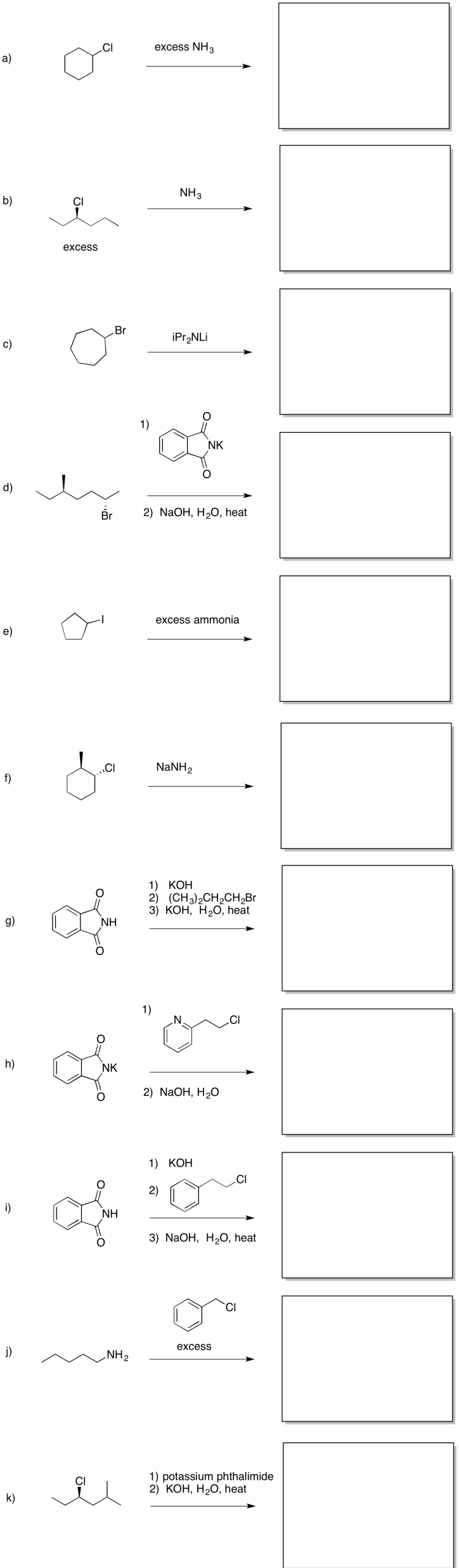
Proporcionar productos de las siguientes reacciones.
Contestar-

Para la reacción del nucleófilo con yodometano en acetona, clasificar los nucleófilos en orden de reactividad (1 = más rápido, 3 = más lento).
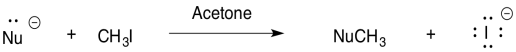
- _ HO - _ HS - _ H 2 O
- _ H 2 O _ H 3 O + _ NH 3
- _ CH 3 CH 2 NH 2 _ (CH 3) 2 CHNH 2 _ (CH 3) 3 CNH 2
- Contestar a
-
2 HO - 1 HS - 3 H 2 O; los aniones son más nucleofílicos que los neutros, pero el azufre es más polarizable que el oxígeno
- Respuesta b
-
2 H 2 O 3 H 3 O + 1 NH 3; los neutrales son más nucleofílicos que el catión, pero el nitrógeno es menos electronegativo que el oxígeno
- Respuesta c
-
1 CH 3 CH 2 NH 2 2 (CH 3) 2 CHNH 2 3 (CH 3) 3 CNH 2; efectos estéricos
Las bases de ADN (adenina, guanina, citosina y timidina) contienen átomos de nitrógeno nucleofílicos, razón por la cual muchos compuestos halogenados son cancerígenos. El ADN alquilado aún puede funcionar en su proceso de replicación, aunque lo hará de manera anormal, dando como resultado mutaciones en el ADN y, en última instancia, en células cancerosas.
a) Proponer un mecanismo, con flechas, para la alquilación de guanina:
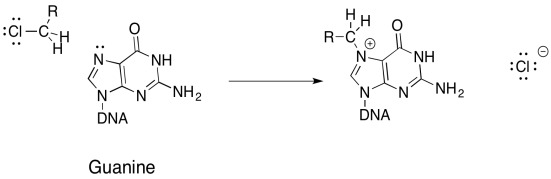
El ADN dañino a través de la alquilación también se puede usar para tratar el cáncer. La clave es que las llamadas al cáncer crecen y se dividen más rápidamente que las llamadas normales, y así son más susceptibles a mecanismos que dañan el ADN y perjudican sus funciones. La mecloretamina es uno de esos fármacos que entrecruza el ADN.
El mecanismo para la activación de la mecloretamina se muestra a continuación:

b) Utilizando esa etapa, proporcionar un mecanismo, con flechas, para la formación de dos moléculas de guanina reticuladas.
c) ¿Qué hace que el anillo de aziridinio sea tan electrofílico?
- Respuesta a & b
-
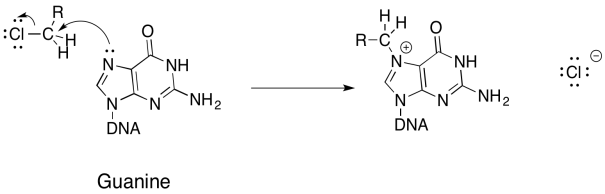
- Respuesta c
-
La tensión del anillo promueve la apertura del anillo.

