5.3: Adición Oxidativa Polar
- Page ID
- 78607
El mecanismo de adición oxidativa polar es muy similar a una reacción de sustitución nucleofílica alifática (S N 1 o S N 2).

Figura\(\PageIndex{1}\): Un ejemplo de adición oxidativa polar.
En una adición oxidativa, el metal puede actuar como nucleófilo en la primera etapa en un proceso de S N 2. En la segunda etapa, el haluro liberado se une al metal. Eso no sucede en una sustitución nucleofílica normal. En este caso, el metal ha donado sus electrones y es capaz de aceptar otro par del haluro.
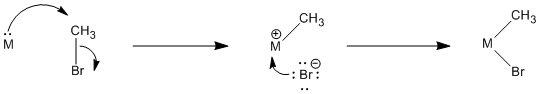
Figura\(\PageIndex{2}\): Etapas mecanicistas en una adición oxidativa polar.
La adición oxidativa polar tiene algunos requisitos similares a una reacción regular de S N 1 o S N 2:
- Requiere un buen grupo de salida
- Requiere carbono tetraédrico (o un protón) como electrófilo
a) ¿Cuál cree que es el paso más difícil (es decir, el paso determinante de la velocidad) para la reacción en la Figura\(\PageIndex{2}\) (OA3.2)? ¿Por qué?
b) Sugerir la ley de tasa probable para esta reacción.
- Contestar a
-
Probablemente el primer paso es el paso más duro (más lento), que implica la ruptura del enlace en el haluro de alquilo. La donación del anión resultante al catión debería ser bastante rápida.
- Respuesta b
-
\[Rate = k_{1}[ML_{n}][CH_{3}Br] \nonumber\]
El compuesto de platino que se muestra a continuación es capaz de eliminar reductivamente una molécula de yodobenceno.

a) Mostrar los productos de esta reacción.
El compuesto de platino de partida es completamente estable en benceno; no se produce ninguna reacción en ese disolvente. Sin embargo, la eliminación reductora ocurre rápidamente cuando el compuesto se disuelve en metanol en su lugar.
b) Explicar por qué los solventes pueden desempeñar un papel en la facilidad con la que reacciona este compuesto.
La reacción en metanol es inhibida por sales yoduro añadidas, tales como yoduro de sodio.
c) Proporcionar un mecanismo para la eliminación reductiva del yodobenceno del complejo de platino, teniendo en cuenta la dependencia del disolvente y la inhibición por ión yoduro.
- Contestar a
-

- Respuesta b
-
El metanol es más polar que el benceno. La aceleración de la reacción en metanol sugiere que hay una polaridad creciente en el estado de transición, o intermedios polares.
- Respuesta c
-
La inhibición por ión yoduro sugiere que el yoduro es un producto de una etapa reversible durante esta reacción. Agregar yoduro empuja ese paso hacia atrás, disminuyendo la tasa de formación del producto. El siguiente mecanismo es consistente con estas observaciones:
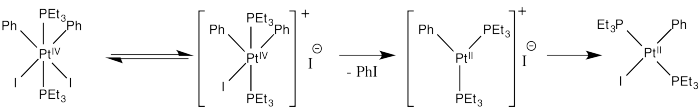
Así se produce la eliminación reductiva a medida que pasamos del segundo al tercer intermedio.
Presumiblemente, el aumento de la carga positiva (y disminución general de la densidad electrónica, debido a la pérdida de un ligando) da como resultado la eliminación reductiva por desestabilización del Pt (IV).
Alternativamente, podríamos suponer que después de la pérdida de yoduro, el ión yoduro dona directamente a un ligando fenilo, desplazando al platino como grupo eliminable en una reacción de S N 2. Eso conduciría directamente al producto desde el primer intermedio, que es una ruta más sencilla. Sin embargo, el precedente para la sustitución nucleofílica alifática implica la donación nucleofílica a los carbonos tetraédricos, no a los planos trigonales. Ese mecanismo es poco probable.
Para la siguiente reacción,
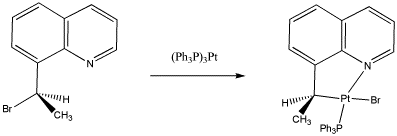
a) Identificar el estado de oxidación en platino en el reactivo y los productos.
b) Asignar configuración estereoquímica en el producto y el reactivo.
c) Explicar la estereoquímica de la reacción.
- Contestar a
-
Pt (0) a Pt (II)
- Respuesta b
-
Cambios de (R) a (S)
- Respuesta c
-
Esta es una reacción de S N 2, por lo que el platino desplaza el bromuro del lado opuesto.
La reacción del siguiente cloruro de alquilo marcado con deuterio con tetraquis (trifenilfosfina) paladio produce un producto enantioméricamente puro (ecuación a). Dibuja el producto esperado.
Sin embargo, la reacción de un haluro de alquilo muy similar produce un compuesto que es solo 90% enantioméricamente puro. Dibuja el producto principal y explica la razón por la que hay alguna racemización

- Contestar
-
En el caso (a), la reacción parece ser S N 2, presumiblemente con inversión completa de la configuración de (S) a (R). En el caso (b), probablemente existe una vía S N 1 competidora porque el catión resultante es tanto bencílico como secundario, por lo que es bastante estable. Por otro lado, si la reacción procediera completamente a través de una vía S N 1, la reacción daría como resultado una racemización casi completa, con 0% ee.
Frecuentemente, las adiciones oxidativas y las eliminaciones reductoras están precedidas o seguidas de otras reacciones. Dibuja un mecanismo para la siguiente transformación.

- Contestar
-


